细菌脂多糖诱导THP1细胞丝裂原信号传导通路活化及细胞因子释放
作者:黄铁生
单位:贵阳医学院检验系 贵阳医学院附属医院临床生化科 贵阳市550004
关键词:
中华医学杂志001125 丝裂原活化的蛋白激酶(MAPK)系列包括一蛋白激酶瀑布群,即癌基因p21ras和或蛋白激酶C (PKC), raf-1蛋白激酶, 丝裂原活化蛋白激酶的激酶-1和-2 (MEK)以及MAPK(也称细胞外信号调节的蛋白激酶ERK)。细菌脂多糖是巨噬细胞的强力活化剂,能刺激巨噬细胞释放多种细胞因子和二十烷类免疫反应介质。已有报道,细菌内毒素脂多糖(LPS)刺激MAPK磷酸化及活化并诱导肿瘤坏死因子(TNFα)和IL-1β产生[1]。为明确LPS及癌基因ras和蛋白激酶raf在调节丝裂原信号传导通路活性中的作用,更好了解LPS激活单核巨噬细胞的机制,用携带显性负向突变的p21ras(A15ras),raf-1(raf1-130)转染THP1髓样单核细胞。观察THP1细胞丝裂原信号传导通路活化及细胞因子的释放。
, http://www.100md.com
一、材料与方法
1.试剂:pSVβ-半乳糖甘酶购自美国Promega公司, 显性负向变基因p21ras(pZIP A 15ras), raf-1 (pCGN raf 1-130)由李永琴教授惠赠。MEK1抑制剂PD98059来自BioLabs公司,细菌脂多糖(LPS)和髓鞘基底蛋白(Myelin basic protein, MBP)购自美国Sigma公司,脂质体(Lipofectin),[γ-32P]-ATP购自DuPont公司,蛋白测定试剂盒购自Bio-Rad公司。
2.方法:(1)质粒转染: THP1单核细胞在含体积分数为5% CO2的潮湿空气,37℃,含10%小牛血清,100 U/ml青霉素, 100 U/ml链霉素的RPMI 1640中传代培养。用脂质体无血清条件下短暂转染法。对照细胞用β-gal转染,其表达不影响细胞因子产生或MAPK活性。β-gal转染细胞酶表达50%~70%。
, 百拇医药
(2)细胞因子测定: 转染细胞中加入LPS, 37℃继续温育最后3 h。用ELISA法检测上清液中TNFα和IL-1β水平。为检查MEK1的作用,在加入LPS之前将细胞与PD98059预温育45 min。对照细胞用二甲亚砜(DMSO)。
(3)MAPK活性测定:107细胞用LPS于37℃刺激10 min后用含蛋白酶抑制剂的裂解液处理。超声波进一步粉碎细胞。离心,Sepharose CL4B层析珠吸附上清液中蛋白。乙烯甘醇依次洗涤吸附珠, 再用乙烯甘醇洗脱蛋白(含MAPK)。测定蛋白量。MAPK活性根据其对特异性底物髓鞘基底蛋白(MBP)的磷酸化作用而测定。蛋白提取液20 μl与测定液35 μl混合。置双重测量管,反应混合物在30℃水浴中振荡20 min。40 μl反应终产物点在磷酸纤维素滤纸上。经正磷酸充分洗涤。干燥后于β液闪仪上检测放射活性。MAPK活性单位以cpm/μg蛋白计算。
3.统计学处理:各组间比较采用方差分析,数据采用Instat 软件处理,以均数±标准误表示。
, http://www.100md.com
二、结果
1.细菌脂多糖激发细胞的MAPK活性: 细菌脂多糖刺激细胞产生约2倍MAPK活性(P<0.01),而丝裂原活化蛋白酶激酶抑制剂(MEK1IN)PD98059削减LPS诱导的MAPK活性4.5倍(P<0.001)见表1。
表1 MEK1抑制剂PD98059抑制细菌脂多糖激发THP1
细胞因子的释放(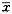 ±s
±s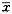 ) 组别
) 组别
例数
细胞因子(pg/ml)
TNF-α
, 百拇医药
IL-1β
对照组
6
1 248±106
1 854±107
丝裂原活化蛋白激酶
6
773± 27
168 593± 48
细菌脂多糖
6
6 153±237*
, 百拇医药
8 947±198*
丝裂原活化蛋白激酶+细菌脂多糖
6
3 363±103
3 826±278
注:与其他3组比较,*P<0.01 2.负向突变的ras和raf基因对MAPK活性的抑制: 显性负向突变A 15ras, raf(1-130)分别抑制LPS诱导的THP1细胞MAPK活性2.9倍和1.2倍(P<0.05), 见表2。表2 负向突变的ras和raf基因对TNFα及IL-1β释放的影响 转移基因
例数
肿瘤坏死因子(pg/ml)
, 百拇医药
白细胞介数(pg/ml)
non-LPS
LPS
non-LPS
LPS
pSV-β-gal
6
1 248±
106
6 153±
237*
1 854±
, 百拇医药
107
8 947±
198*
pZIP-A15ras
6
1 036±
163
1 179±
110
3 249±
944
4 627±
, 百拇医药 109
PCCGN-raf-
1-130
6
1 179±
194
1 468±
214
3 865±
679
4 366±
214
注:与其他2组比较,*P<0.005
, 百拇医药
3.MEK1抑制剂PD98059抑制细菌脂多糖激发THP1细胞因子的释放: MEK1IN明显降低LPS诱导的TNFα和IL-1β产量(P<0.01),见表1。
4.负向突变的ras和raf基因对细胞因子释放的影响: 显性负向突变基因A15ras,raf(1-130)分别抑制LPS诱导THP1细胞释放TNFα和IL-1β(P<0.05),见表2。
三、讨论
单核巨噬细胞在机体免疫调节及宿主抗感染中起重要作用。细菌内毒素脂多糖促进单核巨噬细胞抗菌反应已有广泛报道,但其分子机理仍未完全明确。本研究发现,用LPS激活THP1细胞产生明显高于基础水平的MAPK活性,TNFα和IL-1β也明显伴随增加,与Weistein和Liu等人报道的结果相似[2,3]。近来公认,PD98059的作用是特异性地防止MEK1和MEK2被上游激酶raf-1磷酸化及活化,而MAPK是MEK唯一的效应者[4]。本实验中,MEK抑制剂PD98059阻断LPS诱导的MAPK活性的同时也明显削减TNFα和IL-1β的产量。实验证明,LPS诱导单核巨噬细胞活化通过丝裂原活化的蛋白激酶的磷酸化途径。目前,对LPS在活化丝裂原活化的蛋白激酶通路中是否依赖ras/raf仍有争论。用显性负向突变基因p21ras(A15ras)或raf-1(raf1-130)转染THP1细胞,大幅度降低LPS刺激细胞所诱生的MAPK活性及TNFα和IL-1β产量。对细胞因子的抑制程度与MAPK活性抑制平行。直接证明LPS通过ras和/或raf活化p21ras-MAPK信号传导通路,ras和raf确是位于MAPK上游的信号分子。
, 百拇医药
各种细胞外信号作用于不同类型细胞的不同膜受体活化癌基因p21ras和/或蛋白激酶C(PKC),起始了p21ras—MAPK瀑布式活化。该通路中raf是ras的直接效应者,MEK是MAPK的直接活化者,本实验中LPS是细胞外信号。这些蛋白激酶的活化涉及丝氨酸/苏氨酸的磷酸化。LPS结合于细胞膜表面受体CD14诱导蛋白激酶的磷酸化。该磷酸化对MAPK活性是必需的。LPS通过此磷酸化调节MAPK活性[4]。
我们也用以上负向突变基因转染Jurkat白血病T细胞获得与THP1单核髓样细胞类似的结果。还用活性结构基因p21ras(H-ras61L)或raf(raf22W)转染THP1细胞诱导并协同LPS增强了MAPK活性及提高了THFα产量,但对IL-1β无明显影响,机制不明。
参考文献
1,Hambleton J,McMahon M, DeFranco AL, et al. Activation of Raf-1 and mitogen-activated protein kinase in murin macrophages partially minics lipopolysaccharide-induced signaling events. J EXP Med, 1995, 182: 147-154.
, 百拇医药
2,Weistein SL,Sanghera JS, Lemke K, et al. Bacterial lipopolysaccharide induces tyrosine phosphorylation and activation of motogen-activated protein kinases in macrophages. J Biol Chem, 1992,267:14955-14962.
3,Liu MK, Herrera-Velit P, Brownsey RW, et al. CD14-dependent activation of protein kinase C and mitogen-activated protein kinase (p42 and p44) in human monocytes treated with bacterial lipopolysaccharide. J Immunol, 1994,153 : 2642-2652.
4,Pastor MI, Woodrow M and Cantrell D, Regulation and function of p21ras in T lymphocytes. Cancer Surv,1995, 22:75-83.
(收稿日期:1999-11-25), 百拇医药
单位:贵阳医学院检验系 贵阳医学院附属医院临床生化科 贵阳市550004
关键词:
中华医学杂志001125 丝裂原活化的蛋白激酶(MAPK)系列包括一蛋白激酶瀑布群,即癌基因p21ras和或蛋白激酶C (PKC), raf-1蛋白激酶, 丝裂原活化蛋白激酶的激酶-1和-2 (MEK)以及MAPK(也称细胞外信号调节的蛋白激酶ERK)。细菌脂多糖是巨噬细胞的强力活化剂,能刺激巨噬细胞释放多种细胞因子和二十烷类免疫反应介质。已有报道,细菌内毒素脂多糖(LPS)刺激MAPK磷酸化及活化并诱导肿瘤坏死因子(TNFα)和IL-1β产生[1]。为明确LPS及癌基因ras和蛋白激酶raf在调节丝裂原信号传导通路活性中的作用,更好了解LPS激活单核巨噬细胞的机制,用携带显性负向突变的p21ras(A15ras),raf-1(raf1-130)转染THP1髓样单核细胞。观察THP1细胞丝裂原信号传导通路活化及细胞因子的释放。
, http://www.100md.com
一、材料与方法
1.试剂:pSVβ-半乳糖甘酶购自美国Promega公司, 显性负向变基因p21ras(pZIP A 15ras), raf-1 (pCGN raf 1-130)由李永琴教授惠赠。MEK1抑制剂PD98059来自BioLabs公司,细菌脂多糖(LPS)和髓鞘基底蛋白(Myelin basic protein, MBP)购自美国Sigma公司,脂质体(Lipofectin),[γ-32P]-ATP购自DuPont公司,蛋白测定试剂盒购自Bio-Rad公司。
2.方法:(1)质粒转染: THP1单核细胞在含体积分数为5% CO2的潮湿空气,37℃,含10%小牛血清,100 U/ml青霉素, 100 U/ml链霉素的RPMI 1640中传代培养。用脂质体无血清条件下短暂转染法。对照细胞用β-gal转染,其表达不影响细胞因子产生或MAPK活性。β-gal转染细胞酶表达50%~70%。
, 百拇医药
(2)细胞因子测定: 转染细胞中加入LPS, 37℃继续温育最后3 h。用ELISA法检测上清液中TNFα和IL-1β水平。为检查MEK1的作用,在加入LPS之前将细胞与PD98059预温育45 min。对照细胞用二甲亚砜(DMSO)。
(3)MAPK活性测定:107细胞用LPS于37℃刺激10 min后用含蛋白酶抑制剂的裂解液处理。超声波进一步粉碎细胞。离心,Sepharose CL4B层析珠吸附上清液中蛋白。乙烯甘醇依次洗涤吸附珠, 再用乙烯甘醇洗脱蛋白(含MAPK)。测定蛋白量。MAPK活性根据其对特异性底物髓鞘基底蛋白(MBP)的磷酸化作用而测定。蛋白提取液20 μl与测定液35 μl混合。置双重测量管,反应混合物在30℃水浴中振荡20 min。40 μl反应终产物点在磷酸纤维素滤纸上。经正磷酸充分洗涤。干燥后于β液闪仪上检测放射活性。MAPK活性单位以cpm/μg蛋白计算。
3.统计学处理:各组间比较采用方差分析,数据采用Instat 软件处理,以均数±标准误表示。
, http://www.100md.com
二、结果
1.细菌脂多糖激发细胞的MAPK活性: 细菌脂多糖刺激细胞产生约2倍MAPK活性(P<0.01),而丝裂原活化蛋白酶激酶抑制剂(MEK1IN)PD98059削减LPS诱导的MAPK活性4.5倍(P<0.001)见表1。
表1 MEK1抑制剂PD98059抑制细菌脂多糖激发THP1
细胞因子的释放(
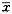 ±s
±s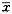 ) 组别
) 组别例数
细胞因子(pg/ml)
TNF-α
, 百拇医药
IL-1β
对照组
6
1 248±106
1 854±107
丝裂原活化蛋白激酶
6
773± 27
168 593± 48
细菌脂多糖
6
6 153±237*
, 百拇医药
8 947±198*
丝裂原活化蛋白激酶+细菌脂多糖
6
3 363±103
3 826±278
注:与其他3组比较,*P<0.01 2.负向突变的ras和raf基因对MAPK活性的抑制: 显性负向突变A 15ras, raf(1-130)分别抑制LPS诱导的THP1细胞MAPK活性2.9倍和1.2倍(P<0.05), 见表2。表2 负向突变的ras和raf基因对TNFα及IL-1β释放的影响 转移基因
例数
肿瘤坏死因子(pg/ml)
, 百拇医药
白细胞介数(pg/ml)
non-LPS
LPS
non-LPS
LPS
pSV-β-gal
6
1 248±
106
6 153±
237*
1 854±
, 百拇医药
107
8 947±
198*
pZIP-A15ras
6
1 036±
163
1 179±
110
3 249±
944
4 627±
, 百拇医药 109
PCCGN-raf-
1-130
6
1 179±
194
1 468±
214
3 865±
679
4 366±
214
注:与其他2组比较,*P<0.005
, 百拇医药
3.MEK1抑制剂PD98059抑制细菌脂多糖激发THP1细胞因子的释放: MEK1IN明显降低LPS诱导的TNFα和IL-1β产量(P<0.01),见表1。
4.负向突变的ras和raf基因对细胞因子释放的影响: 显性负向突变基因A15ras,raf(1-130)分别抑制LPS诱导THP1细胞释放TNFα和IL-1β(P<0.05),见表2。
三、讨论
单核巨噬细胞在机体免疫调节及宿主抗感染中起重要作用。细菌内毒素脂多糖促进单核巨噬细胞抗菌反应已有广泛报道,但其分子机理仍未完全明确。本研究发现,用LPS激活THP1细胞产生明显高于基础水平的MAPK活性,TNFα和IL-1β也明显伴随增加,与Weistein和Liu等人报道的结果相似[2,3]。近来公认,PD98059的作用是特异性地防止MEK1和MEK2被上游激酶raf-1磷酸化及活化,而MAPK是MEK唯一的效应者[4]。本实验中,MEK抑制剂PD98059阻断LPS诱导的MAPK活性的同时也明显削减TNFα和IL-1β的产量。实验证明,LPS诱导单核巨噬细胞活化通过丝裂原活化的蛋白激酶的磷酸化途径。目前,对LPS在活化丝裂原活化的蛋白激酶通路中是否依赖ras/raf仍有争论。用显性负向突变基因p21ras(A15ras)或raf-1(raf1-130)转染THP1细胞,大幅度降低LPS刺激细胞所诱生的MAPK活性及TNFα和IL-1β产量。对细胞因子的抑制程度与MAPK活性抑制平行。直接证明LPS通过ras和/或raf活化p21ras-MAPK信号传导通路,ras和raf确是位于MAPK上游的信号分子。
, 百拇医药
各种细胞外信号作用于不同类型细胞的不同膜受体活化癌基因p21ras和/或蛋白激酶C(PKC),起始了p21ras—MAPK瀑布式活化。该通路中raf是ras的直接效应者,MEK是MAPK的直接活化者,本实验中LPS是细胞外信号。这些蛋白激酶的活化涉及丝氨酸/苏氨酸的磷酸化。LPS结合于细胞膜表面受体CD14诱导蛋白激酶的磷酸化。该磷酸化对MAPK活性是必需的。LPS通过此磷酸化调节MAPK活性[4]。
我们也用以上负向突变基因转染Jurkat白血病T细胞获得与THP1单核髓样细胞类似的结果。还用活性结构基因p21ras(H-ras61L)或raf(raf22W)转染THP1细胞诱导并协同LPS增强了MAPK活性及提高了THFα产量,但对IL-1β无明显影响,机制不明。
参考文献
1,Hambleton J,McMahon M, DeFranco AL, et al. Activation of Raf-1 and mitogen-activated protein kinase in murin macrophages partially minics lipopolysaccharide-induced signaling events. J EXP Med, 1995, 182: 147-154.
, 百拇医药
2,Weistein SL,Sanghera JS, Lemke K, et al. Bacterial lipopolysaccharide induces tyrosine phosphorylation and activation of motogen-activated protein kinases in macrophages. J Biol Chem, 1992,267:14955-14962.
3,Liu MK, Herrera-Velit P, Brownsey RW, et al. CD14-dependent activation of protein kinase C and mitogen-activated protein kinase (p42 and p44) in human monocytes treated with bacterial lipopolysaccharide. J Immunol, 1994,153 : 2642-2652.
4,Pastor MI, Woodrow M and Cantrell D, Regulation and function of p21ras in T lymphocytes. Cancer Surv,1995, 22:75-83.
(收稿日期:1999-11-25), 百拇医药