乙型肝炎病毒核心抗原基因疫苗对小鼠的体液和细胞免疫原性观察
作者:黄祖瑚 卢山 刘宁 王世霞 李军 唐保元
单位:210029 南京医科大学第一附属医院传染病科 (黄祖瑚、刘宁、李军、唐保元),美国马萨诸塞大学医学中心(卢山、王世霞)
关键词:肝炎核心抗原,乙型;基因;疫苗
中华医学杂志NATIONAL MEDICAL JOURNAL OF CHINA1999年 第6期 1999 【摘要】 目的 观察不同品系小鼠(H-2b,H-2d)经乙型肝炎病毒核心抗原(HBcAg)基因疫苗免疫后特异性辅助性T细胞反应类型和特异性细胞毒性T细胞活性。方法 Western blot法鉴定该基因疫苗的体外表达产物;基因枪法和肌内注射法接种该基因疫苗;间接ELISA法检测小鼠血清抗-HBc IgG亚类(IgG1,IgG2a)水平;51铬释放法测定小鼠脾细胞HBcAg特异性细胞毒性T细胞活性。结果 两种品系小鼠经不同方法接种该基因疫苗后均产生高滴度血清抗-HBc (1∶109 350~1∶328 050);抗-HBc IgG亚类以IgG2a占优,肌内注射法接种C57BL/6小鼠后尤然。各组小鼠的HBcAg特异性细胞毒性T细胞杀伤活性均达50%以上。结论 该基因疫苗具有良好的体液免疫和细胞免疫原性,值得进一步探索其临床应用前景。
, 百拇医药
Humoral and cellular immunogenecity of genetic vaccine on core gene of hepatitis B virus in mice
HUANG Zuhu*, LU Shan, LIU Ning, et al. *First Affiliated Hospital,Nanjing Medical University, Nanjing 210029,China
【Abstract】 Objective To observe the specific humoral and cellular immunogenecity of genetic vaccine based on core gene of hepatitis B virus in both C57BL/6(H-2b)and BALB/c(H-2d)mice. Methods The in vitro expressing product of genetic vaccine of HBV core antigen (HBcAg) was identified by Western-blot. Both methods of gene gun and intramuscular immunization were used. Anti-HBc(IgG)and its isotypes (IgG1, IgG2a)in mice sera were detected by indirect ELISA. HBcAg specific cytotoxic T lymphocyte(CTL)activity was measured by 51 Chromium release assay. Results The expression of HBcAg was confirmed by Western-blot. High titers of serum anti-HBc(1∶328 050 by gene gun method and 1∶109 350 by intramuscular method)were raised in both H-2b and H-2d mice after immunization with genetic vaccine of HBcAg. The levels of IgG2a isotype were generally higher than those of IgG1 in all groups of mice with both immunization methods. IgG2a was predominant in C57BL/6 mice after intramuscular immunization. These results suggested the Th1 type of immune response in mice after HBcAg genetic vaccination. HBcAg specific CTL activities were more than 50% in both species of mice with both immunization methods. Conclusion This genetic vaccine of HBcAg shows strong antigenecity in both cellular and humoral immunity. The possibility of its clinical application needs to be further investigated.
, 百拇医药
【Key words】 Hepatitis B, Core antigens Genetic Vaccine
(Natl Med J China, 1999, 79:456-459)
近年来研究发现,基因疫苗(亦称DNA疫苗)能够有效地刺激机体的特异性细胞毒性T细胞(CTL)反应[1]。鉴于乙型肝炎病毒核心抗原(HBcAg)是机体CTL识别的主要靶抗原[2],我们构建了HBcAg基因疫苗,并观察了该基因疫苗经不同接种方法免疫不同品系小鼠后所引起的特异性抗体应答、辅助性T细胞(Th)反应类型和特异性CTL功能,现将结果报告如下。
材料和方法
一、 HBcAg 基因疫苗的构建及其体外表达
将HBcAg基因片段(1 kb,购自中国预防医学科学院病毒研究所) 定向亚克隆进入哺乳动物细胞表达载体pJW4303(美国马萨诸塞大学HL Robinson教授惠赠)的表达框架中(5′HindIII→BamHI 3′),构成重组质粒pJW4303/HBc,即为HBcAg 基因疫苗。将该重组质粒和对照质粒(pJW4303)分别转染哺乳动物细胞系293T细胞,用Western blot法检测被转染细胞裂解产物中的特异性表达产物。
, http://www.100md.com
二、小鼠分组及血清标本采集
选用6~8周龄雌性C57BL/6(H-2b)和BALB/c(H-2d)小鼠。每种品系小鼠各分4组,每组5只,耳洞法编号。组别为基因枪疫苗组、基因枪对照组、肌内注射疫苗组、肌内注射对照组。毛细吸管眼静脉采血法采集小鼠血并分离血清,置-70℃保存待测。
三、基因疫苗的制备、免疫方法及程序
1.HBcAg 基因疫苗的制备:HBcAg 基因疫苗(pJW4303/HBc)及对照质粒(pJW4303)分别转化工程菌HB101,经大量增菌后,采用GIAGEN质粒纯化试剂盒(德国)制备高纯度基因疫苗及对照质粒。
2.免疫方法:(1)基因枪法: 基因枪为美国Agrecetus公司产品,系高压氦气驱动类型。按2 μg质粒DNA:1 mg金颗粒(1 μm)的比例分别制备基因疫苗和对照质粒的基因枪专用细管状子弹,每粒子弹含基因疫苗或对照质粒1 μg。每次免疫时每只小鼠在其腹部皮肤不同部位接受6次基因枪轰击,压力为400 psi(磅/英寸2),总接种剂量为每只小鼠每次6 μg。(2)肌内注射法: 基因疫苗或对照质粒100 μg,以生理盐水配成1 μg/μl,每次在每只小鼠两后肢四头肌处各注射50 μl,总接种剂量为每只小鼠每次100 μg。
, 百拇医药
3.免疫程序:为0周、第4周和第8周,每次免疫时接种方法及剂量相同。每次免疫前及第10周时分别采集小鼠血并分离血清。
四、HBcAg特异性抗体(抗-HBc IgG)及IgG亚类(IgG1,IgG2a)检测
1.抗-HBc IgG检测: 以间接ELISA法检测小鼠血清抗-HBc IgG水平。待测血清作系列3倍稀释(1∶150,1∶450,1∶1 350 …… 1∶8 857 350),取P/N>2.1时的最高血清稀释度为终点滴度。包被用重组HBcAg系南京军区医学研究所张林元研究员惠赠。
2.抗-HBc IgG亚类检测: 以HRP标记的羊抗鼠IgG1或IgG2a为第二抗体,采用间接ELISA法检测各组单个小鼠血清抗-HBc IgG1、IgG2a水平,并根据A (450 nm)值计算IgG2a/IgG1比值。
五、HBcAg特异性CTL杀伤活性测定
, 百拇医药
小鼠经HBcAg 基因疫苗或对照质粒末次免疫后4周(即第12周)时,在麻醉状态、无菌条件下取小鼠脾脏,制成单个脾细胞悬液。不同品系小鼠脾细胞分别用或不用相应的HBcAg特异性CTL表位多肽(H-2b限制性多肽为MGLKFRQL,H-2d限制性多肽为SYVNTNMGL)[3]作刺激培养(37℃,6天),多肽终浓度为10μg/ml。继之以EL-4细胞(H-2b限制性)或P815细胞(H-2d限制性)为靶细胞(分别用或不用上述相应CTL表位多肽作过夜孵育),进行51铬释放试验(4小时法)。效应细胞:靶细胞范围为12∶1~0.5∶1。每组小鼠脾细胞均须测定以下4种效靶组合时的CTL杀伤率,即:A组:多肽刺激效应细胞 比 多肽刺激靶细胞; B组: 多肽刺激效应细胞比 无多肽刺激靶细胞;C组: 无多肽刺激效应细胞比 多肽刺激靶细胞; D组: 无多肽刺激效应细胞比 无多肽刺激靶细胞。
CTL杀伤率(%)=(实验孔铬释放值-自然铬释放值/最大铬释放值-自然铬释放值)×100
, http://www.100md.com
HBcAg特异性CTL杀伤率(%)=(A组杀伤率-B组杀伤率)-(C组杀伤率-D组杀伤率)
结 果
一、HBcAg 基因疫苗的构建及其体外表达
HBcAg 基因疫苗的基因结构图和酶切鉴定图谱见图1和图2。经Western blot检测,经HBcAg基因疫苗转染的293T细胞的裂解产物含一约21kd的特异性蛋白,与HBcAg的分子量相符(图3)。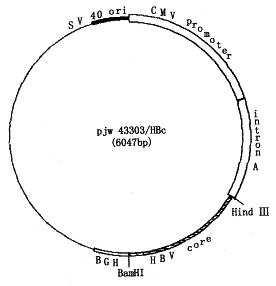
图中所示,pJW4303含SV 40 ori、CMV promoter、Intron A和牛生长激素基因(BGH),HBcAg基因(HBV core)插入在CMV promoter下游多克隆位点区的Hind Ⅲ和BamH I之间
, http://www.100md.com
图1 HBcAg基因疫苗(pJW4303/HBc)的基因结构图
二、各组小鼠血清抗-HBc的终点滴度
末次免疫后2周(第10周)时,各组小鼠血清抗-HBc终点滴度见表1。
三、各组单个小鼠血清抗-HBc IgG亚类比值(IgG2a/IgG1)见表2。
四、各组小鼠脾细胞HBcAg特异性CTL杀伤活性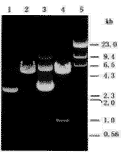
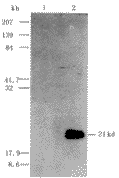
1.对照质粒pJW4303;2. pJW4303的 1.对照质粒转染细胞的裂解产物,BamHI/HindⅢ双酶切产物;3.系基因疫 2.HBcAg DNA疫苗转染细胞的裂解产物
, http://www.100md.com
苗pJW4303/HBc;4.系pJW4303/HBc的 图3 HBcAg基因疫苗在转染细胞中的表达
BamHI/HindⅢ双酶切产物;5.DNA标志物(λ/HindⅢ)
图2 HBcAg基因疫苗(pJW4303/HBc)的酶切图谱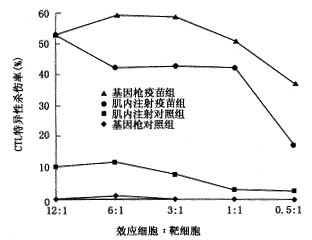
图4 C57BL/6小鼠脾细胞HBcAg特异性CTL杀伤活性
表1 小鼠血清抗-HBc的终点滴度 组别
鼠数
C57BL/6
BALB/c
, http://www.100md.com
基因枪
疫苗组
5
1:328 050
1:328 050
对照组
5
1:450
1:450
肌内注射
疫苗组
5
1:109 350
, 百拇医药
1:109 350
对照组
5
1:450
1:1 350
表2 个体小鼠血清抗-HBc IgG亚类比值 组别
鼠数
C57BL/6
BALB/c
基因枪组
5
1.55± 0.80
, http://www.100md.com
1.12±0.16
肌内注射组
5
19.13±15.06
1.04±0.35
注:表中数值为ELISA(A450nm)测定IgG2a/IgG1比值
C57BL/6小鼠CTL杀伤活性见图4,BALB/c小鼠CTL杀伤活性见图5。
图5 BALB/c小鼠脾细胞HBcAg特异性CTL杀伤活性
讨 论
, 百拇医药
基因疫苗具有激发机体特异性CTL功能的显著特点,这给HBV慢性持续感染患者的治疗带来了新的希望。已有研究表明,尽管HBV慢性感染患者大多存在较强而持久的抗-HBc应答,但其针对HBcAg的特异性CTL应答是低下的[4]。这是导致HBV在体内持续感染的主要机制之一。如何刺激机体的HBcAg特异性的CTL活性以达到清除HBV的目的,是迫切需要解决的理论和临床问题。Kuhober等[5]和Geissler等[6]进行了HBcAg 基因疫苗肌内注射法免疫H-2b小鼠的初步观察。本研究则观察了自行构建的HBcAg基因疫苗经两种方法(基因枪法和肌内注射法)接种两种品系小鼠(C57BL/6小鼠[H-2b]和BALB/c小鼠[H-2d])后的特异性抗体反应和CTL应答。
从结果可见,两种品系小鼠经基因枪法接种HBcAg 基因疫苗后均产生了高达1∶328 050的血清抗-HBc滴度。而接种方法为肌内注射法时两种小鼠血清抗-HBc滴度亦可达1∶109 350,提示该基因疫苗具有良好的体液免疫原性,而基因枪法在刺激抗体形成方面优于肌内注射法。
, 百拇医药
有学者[7]观察到,基因疫苗经基因枪法接种后宿主以Th2型(IgG1占优)反应为主,而经肌内注射法接种后则以Th1型(IgG2a占优)反应为主。本研究有一些新的发现。其一,基因枪法接种基因疫苗不一定引起Th2型反应,如本研究中C57BL/6和BALB/c小鼠均表现为Th1型反应;其二,同为肌内注射法接种基因疫苗,在不同品系小鼠引起的Th1型反应的程度可有不同,如本研究中C57BL/6小鼠和BALB/c小鼠的血清抗-HBc亚类比值(IgG2a/IgG1)之间差异有显著意义(19.13±15.06比1.04±0.35,P<0.05)。这一发现提示,宿主的遗传背景对Th反应类型的形成及反应程度有重要影响。
抗-HBc应答仅反映了该基因疫苗的体液免疫原性,而其特异性CTL应答才是本研究最关键的观察内容。结果发现,两种品系小鼠经基因枪或肌内注射接种该基因疫苗后,均产生了较强的HBcAg特异性CTL活性。在效应细胞:靶细胞=12∶1时,各组小鼠脾细胞的特异性CTL杀伤率均达50%以上。在C57BL/6小鼠,基因枪组的CTL杀伤活性略高于肌内注射组;而在BALB/c小鼠,肌内注射组的CTL杀伤活性又略高于基因枪组,说明遗传背景对不同免疫方法所引起的CTL反应亦有一定影响。
, 百拇医药
本研究比较了基因枪法和肌内注射法接种基因疫苗的免疫结果。在诱导体液免疫方面,基因枪法优于肌内注射法;而在诱导细胞介导免疫(CTL)方面,两者效果相当。然而,基因枪法免疫时所用基因疫苗量仅为肌内注射法用量的1/16(6 μg∶100 μg),可见基因枪法确是一种高效免疫方法。但另一方面,基因枪法免疫需有特殊装置(基因枪、高压氦气等),制备子弹时所需的金颗粒(gold beads)价格昂贵,因而成本较高;而肌内注射法简便易行,成本也相对较低。因此,在选择免疫方法时应视具体情况而定。
本研究结果表明,HBcAg 基因疫苗具有良好的免疫原性,既可诱导机体产生Th1型免疫应答,又能刺激机体产生较强的CTL杀伤活性。这两种免疫应答无疑都有利于机体清除HBV持续感染。今后应进一步探索HBcAg 基因疫苗作为乙型肝炎治疗性基因疫苗的可能性。
注释:本课题为卫生部科学研究基金资助项目(96-1-347)
, http://www.100md.com 参考文献
1 Robinson HL, Torres CAT. DNA vaccine. Seminars in Immunology, 1997,9:271-283.
2 Lee WM. Hepatitis B virus infection. N Engl J Med, 1997,37:1733-1745.
3 Kuhober A, Wild J, Pudollek HP, et al. DNA vaccination with plasmid encoding the
intracellular (HBcAg) or secreted (HBeAg) form of the core protein of hepatitis
B virus primes T cell responses to two overelapping Kb- and Kd- restricted
, 百拇医药
epitopes. Internati Immunol, 1997,9:1203-1212.
4 Milich DR. Immune response to the hepatitis B virus:infection,animal
models,vaccination. Viral Hepat Rev,1997,3:63-103.
5 Kuhober A, Pudollek HP, Reifenberg K, et al. DNA immunization induces antibody
and cytotoxic T cell responses to hepatitis B core antigen in H-2b mice. J
, 百拇医药
Immunol, 1996,156:3687-3695.
6 Geissler M, Tokushige K, Chante CC, et al. Cellular and humoral immune response
to hepatitis B virus structure proteins in mice after DNA-based immunization.
Gastroenterology, 1997,112:1307-1320.
7 Feltquate DM, Heaney S, Webster RG, et al. Different TH cell-types and antibody
isotypes generated by saline and gene gun DNA immunization. J Immunol,1997,158:2278-2284.
收稿:1998-07-09 修回:1999-02-23, 百拇医药
单位:210029 南京医科大学第一附属医院传染病科 (黄祖瑚、刘宁、李军、唐保元),美国马萨诸塞大学医学中心(卢山、王世霞)
关键词:肝炎核心抗原,乙型;基因;疫苗
中华医学杂志NATIONAL MEDICAL JOURNAL OF CHINA1999年 第6期 1999 【摘要】 目的 观察不同品系小鼠(H-2b,H-2d)经乙型肝炎病毒核心抗原(HBcAg)基因疫苗免疫后特异性辅助性T细胞反应类型和特异性细胞毒性T细胞活性。方法 Western blot法鉴定该基因疫苗的体外表达产物;基因枪法和肌内注射法接种该基因疫苗;间接ELISA法检测小鼠血清抗-HBc IgG亚类(IgG1,IgG2a)水平;51铬释放法测定小鼠脾细胞HBcAg特异性细胞毒性T细胞活性。结果 两种品系小鼠经不同方法接种该基因疫苗后均产生高滴度血清抗-HBc (1∶109 350~1∶328 050);抗-HBc IgG亚类以IgG2a占优,肌内注射法接种C57BL/6小鼠后尤然。各组小鼠的HBcAg特异性细胞毒性T细胞杀伤活性均达50%以上。结论 该基因疫苗具有良好的体液免疫和细胞免疫原性,值得进一步探索其临床应用前景。
, 百拇医药
Humoral and cellular immunogenecity of genetic vaccine on core gene of hepatitis B virus in mice
HUANG Zuhu*, LU Shan, LIU Ning, et al. *First Affiliated Hospital,Nanjing Medical University, Nanjing 210029,China
【Abstract】 Objective To observe the specific humoral and cellular immunogenecity of genetic vaccine based on core gene of hepatitis B virus in both C57BL/6(H-2b)and BALB/c(H-2d)mice. Methods The in vitro expressing product of genetic vaccine of HBV core antigen (HBcAg) was identified by Western-blot. Both methods of gene gun and intramuscular immunization were used. Anti-HBc(IgG)and its isotypes (IgG1, IgG2a)in mice sera were detected by indirect ELISA. HBcAg specific cytotoxic T lymphocyte(CTL)activity was measured by 51 Chromium release assay. Results The expression of HBcAg was confirmed by Western-blot. High titers of serum anti-HBc(1∶328 050 by gene gun method and 1∶109 350 by intramuscular method)were raised in both H-2b and H-2d mice after immunization with genetic vaccine of HBcAg. The levels of IgG2a isotype were generally higher than those of IgG1 in all groups of mice with both immunization methods. IgG2a was predominant in C57BL/6 mice after intramuscular immunization. These results suggested the Th1 type of immune response in mice after HBcAg genetic vaccination. HBcAg specific CTL activities were more than 50% in both species of mice with both immunization methods. Conclusion This genetic vaccine of HBcAg shows strong antigenecity in both cellular and humoral immunity. The possibility of its clinical application needs to be further investigated.
, 百拇医药
【Key words】 Hepatitis B, Core antigens Genetic Vaccine
(Natl Med J China, 1999, 79:456-459)
近年来研究发现,基因疫苗(亦称DNA疫苗)能够有效地刺激机体的特异性细胞毒性T细胞(CTL)反应[1]。鉴于乙型肝炎病毒核心抗原(HBcAg)是机体CTL识别的主要靶抗原[2],我们构建了HBcAg基因疫苗,并观察了该基因疫苗经不同接种方法免疫不同品系小鼠后所引起的特异性抗体应答、辅助性T细胞(Th)反应类型和特异性CTL功能,现将结果报告如下。
材料和方法
一、 HBcAg 基因疫苗的构建及其体外表达
将HBcAg基因片段(1 kb,购自中国预防医学科学院病毒研究所) 定向亚克隆进入哺乳动物细胞表达载体pJW4303(美国马萨诸塞大学HL Robinson教授惠赠)的表达框架中(5′HindIII→BamHI 3′),构成重组质粒pJW4303/HBc,即为HBcAg 基因疫苗。将该重组质粒和对照质粒(pJW4303)分别转染哺乳动物细胞系293T细胞,用Western blot法检测被转染细胞裂解产物中的特异性表达产物。
, http://www.100md.com
二、小鼠分组及血清标本采集
选用6~8周龄雌性C57BL/6(H-2b)和BALB/c(H-2d)小鼠。每种品系小鼠各分4组,每组5只,耳洞法编号。组别为基因枪疫苗组、基因枪对照组、肌内注射疫苗组、肌内注射对照组。毛细吸管眼静脉采血法采集小鼠血并分离血清,置-70℃保存待测。
三、基因疫苗的制备、免疫方法及程序
1.HBcAg 基因疫苗的制备:HBcAg 基因疫苗(pJW4303/HBc)及对照质粒(pJW4303)分别转化工程菌HB101,经大量增菌后,采用GIAGEN质粒纯化试剂盒(德国)制备高纯度基因疫苗及对照质粒。
2.免疫方法:(1)基因枪法: 基因枪为美国Agrecetus公司产品,系高压氦气驱动类型。按2 μg质粒DNA:1 mg金颗粒(1 μm)的比例分别制备基因疫苗和对照质粒的基因枪专用细管状子弹,每粒子弹含基因疫苗或对照质粒1 μg。每次免疫时每只小鼠在其腹部皮肤不同部位接受6次基因枪轰击,压力为400 psi(磅/英寸2),总接种剂量为每只小鼠每次6 μg。(2)肌内注射法: 基因疫苗或对照质粒100 μg,以生理盐水配成1 μg/μl,每次在每只小鼠两后肢四头肌处各注射50 μl,总接种剂量为每只小鼠每次100 μg。
, 百拇医药
3.免疫程序:为0周、第4周和第8周,每次免疫时接种方法及剂量相同。每次免疫前及第10周时分别采集小鼠血并分离血清。
四、HBcAg特异性抗体(抗-HBc IgG)及IgG亚类(IgG1,IgG2a)检测
1.抗-HBc IgG检测: 以间接ELISA法检测小鼠血清抗-HBc IgG水平。待测血清作系列3倍稀释(1∶150,1∶450,1∶1 350 …… 1∶8 857 350),取P/N>2.1时的最高血清稀释度为终点滴度。包被用重组HBcAg系南京军区医学研究所张林元研究员惠赠。
2.抗-HBc IgG亚类检测: 以HRP标记的羊抗鼠IgG1或IgG2a为第二抗体,采用间接ELISA法检测各组单个小鼠血清抗-HBc IgG1、IgG2a水平,并根据A (450 nm)值计算IgG2a/IgG1比值。
五、HBcAg特异性CTL杀伤活性测定
, 百拇医药
小鼠经HBcAg 基因疫苗或对照质粒末次免疫后4周(即第12周)时,在麻醉状态、无菌条件下取小鼠脾脏,制成单个脾细胞悬液。不同品系小鼠脾细胞分别用或不用相应的HBcAg特异性CTL表位多肽(H-2b限制性多肽为MGLKFRQL,H-2d限制性多肽为SYVNTNMGL)[3]作刺激培养(37℃,6天),多肽终浓度为10μg/ml。继之以EL-4细胞(H-2b限制性)或P815细胞(H-2d限制性)为靶细胞(分别用或不用上述相应CTL表位多肽作过夜孵育),进行51铬释放试验(4小时法)。效应细胞:靶细胞范围为12∶1~0.5∶1。每组小鼠脾细胞均须测定以下4种效靶组合时的CTL杀伤率,即:A组:多肽刺激效应细胞 比 多肽刺激靶细胞; B组: 多肽刺激效应细胞比 无多肽刺激靶细胞;C组: 无多肽刺激效应细胞比 多肽刺激靶细胞; D组: 无多肽刺激效应细胞比 无多肽刺激靶细胞。
CTL杀伤率(%)=(实验孔铬释放值-自然铬释放值/最大铬释放值-自然铬释放值)×100
, http://www.100md.com
HBcAg特异性CTL杀伤率(%)=(A组杀伤率-B组杀伤率)-(C组杀伤率-D组杀伤率)
结 果
一、HBcAg 基因疫苗的构建及其体外表达
HBcAg 基因疫苗的基因结构图和酶切鉴定图谱见图1和图2。经Western blot检测,经HBcAg基因疫苗转染的293T细胞的裂解产物含一约21kd的特异性蛋白,与HBcAg的分子量相符(图3)。

图中所示,pJW4303含SV 40 ori、CMV promoter、Intron A和牛生长激素基因(BGH),HBcAg基因(HBV core)插入在CMV promoter下游多克隆位点区的Hind Ⅲ和BamH I之间
, http://www.100md.com
图1 HBcAg基因疫苗(pJW4303/HBc)的基因结构图
二、各组小鼠血清抗-HBc的终点滴度
末次免疫后2周(第10周)时,各组小鼠血清抗-HBc终点滴度见表1。
三、各组单个小鼠血清抗-HBc IgG亚类比值(IgG2a/IgG1)见表2。
四、各组小鼠脾细胞HBcAg特异性CTL杀伤活性


1.对照质粒pJW4303;2. pJW4303的 1.对照质粒转染细胞的裂解产物,BamHI/HindⅢ双酶切产物;3.系基因疫 2.HBcAg DNA疫苗转染细胞的裂解产物
, http://www.100md.com
苗pJW4303/HBc;4.系pJW4303/HBc的 图3 HBcAg基因疫苗在转染细胞中的表达
BamHI/HindⅢ双酶切产物;5.DNA标志物(λ/HindⅢ)
图2 HBcAg基因疫苗(pJW4303/HBc)的酶切图谱

图4 C57BL/6小鼠脾细胞HBcAg特异性CTL杀伤活性
表1 小鼠血清抗-HBc的终点滴度 组别
鼠数
C57BL/6
BALB/c
, http://www.100md.com
基因枪
疫苗组
5
1:328 050
1:328 050
对照组
5
1:450
1:450
肌内注射
疫苗组
5
1:109 350
, 百拇医药
1:109 350
对照组
5
1:450
1:1 350
表2 个体小鼠血清抗-HBc IgG亚类比值 组别
鼠数
C57BL/6
BALB/c
基因枪组
5
1.55± 0.80
, http://www.100md.com
1.12±0.16
肌内注射组
5
19.13±15.06
1.04±0.35
注:表中数值为ELISA(A450nm)测定IgG2a/IgG1比值
C57BL/6小鼠CTL杀伤活性见图4,BALB/c小鼠CTL杀伤活性见图5。

图5 BALB/c小鼠脾细胞HBcAg特异性CTL杀伤活性
讨 论
, 百拇医药
基因疫苗具有激发机体特异性CTL功能的显著特点,这给HBV慢性持续感染患者的治疗带来了新的希望。已有研究表明,尽管HBV慢性感染患者大多存在较强而持久的抗-HBc应答,但其针对HBcAg的特异性CTL应答是低下的[4]。这是导致HBV在体内持续感染的主要机制之一。如何刺激机体的HBcAg特异性的CTL活性以达到清除HBV的目的,是迫切需要解决的理论和临床问题。Kuhober等[5]和Geissler等[6]进行了HBcAg 基因疫苗肌内注射法免疫H-2b小鼠的初步观察。本研究则观察了自行构建的HBcAg基因疫苗经两种方法(基因枪法和肌内注射法)接种两种品系小鼠(C57BL/6小鼠[H-2b]和BALB/c小鼠[H-2d])后的特异性抗体反应和CTL应答。
从结果可见,两种品系小鼠经基因枪法接种HBcAg 基因疫苗后均产生了高达1∶328 050的血清抗-HBc滴度。而接种方法为肌内注射法时两种小鼠血清抗-HBc滴度亦可达1∶109 350,提示该基因疫苗具有良好的体液免疫原性,而基因枪法在刺激抗体形成方面优于肌内注射法。
, 百拇医药
有学者[7]观察到,基因疫苗经基因枪法接种后宿主以Th2型(IgG1占优)反应为主,而经肌内注射法接种后则以Th1型(IgG2a占优)反应为主。本研究有一些新的发现。其一,基因枪法接种基因疫苗不一定引起Th2型反应,如本研究中C57BL/6和BALB/c小鼠均表现为Th1型反应;其二,同为肌内注射法接种基因疫苗,在不同品系小鼠引起的Th1型反应的程度可有不同,如本研究中C57BL/6小鼠和BALB/c小鼠的血清抗-HBc亚类比值(IgG2a/IgG1)之间差异有显著意义(19.13±15.06比1.04±0.35,P<0.05)。这一发现提示,宿主的遗传背景对Th反应类型的形成及反应程度有重要影响。
抗-HBc应答仅反映了该基因疫苗的体液免疫原性,而其特异性CTL应答才是本研究最关键的观察内容。结果发现,两种品系小鼠经基因枪或肌内注射接种该基因疫苗后,均产生了较强的HBcAg特异性CTL活性。在效应细胞:靶细胞=12∶1时,各组小鼠脾细胞的特异性CTL杀伤率均达50%以上。在C57BL/6小鼠,基因枪组的CTL杀伤活性略高于肌内注射组;而在BALB/c小鼠,肌内注射组的CTL杀伤活性又略高于基因枪组,说明遗传背景对不同免疫方法所引起的CTL反应亦有一定影响。
, 百拇医药
本研究比较了基因枪法和肌内注射法接种基因疫苗的免疫结果。在诱导体液免疫方面,基因枪法优于肌内注射法;而在诱导细胞介导免疫(CTL)方面,两者效果相当。然而,基因枪法免疫时所用基因疫苗量仅为肌内注射法用量的1/16(6 μg∶100 μg),可见基因枪法确是一种高效免疫方法。但另一方面,基因枪法免疫需有特殊装置(基因枪、高压氦气等),制备子弹时所需的金颗粒(gold beads)价格昂贵,因而成本较高;而肌内注射法简便易行,成本也相对较低。因此,在选择免疫方法时应视具体情况而定。
本研究结果表明,HBcAg 基因疫苗具有良好的免疫原性,既可诱导机体产生Th1型免疫应答,又能刺激机体产生较强的CTL杀伤活性。这两种免疫应答无疑都有利于机体清除HBV持续感染。今后应进一步探索HBcAg 基因疫苗作为乙型肝炎治疗性基因疫苗的可能性。
注释:本课题为卫生部科学研究基金资助项目(96-1-347)
, http://www.100md.com 参考文献
1 Robinson HL, Torres CAT. DNA vaccine. Seminars in Immunology, 1997,9:271-283.
2 Lee WM. Hepatitis B virus infection. N Engl J Med, 1997,37:1733-1745.
3 Kuhober A, Wild J, Pudollek HP, et al. DNA vaccination with plasmid encoding the
intracellular (HBcAg) or secreted (HBeAg) form of the core protein of hepatitis
B virus primes T cell responses to two overelapping Kb- and Kd- restricted
, 百拇医药
epitopes. Internati Immunol, 1997,9:1203-1212.
4 Milich DR. Immune response to the hepatitis B virus:infection,animal
models,vaccination. Viral Hepat Rev,1997,3:63-103.
5 Kuhober A, Pudollek HP, Reifenberg K, et al. DNA immunization induces antibody
and cytotoxic T cell responses to hepatitis B core antigen in H-2b mice. J
, 百拇医药
Immunol, 1996,156:3687-3695.
6 Geissler M, Tokushige K, Chante CC, et al. Cellular and humoral immune response
to hepatitis B virus structure proteins in mice after DNA-based immunization.
Gastroenterology, 1997,112:1307-1320.
7 Feltquate DM, Heaney S, Webster RG, et al. Different TH cell-types and antibody
isotypes generated by saline and gene gun DNA immunization. J Immunol,1997,158:2278-2284.
收稿:1998-07-09 修回:1999-02-23, 百拇医药