阿霉素毫微粒肝动脉灌注后在荷肝肿瘤鼠体内的分布研究
作者:陈江浩 王执民 吴道澄 徐山淡 陈海微 文爱东
单位:710038 西安市,第四军医大学唐都医院介入放射科(陈江浩、王执民、徐山淡);第四军医大学化学教研室(吴道澄);第四军医大学微生物学教研室(陈海微);第四军医大学西京医院临床药理基地(文爱东)
关键词:放射学,介入性;动物,;实验;肝肿瘤;阿霉素;药代动力学;组织分布
中华放射学杂志990306 【摘要】 目的 检测阿霉素毫微粒(NADM)与游离阿霉素(FADM)经肝动脉灌注后在荷肝肿瘤鼠体内的药物分布,并比较其差异。方法 SD纯系大鼠30只,建立W256 移植性肝癌模型并随机分为两组,每组各15只动物;经肝动脉以2mg/kg药物剂量分别注入NADM与FADM,每组于给药后1小时、5小时、15小时各处死5只大鼠,分别提取血浆、肝、心、脾、肺、肾、肝肿瘤样品,采用反相高效液相色谱荧光检测法(RP-HPLC)测定药物浓度。结果 1小时、5小时、15小时NADM组大鼠肝、脾、肝肿瘤中阿霉素浓度均显著高于FADM组(均为P<0.01),而血浆、心、肺中阿霉素浓度则显著降低(P值均<0.01)。肾组织中药物浓度在1小时、5小时以FADM组为高(分别为P<0.05, P<0.01),但15小时时两组间无显著性差异(P>0.05)。NADM组中,给药后1小时、5小时以肝肿瘤药物浓度为最高(分别为20.643 μg/g, 8.841 μg/g),而15小时以肝脏药物浓度为最高(5.054 μg/g);各时间点均以心脏药物浓度为最低,其平均药物浓度值分别为0.163 μg/g,0.071 μg/g,0.025 μg/g。结论 NADM肝动脉给药后改变了阿霉素的体内分布特征,对肝、脾、肝肿瘤表现出明显的靶向性,而心脏的药物分布明显减少。
, http://www.100md.com
Body distribution of nanoparticle-associated adriamycin after administration into the hepatic artery of hepatoma-bearing rats CHEN Jianghao*, WANG Zhimin, WU Daocheng, et al. *Department of Interventional Radiology, Tangdu Hospital, Fourth Military Medical University, Xi'an 710038
【Abstract】 Objective To determine the body distribution of nanoparticle-associated adriamycin (NADM) and free adriamycin (FADM) after administration into the hepatic artery of hepatoma-bearing rats, and compare the difference between them. Methods Walker-256 (W256) carcinosarcoma cells were implanted into the left lobe of 30 male SD rats, which were divided into two groups at random, with 15 rats for each group. NADM and FADM were injected into the hepatic artery of animals on 7th day after tumor inoculation. The dose of adriamycin in each formulation was 2mg/kg body weight, and the concentration was 1.0 mg/ml. At 1, 5, 15 h after drug administration, 5 animals in each group were sacrificed and the adriamycin concentrations in the plasma, liver, heart, spleen, lungs, kidneys, and tumor were determined using a reverse phased high performance liquid chromatography with fluorescence detector (RP-HPLC) technique. Results NADM drastically increased the adriamycin concentrations in the liver, spleen, tumor of rats at 1, 5, and 15 h post injection (P<0.01), as compared to FADM, whereas the concentrations in the plasma, heart, lungs were significantly decreased (P<0.01). In the kidney, relatively higher drug concentration was found in rats accepting FADM after 1, 5 h (P<0.05, P<0.01, respectively) in comparison with those accepting NADM. However, the difference was not significant after 15 h (P>0.05). The highest drug concentrations were found in the tumor at 1, 5 h (20.643 μg/g, 8.841 μg/g, respectively) and in the liver at 15 h (5.054 μg/g); the lowest concentrations were found in the heart at all time periods (0.163 μg/g, 0.071 μg/g, 0.025 μg/g, respectively) after administration with NADM. Conclusions The body distribution of adriamycin could be modified by its encapsulation in nanoparticles and administration via the hepatic artery; most of the drug was accumulated in the liver, spleen, and tumor, whereas the heart concentrations were reduced significantly.
, 百拇医药
【Key words】 Radiology, interventional Animals,laboratory Liver neoplasm DoxorubicinPharmacokinetics Tissue distribution
阿霉素(adriamycin,ADM)是肝癌介入治疗中常用的化疗药,具有抗癌谱广、活性强、疗效确切等优点,但因对心脏及骨髓有较强的毒副作用而使其临床应用常受到限制。毫微粒(nanoparticles)为近年来研究开发的一种新型药物载体,具有无毒、稳定、生物相容性好、可生物降解等特点,还有一定的缓释和组织靶向功能。不少学者发现,毫微粒运载化疗药用于动物肿瘤模型可提高疗效并减轻药物对心脏等器官的毒副作用[1,2]。我们曾将自制的阿霉素聚氰基丙烯酸正丁酯毫微粒(adriamycin-loaded polybutylcyanoacrylate nanoparticle,NADM)采用肝动脉给药途径注射于大鼠W256移植性肝癌模型,发现与游离阿霉素(free adriamycin,FADM)相比,NADM组大鼠肿瘤生长抑制更为显著,动物生存时间显著延长[3]。为进一步阐明其内在机理,我们采用反相高效液相色谱荧光检测法(reverse phased high performance liquid chromatography with fluorescence detector,RP-HPLC)检测了NADM肝动脉灌注后不同时间点的体内药物分布,并与FADM进行对比。经检索未见类似报道。
, 百拇医药
材料与方法
一、材料
仪器:日本Shimadzu LC-6A高效液相色谱仪,RF-530荧光检测器,C-R3A数据处理仪,YMG-C18H37色谱柱(300mm×5mm)。
试剂:盐酸ADM对照品(上海医药工业研究院),盐酸ADM(意大利爱宝药厂),盐酸正定霉素(daunomycin,DM,意大利),氯仿、甲醇、冰醋酸、磷酸二氢铵等均采用分析纯。NADM为我科与化学教研室合作研制,平均粒径(93.1±11.7)nm。
动物:SD纯系大白鼠30只,体重220g~250g,雄性,学校实验动物中心提供;大鼠Walker-256瘤株,购自上海医药工业研究院。
二、方法
, 百拇医药
1. 动物模型及给药方法:全部动物均依文献[4]的方法建立移植性肝癌模型,并随机分为两组,每组15只大鼠。于植瘤后第7天行动脉灌注,以质量分数为2%的戊巴比妥钠按40mg/kg行腹腔注射麻醉,沿腹白线切开2.5~3cm,暴露肝脏。手术显微镜下以自制导管经胃十二指肠动脉行肝固有动脉插管,按分组分别注射FADM和NADM,药物剂量2mg/kg体重,药物浓度均为1mg/ml。
2. 样品采集与预处理:(1) 血样:每组于给药后1小时、5小时、15小时各处死5只大鼠,从心腔抽取全血2ml, 分离血浆后进行预处理: 1.0ml血浆,加内标物DM甲醇溶液20μl(20μg/ml)混匀,加氯仿-甲醇(4∶1)混合液5ml,振摇5分钟后离心(300r/min),取氯仿层以37℃氮气吹干,残渣加50μl甲醇定容,进样40μl供HPLC分析。(2) 组织样品:取肝、心、脾、肺、肾、肝肿瘤组织各1.0g,加磷酸盐缓冲溶液2ml,直流恒温搅拌器6 000r/min匀浆,加内标20μl,再加氯仿-甲醇(4∶1)混合液5ml,提取方法同血样,残渣以100μl甲醇定容,进样40μl供HPLC分析。
, 百拇医药
3. 色谱条件:流动相为甲醇-0.01mol/L磷酸二氢铵-冰醋酸(70∶30∶0.5)混合液,流速1.0ml/min,激发波长450nm,发射波长530nm,室温。
4. 标准曲线的制备:取空白血浆1.0ml或组织1.0g,加入一系列浓度的ADM标准液,使血浆中ADM浓度分别为每毫升50、100、200、600、1 000μg,使组织中药物浓度分别为每克0.4、0.8、1.2、2.0、3.6 μg,加入上述内标液20μl,按血浆及组织中ADM检测项提取、测定。在上述检测条件下得到不同浓度的血浆和肝组织标准色谱图。以样品中ADM峰高与内标DM峰高的比值(HADM/HDM)为应变量(Y),样品中ADM浓度为自变量(X),进行回归,得到回归方程。
5. 数据处理:将求出的两组数据进行组间Student t检验,并据下列公式计算NADM的药物靶向指数(drug targetting index,DTI)和药物选择性指数(drug selective index,DSI):
, 百拇医药
结 果
给药后1小时、5小时、15小时FADM组及NADM组的体内药物分布以及组间差异比较见表1~3。NADM对肝、脾、肝肿瘤的DTI和DSI数据见表4。统计学检查发现:
1. 1小时、5小时、15小时NADM组大鼠肝、脾、肝肿瘤中ADM浓度均显著高于FADM组(P值均<0.01),而血浆、心、肺中ADM浓度显著降低(P值均<0.01)。肾组织ADM浓度1小时、5小时以FADM组为高(分别为P<0.05, P<0.01),但15小时两组间无显著差别(P>0.05)。
2. NADM对肝肿瘤及肝、脾表现出明显的靶向性,给药后1小时其平均药物浓度分别为20.643μg/g、15.323μg/g、8.643μg/g,药物靶向指数分别为9.175、8.185、6.393。以血浆为非靶器官计算,选择性指数分别是53.758、39.904、22.508。
, 百拇医药
3. 给药后1小时、5小时以NADM组大鼠的肝肿瘤药物浓度为最高(分别为20.643μg/g、8.841 μg/g),而15小时以肝脏药物浓度为最高(5.054 μg/g),肝肿瘤中药物浓度下降速度快于肝脏。
4. 心脏1小时、5小时、15小时NADM组平均药物浓度分别为0.163μg/g、0.071μg/g、0.025μg/g,均显著低于FADM组,且均为NADM组中最低浓度值。
表1 肝动脉注射FADM和NADM后1小时大鼠体内
药物分布及组间差异比较(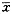 ±s, n=5) 分布部位
±s, n=5) 分布部位
FADM (μg/g)
NADM (μg/g)
, 百拇医药
t值
P值
血浆△
1.273±0.317
0.384 ± 0.187
-5.400
0.001
心
0.570±0.196
0.163 ± 0.050
-4.498
0.002
, 百拇医药
肝
1.872±0.324
15.323 ± 3.081
9.709
0.000
脾
1.352±0.284
8.643 ± 1.818
8.861
0.000
肺
1.560±0.496
, 百拇医药
0.629 ± 0.278
-3.660
0.006
肾
1.841±0.659
0.827 ± 0.214
-3.277
0.011
肿瘤
2.250±1.153
20.643 ± 5.412
7.433
, 百拇医药
0.000
注:△血浆的药物浓度单位为μg/ml;FADM: 游离阿霉素; NADM: 阿霉素毫微粒
表2 肝动脉注射FADM和NADM后5小时大鼠体内
药物分布及组间差异比较(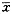 ±s, n=5) 分布部位
±s, n=5) 分布部位
FADM(μg/g)
NADM (μg/g)
t值
P值
血浆△
, http://www.100md.com
0.584±0.209
0.221 ± 0.078
-3.636
0.007
心
0.399±0.111
0.071 ± 0.032
-6.363
0.000
肝
0.864±0.267
8.374 ± 2.948
, http://www.100md.com
5.674
0.000
脾
0.698±0.316
5.237 ± 2.350
4.280
0.003
肺
1.124±0.488
0.332 ± 0.156
-3.460
0.009
, http://www.100md.com
肾
1.301±0.492
0.508 ± 0.177
-3.393
0.009
肿瘤
1.386±0.624
8.841 ± 3.937
4.182
0.003
注:△血浆的药物浓度单位为μg/ml;FADM: 游离阿霉素; NADM: 阿霉素毫微粒
, 百拇医药
表3 肝动脉注射FADM和NADM后15小时大鼠体内
药物分布及组间差异比较(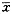 ±s, n=5) 分布部位
±s, n=5) 分布部位
FADM (μg/g)
NADM (μg/g)
t值
P值
血浆△
0.234±0.032
0.139 ± 0.036
-4.439
, 百拇医药
0.002
心
0.118±0.060
0.025 ± 0.010
-3.425
0.009
肝
0.396±0.197
5.054 ± 1.447
7.133
0.000
脾
, 百拇医药
0.311±0.089
2.340 ± 0.739
6.096
0.000
肺
0.473±0.164
0.182 ± 0.077
-3.597
0.007
肾
0.489±0.213
0.311 ± 0.144
, http://www.100md.com
-1.544
0.161
肿瘤
0.446±0.167
3.821 ± 1.083
6.888
0.000
注:△血浆的药物浓度单位为μg/ml;FADM: 游离阿霉素; NADM: 阿霉素毫微粒
表4 给药后1小时、5小时、15小时时NADM对肝、脾、肝肿瘤的DTI和DSI数据(n=5) 部位
DTI
, http://www.100md.com
DSI
1小时
5小时
15小时
1小时
5小时
15小时
肝
8.185
9.692
12.763
39.904
37.891
, http://www.100md.com
36.360
脾
6.393
7.503
7.524
22.508
23.697
16.835
肝肿瘤
9.175
6.379
8.567
53.758
, 百拇医药
40.005
27.489
注:DTI: 药物靶向指数(drug targetting index);DSI: 药物选择性指数(drug selective index),以血浆为非靶器官; NADM: 阿霉素毫微粒讨 论
随着介入放射学的迅速发展,原发性肝癌(PHC)的治疗取得了长足的进步。目前,经导管动脉化疗(transcatheter arterial chemotherary,TAC)已广泛应用于临床并被证实可明显改善无法手术切除的中晚期PHC患者的生存质量。TAC疗效的进一步提高与灌注用药密切相关,寻找适宜的药物剂型为近几年中介入学界的一个研究热点。
毫微粒是一类由天然或合成高分子材料制成的nm级固态胶体微粒,实验表明,其在动物体内的分布有明显的靶向性,主要集中于网状内皮系统,如肝脾等。因此,从理论上分析,TAC与毫微粒技术相结合应可在PHC的治疗中取得良好的协同作用。我们曾进行的药效学研究也初步证实了这一想法[3]。
, 百拇医药
本实验中最令人感兴趣的发现是NADM大大增加了药物在肿瘤组织的分布,这与我们以往的药效学研究结果相吻合[3]。我们分析毫微粒肝肿瘤靶向行为的机理在于: (1) 本实验中采用大鼠W256移植性肝癌模型,其肿瘤血供以肝动脉为主,门脉不参与或仅参与瘤灶外缘的部分营养(类似于人类PHC血供情况)[5],而正常肝组织的血供以门脉为主,因此,NADM从肝动脉灌注后,将主要经过肿瘤组织。(2) 药代动力学研究表明,采用动脉途径给药时,药物表现出明显的首过效应,其靶器官分布量显著高于静脉给药方式,这也是介入治疗学的理论基础[6]。(3) 肝癌恶性程度高,瘤区内血管快速增生,血供丰富,血流量大,对药物产生“虹吸”作用。(4) 瘤区血管迂曲紊乱且粗细不均,血流缓慢,NADM易于停留。(5) 瘤组织中残存的枯否细胞对NADM的吞噬。(6) 载药毫微粒表面的粘附性及小的粒径,增加了药物与瘤血管壁的接触时间与接触面积。(7) 毫微粒有助于药物透过血管壁,增加药物的血管外分布[7]。(8) 毫微粒改变了ADM的消除动力学。曾有报道,FADM的消除半衰期是(23.7±7.7)小时,而NADM的消除半衰期延长为(85.9±19.2)小时[8]。(9) 毫微粒对实体瘤有一定的靶向性,如: Reszka等[9]将NADM静脉注射于荷B16黑色素瘤小鼠,1小时后测得NADM组平均药物浓度为1.248μg/g,而FADM组仅为0.094μg/g。对神经胶质瘤的研究也取得了相似的结果[10]。(10) 毫微粒可改变膜转运机制,增加瘤细胞乃至耐药瘤细胞内的药物积聚[8,11]。(11) Chiannilkulchai等[12]用透射电镜观察到肝脏对NADM具有强大的摄取能力,成为有效的药物贮库; 降解的NADM不断释放游离药物,形成局部药物浓度梯度,促使ADM向瘤组织弥散。我们在实验中发现,瘤组织中药物浓度下降速度明显快于肝脏,其原因可能在于药物的再分布,因此,这种“药物贮库”机理可能在后期起到主要作用。
, http://www.100md.com
此外,本实验进一步证实了毫微粒对网状内皮系统,特别是肝、脾的靶向作用。同时,毫微粒减少了药物在心脏的分布,从而增加了使用安全性。Verdun等[2]采用静脉给药途径亦取得了相似的结果。
综上所述,毫微粒有望在PHC的介入治疗中发挥巨大的作用。
参考文献
1 Sharma D, Chelvi TP, Kaur J, et al. Novel Taxol formulation: polyvinylpyrrolidone nanoparticle-encapsulated Taxol for drug delivery in cancer therapy. Oncol Res,1996,8:281-286.
2 Verdun C, Brasseur F, Vranckx H, et al. Tissue distribution of doxorubicin associated with polyisohexylcyanoacrylate nanoparticles. Cancer Chemother Pharmacol,1990,26:13-18.
, http://www.100md.com
3 陈江浩,王执民,吴道澄,等. 阿霉素毫微粒经动脉给药对大鼠肝肿瘤的疗效. 肿瘤,1998,18:14-16.
4 杨继金,朱永法,左长京,等. 大白鼠转移性肝癌模型的制作. 中华放射学杂志,1993,27: 122-123.
5 曾蒙苏,张宏伟,周康荣,等. 供影像学诊断实验的大鼠移植肝癌模型的可行性研究. 临床放射学杂志,1996,15:56-59.
6 Fety R, Lucas C, Solere P, et al. Hepatic intra-arterial infusion of fotemustine: pharmacokinetics. Cancer Chemother Pharmacol,1992,31:118-122.
7 Andrieu V, Fessi H, Dubrasquet M, et al. Pharmacokinetic evaluation of indomethacin nanocapsules. Drug Des Deliv,1989,4:295-302.
, http://www.100md.com
8 Astier A, Doat B, Ferrer MJ, et al. Enhancement of adriamycin antitumor activity by its binding with an intracellular sustained-release form polymethacrylate nanospheres, in U-937 cells. Cancer Res,1988,48:1835-1841.
9 Reszka R, Beck P, Fichtner I, et al. Body distribution of free, liposomal and nanoparticle-associated mitoxantrone in B16-melanoma-bearing mice. J Pharmacol Exp Ther,1997,280:232-237.
10 Zimmer C, Weissleder R, Poss K, et al. MR imaging of phagocytosis in experimental gliomas. Radiology,1995,197:533-538.
, http://www.100md.com
11 de Verdiere AC, Dubernet C, Nemati F, et al. Reversion of multidrug resistance with polyalkylcyanoacrylate nanoparticles: towards a mechanism of action. Br J Cancer,1997,76:198-205.
12 Chiannilkulchai N, Ammoury N, Caillou B, et al. Hepatic tissue distribution of doxorubicin-loaded nanoparticles after i.v. administration in reticulosarcoma M 5076 metastasis-bearing mice. Cancer Chemother Pharmacol,1990,26:122-126.
(收稿:1998-06-09 修回:1998-10-16), 百拇医药
单位:710038 西安市,第四军医大学唐都医院介入放射科(陈江浩、王执民、徐山淡);第四军医大学化学教研室(吴道澄);第四军医大学微生物学教研室(陈海微);第四军医大学西京医院临床药理基地(文爱东)
关键词:放射学,介入性;动物,;实验;肝肿瘤;阿霉素;药代动力学;组织分布
中华放射学杂志990306 【摘要】 目的 检测阿霉素毫微粒(NADM)与游离阿霉素(FADM)经肝动脉灌注后在荷肝肿瘤鼠体内的药物分布,并比较其差异。方法 SD纯系大鼠30只,建立W256 移植性肝癌模型并随机分为两组,每组各15只动物;经肝动脉以2mg/kg药物剂量分别注入NADM与FADM,每组于给药后1小时、5小时、15小时各处死5只大鼠,分别提取血浆、肝、心、脾、肺、肾、肝肿瘤样品,采用反相高效液相色谱荧光检测法(RP-HPLC)测定药物浓度。结果 1小时、5小时、15小时NADM组大鼠肝、脾、肝肿瘤中阿霉素浓度均显著高于FADM组(均为P<0.01),而血浆、心、肺中阿霉素浓度则显著降低(P值均<0.01)。肾组织中药物浓度在1小时、5小时以FADM组为高(分别为P<0.05, P<0.01),但15小时时两组间无显著性差异(P>0.05)。NADM组中,给药后1小时、5小时以肝肿瘤药物浓度为最高(分别为20.643 μg/g, 8.841 μg/g),而15小时以肝脏药物浓度为最高(5.054 μg/g);各时间点均以心脏药物浓度为最低,其平均药物浓度值分别为0.163 μg/g,0.071 μg/g,0.025 μg/g。结论 NADM肝动脉给药后改变了阿霉素的体内分布特征,对肝、脾、肝肿瘤表现出明显的靶向性,而心脏的药物分布明显减少。
, http://www.100md.com
Body distribution of nanoparticle-associated adriamycin after administration into the hepatic artery of hepatoma-bearing rats CHEN Jianghao*, WANG Zhimin, WU Daocheng, et al. *Department of Interventional Radiology, Tangdu Hospital, Fourth Military Medical University, Xi'an 710038
【Abstract】 Objective To determine the body distribution of nanoparticle-associated adriamycin (NADM) and free adriamycin (FADM) after administration into the hepatic artery of hepatoma-bearing rats, and compare the difference between them. Methods Walker-256 (W256) carcinosarcoma cells were implanted into the left lobe of 30 male SD rats, which were divided into two groups at random, with 15 rats for each group. NADM and FADM were injected into the hepatic artery of animals on 7th day after tumor inoculation. The dose of adriamycin in each formulation was 2mg/kg body weight, and the concentration was 1.0 mg/ml. At 1, 5, 15 h after drug administration, 5 animals in each group were sacrificed and the adriamycin concentrations in the plasma, liver, heart, spleen, lungs, kidneys, and tumor were determined using a reverse phased high performance liquid chromatography with fluorescence detector (RP-HPLC) technique. Results NADM drastically increased the adriamycin concentrations in the liver, spleen, tumor of rats at 1, 5, and 15 h post injection (P<0.01), as compared to FADM, whereas the concentrations in the plasma, heart, lungs were significantly decreased (P<0.01). In the kidney, relatively higher drug concentration was found in rats accepting FADM after 1, 5 h (P<0.05, P<0.01, respectively) in comparison with those accepting NADM. However, the difference was not significant after 15 h (P>0.05). The highest drug concentrations were found in the tumor at 1, 5 h (20.643 μg/g, 8.841 μg/g, respectively) and in the liver at 15 h (5.054 μg/g); the lowest concentrations were found in the heart at all time periods (0.163 μg/g, 0.071 μg/g, 0.025 μg/g, respectively) after administration with NADM. Conclusions The body distribution of adriamycin could be modified by its encapsulation in nanoparticles and administration via the hepatic artery; most of the drug was accumulated in the liver, spleen, and tumor, whereas the heart concentrations were reduced significantly.
, 百拇医药
【Key words】 Radiology, interventional Animals,laboratory Liver neoplasm DoxorubicinPharmacokinetics Tissue distribution
阿霉素(adriamycin,ADM)是肝癌介入治疗中常用的化疗药,具有抗癌谱广、活性强、疗效确切等优点,但因对心脏及骨髓有较强的毒副作用而使其临床应用常受到限制。毫微粒(nanoparticles)为近年来研究开发的一种新型药物载体,具有无毒、稳定、生物相容性好、可生物降解等特点,还有一定的缓释和组织靶向功能。不少学者发现,毫微粒运载化疗药用于动物肿瘤模型可提高疗效并减轻药物对心脏等器官的毒副作用[1,2]。我们曾将自制的阿霉素聚氰基丙烯酸正丁酯毫微粒(adriamycin-loaded polybutylcyanoacrylate nanoparticle,NADM)采用肝动脉给药途径注射于大鼠W256移植性肝癌模型,发现与游离阿霉素(free adriamycin,FADM)相比,NADM组大鼠肿瘤生长抑制更为显著,动物生存时间显著延长[3]。为进一步阐明其内在机理,我们采用反相高效液相色谱荧光检测法(reverse phased high performance liquid chromatography with fluorescence detector,RP-HPLC)检测了NADM肝动脉灌注后不同时间点的体内药物分布,并与FADM进行对比。经检索未见类似报道。
, 百拇医药
材料与方法
一、材料
仪器:日本Shimadzu LC-6A高效液相色谱仪,RF-530荧光检测器,C-R3A数据处理仪,YMG-C18H37色谱柱(300mm×5mm)。
试剂:盐酸ADM对照品(上海医药工业研究院),盐酸ADM(意大利爱宝药厂),盐酸正定霉素(daunomycin,DM,意大利),氯仿、甲醇、冰醋酸、磷酸二氢铵等均采用分析纯。NADM为我科与化学教研室合作研制,平均粒径(93.1±11.7)nm。
动物:SD纯系大白鼠30只,体重220g~250g,雄性,学校实验动物中心提供;大鼠Walker-256瘤株,购自上海医药工业研究院。
二、方法
, 百拇医药
1. 动物模型及给药方法:全部动物均依文献[4]的方法建立移植性肝癌模型,并随机分为两组,每组15只大鼠。于植瘤后第7天行动脉灌注,以质量分数为2%的戊巴比妥钠按40mg/kg行腹腔注射麻醉,沿腹白线切开2.5~3cm,暴露肝脏。手术显微镜下以自制导管经胃十二指肠动脉行肝固有动脉插管,按分组分别注射FADM和NADM,药物剂量2mg/kg体重,药物浓度均为1mg/ml。
2. 样品采集与预处理:(1) 血样:每组于给药后1小时、5小时、15小时各处死5只大鼠,从心腔抽取全血2ml, 分离血浆后进行预处理: 1.0ml血浆,加内标物DM甲醇溶液20μl(20μg/ml)混匀,加氯仿-甲醇(4∶1)混合液5ml,振摇5分钟后离心(300r/min),取氯仿层以37℃氮气吹干,残渣加50μl甲醇定容,进样40μl供HPLC分析。(2) 组织样品:取肝、心、脾、肺、肾、肝肿瘤组织各1.0g,加磷酸盐缓冲溶液2ml,直流恒温搅拌器6 000r/min匀浆,加内标20μl,再加氯仿-甲醇(4∶1)混合液5ml,提取方法同血样,残渣以100μl甲醇定容,进样40μl供HPLC分析。
, 百拇医药
3. 色谱条件:流动相为甲醇-0.01mol/L磷酸二氢铵-冰醋酸(70∶30∶0.5)混合液,流速1.0ml/min,激发波长450nm,发射波长530nm,室温。
4. 标准曲线的制备:取空白血浆1.0ml或组织1.0g,加入一系列浓度的ADM标准液,使血浆中ADM浓度分别为每毫升50、100、200、600、1 000μg,使组织中药物浓度分别为每克0.4、0.8、1.2、2.0、3.6 μg,加入上述内标液20μl,按血浆及组织中ADM检测项提取、测定。在上述检测条件下得到不同浓度的血浆和肝组织标准色谱图。以样品中ADM峰高与内标DM峰高的比值(HADM/HDM)为应变量(Y),样品中ADM浓度为自变量(X),进行回归,得到回归方程。
5. 数据处理:将求出的两组数据进行组间Student t检验,并据下列公式计算NADM的药物靶向指数(drug targetting index,DTI)和药物选择性指数(drug selective index,DSI):

, 百拇医药
结 果
给药后1小时、5小时、15小时FADM组及NADM组的体内药物分布以及组间差异比较见表1~3。NADM对肝、脾、肝肿瘤的DTI和DSI数据见表4。统计学检查发现:
1. 1小时、5小时、15小时NADM组大鼠肝、脾、肝肿瘤中ADM浓度均显著高于FADM组(P值均<0.01),而血浆、心、肺中ADM浓度显著降低(P值均<0.01)。肾组织ADM浓度1小时、5小时以FADM组为高(分别为P<0.05, P<0.01),但15小时两组间无显著差别(P>0.05)。
2. NADM对肝肿瘤及肝、脾表现出明显的靶向性,给药后1小时其平均药物浓度分别为20.643μg/g、15.323μg/g、8.643μg/g,药物靶向指数分别为9.175、8.185、6.393。以血浆为非靶器官计算,选择性指数分别是53.758、39.904、22.508。
, 百拇医药
3. 给药后1小时、5小时以NADM组大鼠的肝肿瘤药物浓度为最高(分别为20.643μg/g、8.841 μg/g),而15小时以肝脏药物浓度为最高(5.054 μg/g),肝肿瘤中药物浓度下降速度快于肝脏。
4. 心脏1小时、5小时、15小时NADM组平均药物浓度分别为0.163μg/g、0.071μg/g、0.025μg/g,均显著低于FADM组,且均为NADM组中最低浓度值。
表1 肝动脉注射FADM和NADM后1小时大鼠体内
药物分布及组间差异比较(
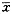 ±s, n=5) 分布部位
±s, n=5) 分布部位FADM (μg/g)
NADM (μg/g)
, 百拇医药
t值
P值
血浆△
1.273±0.317
0.384 ± 0.187
-5.400
0.001
心
0.570±0.196
0.163 ± 0.050
-4.498
0.002
, 百拇医药
肝
1.872±0.324
15.323 ± 3.081
9.709
0.000
脾
1.352±0.284
8.643 ± 1.818
8.861
0.000
肺
1.560±0.496
, 百拇医药
0.629 ± 0.278
-3.660
0.006
肾
1.841±0.659
0.827 ± 0.214
-3.277
0.011
肿瘤
2.250±1.153
20.643 ± 5.412
7.433
, 百拇医药
0.000
注:△血浆的药物浓度单位为μg/ml;FADM: 游离阿霉素; NADM: 阿霉素毫微粒
表2 肝动脉注射FADM和NADM后5小时大鼠体内
药物分布及组间差异比较(
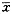 ±s, n=5) 分布部位
±s, n=5) 分布部位FADM(μg/g)
NADM (μg/g)
t值
P值
血浆△
, http://www.100md.com
0.584±0.209
0.221 ± 0.078
-3.636
0.007
心
0.399±0.111
0.071 ± 0.032
-6.363
0.000
肝
0.864±0.267
8.374 ± 2.948
, http://www.100md.com
5.674
0.000
脾
0.698±0.316
5.237 ± 2.350
4.280
0.003
肺
1.124±0.488
0.332 ± 0.156
-3.460
0.009
, http://www.100md.com
肾
1.301±0.492
0.508 ± 0.177
-3.393
0.009
肿瘤
1.386±0.624
8.841 ± 3.937
4.182
0.003
注:△血浆的药物浓度单位为μg/ml;FADM: 游离阿霉素; NADM: 阿霉素毫微粒
, 百拇医药
表3 肝动脉注射FADM和NADM后15小时大鼠体内
药物分布及组间差异比较(
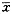 ±s, n=5) 分布部位
±s, n=5) 分布部位FADM (μg/g)
NADM (μg/g)
t值
P值
血浆△
0.234±0.032
0.139 ± 0.036
-4.439
, 百拇医药
0.002
心
0.118±0.060
0.025 ± 0.010
-3.425
0.009
肝
0.396±0.197
5.054 ± 1.447
7.133
0.000
脾
, 百拇医药
0.311±0.089
2.340 ± 0.739
6.096
0.000
肺
0.473±0.164
0.182 ± 0.077
-3.597
0.007
肾
0.489±0.213
0.311 ± 0.144
, http://www.100md.com
-1.544
0.161
肿瘤
0.446±0.167
3.821 ± 1.083
6.888
0.000
注:△血浆的药物浓度单位为μg/ml;FADM: 游离阿霉素; NADM: 阿霉素毫微粒
表4 给药后1小时、5小时、15小时时NADM对肝、脾、肝肿瘤的DTI和DSI数据(n=5) 部位
DTI
, http://www.100md.com
DSI
1小时
5小时
15小时
1小时
5小时
15小时
肝
8.185
9.692
12.763
39.904
37.891
, http://www.100md.com
36.360
脾
6.393
7.503
7.524
22.508
23.697
16.835
肝肿瘤
9.175
6.379
8.567
53.758
, 百拇医药
40.005
27.489
注:DTI: 药物靶向指数(drug targetting index);DSI: 药物选择性指数(drug selective index),以血浆为非靶器官; NADM: 阿霉素毫微粒讨 论
随着介入放射学的迅速发展,原发性肝癌(PHC)的治疗取得了长足的进步。目前,经导管动脉化疗(transcatheter arterial chemotherary,TAC)已广泛应用于临床并被证实可明显改善无法手术切除的中晚期PHC患者的生存质量。TAC疗效的进一步提高与灌注用药密切相关,寻找适宜的药物剂型为近几年中介入学界的一个研究热点。
毫微粒是一类由天然或合成高分子材料制成的nm级固态胶体微粒,实验表明,其在动物体内的分布有明显的靶向性,主要集中于网状内皮系统,如肝脾等。因此,从理论上分析,TAC与毫微粒技术相结合应可在PHC的治疗中取得良好的协同作用。我们曾进行的药效学研究也初步证实了这一想法[3]。
, 百拇医药
本实验中最令人感兴趣的发现是NADM大大增加了药物在肿瘤组织的分布,这与我们以往的药效学研究结果相吻合[3]。我们分析毫微粒肝肿瘤靶向行为的机理在于: (1) 本实验中采用大鼠W256移植性肝癌模型,其肿瘤血供以肝动脉为主,门脉不参与或仅参与瘤灶外缘的部分营养(类似于人类PHC血供情况)[5],而正常肝组织的血供以门脉为主,因此,NADM从肝动脉灌注后,将主要经过肿瘤组织。(2) 药代动力学研究表明,采用动脉途径给药时,药物表现出明显的首过效应,其靶器官分布量显著高于静脉给药方式,这也是介入治疗学的理论基础[6]。(3) 肝癌恶性程度高,瘤区内血管快速增生,血供丰富,血流量大,对药物产生“虹吸”作用。(4) 瘤区血管迂曲紊乱且粗细不均,血流缓慢,NADM易于停留。(5) 瘤组织中残存的枯否细胞对NADM的吞噬。(6) 载药毫微粒表面的粘附性及小的粒径,增加了药物与瘤血管壁的接触时间与接触面积。(7) 毫微粒有助于药物透过血管壁,增加药物的血管外分布[7]。(8) 毫微粒改变了ADM的消除动力学。曾有报道,FADM的消除半衰期是(23.7±7.7)小时,而NADM的消除半衰期延长为(85.9±19.2)小时[8]。(9) 毫微粒对实体瘤有一定的靶向性,如: Reszka等[9]将NADM静脉注射于荷B16黑色素瘤小鼠,1小时后测得NADM组平均药物浓度为1.248μg/g,而FADM组仅为0.094μg/g。对神经胶质瘤的研究也取得了相似的结果[10]。(10) 毫微粒可改变膜转运机制,增加瘤细胞乃至耐药瘤细胞内的药物积聚[8,11]。(11) Chiannilkulchai等[12]用透射电镜观察到肝脏对NADM具有强大的摄取能力,成为有效的药物贮库; 降解的NADM不断释放游离药物,形成局部药物浓度梯度,促使ADM向瘤组织弥散。我们在实验中发现,瘤组织中药物浓度下降速度明显快于肝脏,其原因可能在于药物的再分布,因此,这种“药物贮库”机理可能在后期起到主要作用。
, http://www.100md.com
此外,本实验进一步证实了毫微粒对网状内皮系统,特别是肝、脾的靶向作用。同时,毫微粒减少了药物在心脏的分布,从而增加了使用安全性。Verdun等[2]采用静脉给药途径亦取得了相似的结果。
综上所述,毫微粒有望在PHC的介入治疗中发挥巨大的作用。
参考文献
1 Sharma D, Chelvi TP, Kaur J, et al. Novel Taxol formulation: polyvinylpyrrolidone nanoparticle-encapsulated Taxol for drug delivery in cancer therapy. Oncol Res,1996,8:281-286.
2 Verdun C, Brasseur F, Vranckx H, et al. Tissue distribution of doxorubicin associated with polyisohexylcyanoacrylate nanoparticles. Cancer Chemother Pharmacol,1990,26:13-18.
, http://www.100md.com
3 陈江浩,王执民,吴道澄,等. 阿霉素毫微粒经动脉给药对大鼠肝肿瘤的疗效. 肿瘤,1998,18:14-16.
4 杨继金,朱永法,左长京,等. 大白鼠转移性肝癌模型的制作. 中华放射学杂志,1993,27: 122-123.
5 曾蒙苏,张宏伟,周康荣,等. 供影像学诊断实验的大鼠移植肝癌模型的可行性研究. 临床放射学杂志,1996,15:56-59.
6 Fety R, Lucas C, Solere P, et al. Hepatic intra-arterial infusion of fotemustine: pharmacokinetics. Cancer Chemother Pharmacol,1992,31:118-122.
7 Andrieu V, Fessi H, Dubrasquet M, et al. Pharmacokinetic evaluation of indomethacin nanocapsules. Drug Des Deliv,1989,4:295-302.
, http://www.100md.com
8 Astier A, Doat B, Ferrer MJ, et al. Enhancement of adriamycin antitumor activity by its binding with an intracellular sustained-release form polymethacrylate nanospheres, in U-937 cells. Cancer Res,1988,48:1835-1841.
9 Reszka R, Beck P, Fichtner I, et al. Body distribution of free, liposomal and nanoparticle-associated mitoxantrone in B16-melanoma-bearing mice. J Pharmacol Exp Ther,1997,280:232-237.
10 Zimmer C, Weissleder R, Poss K, et al. MR imaging of phagocytosis in experimental gliomas. Radiology,1995,197:533-538.
, http://www.100md.com
11 de Verdiere AC, Dubernet C, Nemati F, et al. Reversion of multidrug resistance with polyalkylcyanoacrylate nanoparticles: towards a mechanism of action. Br J Cancer,1997,76:198-205.
12 Chiannilkulchai N, Ammoury N, Caillou B, et al. Hepatic tissue distribution of doxorubicin-loaded nanoparticles after i.v. administration in reticulosarcoma M 5076 metastasis-bearing mice. Cancer Chemother Pharmacol,1990,26:122-126.
(收稿:1998-06-09 修回:1998-10-16), 百拇医药