造血生长因子促进RV介导LacZ-NeoR基因在人骨髓造血细胞中转染的机制
作者:奚永志 孔繁华
单位:奚永志 孔繁华 军事医学科学院附属医院免疫学研究室(北京100039)
关键词:人类;血细胞生成;逆转录病毒科;造血细胞生长因子
中国病理生理杂志990203 摘 要 目的:本文探索了不同组合的造血生长因子SCF、IL3及IL6对逆转录病毒(RV)介导的LacZ-NeoR双标志基因转染人骨髓造血细胞转染效率、表达水平的影响及其相关机理。方法:采用RV转染人骨髓非粘附造血细胞(NABMC)及经SCF、IL3及IL6不同组合预激48 h后的NABMC。经荧光素二-β-D-半乳糖呋喃苷脂(FDG)标记的半乳糖苷酶、G418RCFU-GM及PCR/Sourthern-blot检测NeoR和LacZ基因的表达。结果:早期造血生长因子(HGFs)的预激明显改善了RV介导的LacZ-NeoR基因在人骨髓造血细胞中的转染效率与表达水平,SCF+IL3+IL6>SCF+IL3>IL3+IL6>SCF+IL6。氚标记脱氧胸苷(3H-TdR)自杀及5-溴脱氧尿苷-碘化丙啶(BrdU-PI)双标流式细胞仪(FCM)检测显示,HGFs预激后人骨髓造血细胞及CFU-GM的S期比例显著提高。结论:SCF+IL3+IL6的联合预激可显著改善RV介导的外源基因在人骨髓造血细胞中的转染效率与表达水平,这可能与HGFs预激后明显提高人骨髓造血细胞及CFU-GM的S期比例密切相关。
, 百拇医药
Mechanisms of hematopoietic growth factors promote retroviral-mediated LacZ-NeoR double marker genes into hematopoietic cells of human bone marrow
XI Yong-Zhi,KONG Fan-Hua
Department of Immunology,Affiliated Hospital for Academy of Medical Sciences,Beijing(100039)
Abstract AIM:To examine prestimulation effects of different combinations of SCF、IL3 and IL6 on transfer efficiency,expression levels and related mechanism of retroviral-mediated LacZ-NeoR double marker genes into hematopoietic cells of human bone marrow.METHODS:Nonadherent hematopoletic cells,either directly or after prestimulation with different combinations of SCF,IL3 and IL6 for 48 hours,was transfected with supernatants from BAG-PA317 amphotropic packaging cell line in the presence of protamine sulfate.Transfer efficiency and expression levels of retroviral-mediated LacZ-NeoR into these target cell were analyzed by FDG staining of FCM for β-galactosidase,PCR/sourthern-blot and G418 selective culture of CFU-GM separately.RESULTS:Compared to control,prestimulation of hematopoietic cells with different combinations of SCF,IL3 and IL6 markedly enhanced the transfer efficency of LacZ-NeoR double marker genes into hematopoietic cells.The most potent combinations of HGFs were SCF+IL3+IL6 (48.4%)>SCF+IL3(43.2%)>IL3+IL6(41.4%)>SCF+IL6(40.5%) respectively.Cell-cycle analysis of hematopoietic cells made by FCM with double staining of bromodexyuridine and propidium idodide demonstrated an highly proporation of hematopoietic cells in S phase after prestimulation with HGFs.[3H]-thymidine suicide tests of cultured hematopoietic progenitor cells also indicated increasing percentage of CFU-GM in S phase after prestimulation with HGFs.CONCLUSION: Prestimlation with SCF+IL3+IL6 combination could effectively promote the transfter efficiency of retroviral-mediated gene into human hematopoietic cells,which are associated with increased proporation of hematopoietic cells in S phase.
, http://www.100md.com
MeSH Human;Hematopoiesis;Retroviridae;Hematopoietic cell growth factors
人类造血干细胞(hematopoietic stem cell,HSC)的基因转染效率甚低已成为HSC用于基因治疗的最大障碍之一[1,2]。目前人们已采用高纯度的CD34+造血细胞、造血细胞长期培养体系、腺病毒载体及HGFs的预处理等策略试图克服这一困境[3~5]。本研究探讨了SCF、IL3、IL6几种早期HGFs的联合预激改善RV介导的LacZ-NeoR双标志基因在人骨髓造血细胞中转染效率的可能性及其作用机制。
材料与方法
1.人骨髓细胞制备:取胸外科无血液疾患切除的肋骨,无菌下分出单个核细胞(MNC)备用。
, http://www.100md.com
2.包装细胞系及逆转录病毒载体BAG的来源与构建:pDOL是源于Moloney小鼠白血病病毒为基础的载体,将β-半乳糖苷酶LacZ基因克隆该载体后形成含有LacZ与Tn5新霉素耐药NeoR可选择的双标志基因的BAG逆转录病毒载体。LacZ位于NeoR的上游,两者的启动子分别是5′LTR和SV40。按常规方法转化、扩增提取质粒DNA。
3.BAG-PA317的产生及滴度测度:采用电转法将BAG质粒DNA首先转入嗜单向型Ψ2中,经G418压力选出BAG-Ψ2株,收集培养48h上清,在含有8mg/L硫酸渔精蛋白的条件下穿梭感染嗜双向型PA317包装细胞,尔后更换含600mg/L G418的D10培养基筛选,挑选并扩增BAG-PA317 G418R克隆。用常规感染NIH3T3细胞的方法测定其产假病毒滴度。收集产生高滴度的BAG-PA317上清,经0.45 μm滤膜过滤后用于转染造血细胞。
4.基因转染:转基因实验共分NABMC组和经IL3+IL6、SCF+IL3、SCF+IL6及SCF+IL3+IL6预激48 h5组。转染条件为1×109/L的NABMC或HGFs预激后的NABMC、20%FCS-IMDM、BAG-PA317上清10mL、渔精蛋白8mg/L、SCF100ng+IL3 100U+IL6100U/mL。期间每8h更换新鲜体系。SCF、IL3及IL6分别为Amgen、德国Behrigwerke及荷兰TNO所惠赠。
, 百拇医药
5.FDG标记β-半乳糖苷酶的FCM检测:分取转染前及HGFs预激转染后的NABMC于37℃水浴5 min,加入100μL 2mmol/L FDG(Sigma)后轻震均,继续于37℃水浴1min后迅置冰浴上,加入1800 μL冰浴等渗培养液和1μmol/L碘化丙啶(PI)孵育60min,在FCM上检测,计算机收集分析数据。
6.[3H]-TdR自杀实验:分取NABMC和HGFs预激后的NABMC 2×108/L,加入7.4×104Bq甲基[3H]-TdR(18.5×1010Bq/mmol,Amersham),对照组加入相同浓度的未标记脱氧胸苷TdR(Sigma),37 ℃孵育1h后加入含未标记TdR 100mg/L的冷IMDM,中止[3H]-TdR的继续掺入,经IMDM洗两遍后做CFU-GM培养,14d后倒置镜下计数集落。
, http://www.100md.com CFU-GM的S%=
7.BrdU-PI双标记FCM检测细胞周期:参照我们已建立的方法[6],分取HGFs预激前、后的NABMC 1×109/L,加入终浓度为5mg/L的BrdU于37℃孵育30min,用70%乙醇固定。尔后依次采用4mol/L HCl、0.1mol/L硼酸钠处理30min。用含0.5% Tween-20的PBS洗3遍后加入抗BrdU单抗(BD)孵育20 min,PBS洗2遍后加入终浓度5mg/L PI继续孵育20min,在FCM上检测。
8.PCR/Sourthern-blot检测NeoR基因:扩增NeoR基因的引物:Primer I:5′ATC ATG GCT GAT GCA ATG CG3′;Primer Ⅱ:5′ AGA TCA TCC TGA TCG AGA AG3′由荷兰TNO所惠赠。随机分取G418RCFU-GM集落进行PCR反应,条件为94℃ 5min,然后进行35个循环反应(94℃ 30s,55℃ 1min,72℃ 1min,72℃延伸5min),取10μL PCR产物进行琼脂糖电泳,按《分子克隆实验指南》常规方法进行Sourthern-blot 杂交,Neo探针用32P进行标记。
, 百拇医药
结 果
(一)LacZ-NeoR双标志基因在NABMC中的转染:经电脉冲转移、Ψ2PA317穿梭感染、G418高压力选择和有限稀释法筛选,获得一株产假病毒滴度为2.7×105CFU/mL的BAG-PA317,取其上清转染NABMC。在5次分离实验中,NeoR基因在CFU-GM的表达分别为4.1%、0.8%、1.1%、3.3%和3.5%,平均为2.56%±1.50%,并且x-gal原位染色检测LacZ在转染的CFU-GM中的表达所得结果于之相同。
(二)HGFs预激后对NABMC基因转染效率的影响:采用IL3+IL6、SCF+IL3、SCF+IL6和SCF+IL3+IL6预激NABMC 48 h后再进行转染的结果表明,4种组合HGFs的预激均可使LacZ-NeoR的转染效率较对照组NABMC显著提高,在4次分离实验中,G418RCFU-GM分别平均为SCF+IL3+IL6(43.9%±3.85%)>SCF+IL3(39.55%±4.25%)>IL3+IL6(38.95%±2.24%)>SCF+IL6(37.83%±3.98%)>对照(1.63%±1.14%)。FDG标记β-半乳糖苷酶的FCM检测及PCR扩增G418RCFU-GM中NeoR基因的Sourthern-blot 印迹均得以证实,见图1、2。
, 百拇医药
(三)HGFs预激对NABMC细胞周期的改变:为探究HGFs预激显著改善RV介导的LacZ-NeoR双标志基因在NABMC中转染效率的可能机制,采用[3H]-TdR自杀和BrdU-PI双标记FCM检测HGFs预激前、后NABMC的细胞周期变化。结果表明,在4次3H-TdR自杀分离实验中,经HGFs预激后,CFU-GM的S期比例明显高于对照组,分别平均为SCF+IL3+IL6(55.45%±2.33%)>SCF+IL3(49.83%±2.73%)>IL3+IL6(45.03%±4.31%)>SCF+IL6(43.43%±2.41%)>对照(14.08%±2.24%)。BrdU-PI双标记FCM的检测亦显示HGFs预激后造血细胞的S期比例显著增加,见图3。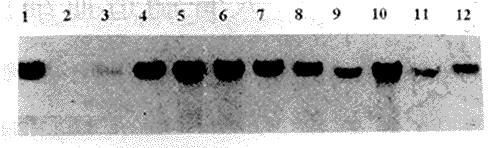
Fig 1 PCR analysis of individual colonies grown from BAG-PA317 infected BM CFU-GM,amplified with neo-specific primers by PCR and hybridized to neo-specific probe by Southern-blot.Lane 1,BAG-PA317 packaging cell(positive control);lane 2 to 3,uninfected normal NABMC(negative control);lane 4 through 12,G418R CFU-GM colonies
, 百拇医药
图1 PCR-扩增转染前后人骨髓CFU-GM中的NeoR基因,并采用Southern-blot印迹杂交检测
Fig 2 Cytometric analysis for the expression levels of LacZ gene by FDG staining for β-galactosidase.A:uninfected NABMC;B:infected NABMC prestimulated with SCF+IL3+IL6图2 流式细胞仪检测FDG染色的β-半乳糖苷酶的表达水平
Fig 3 Cytometric analysis for cell-cycle of hematopoietic cells from human bone marrow prestimulated with HGFs or no HGFs using double staining with BrdU and PI.X-and Y-axises show the intensity of FITC(FL1) and PI(FL2),indicating DNA contents of cells and cell incorporating Brdu,respectively 图3 流式细胞仪检测HGFs预激前后BrdU-PI双标记人骨髓造血细胞的细胞周期状态
, http://www.100md.com
讨 论
HSC作为基因治疗的理想靶细胞除了具备靶细胞通常应具备的条件特征外,它还具有如下优势;(1)许多遗传病与造血细胞异常有关[2];(2)造血细胞能将目的基因产物直接释入血循环而达到靶器官或在循环中发挥作用;3.临床与实验室有成熟的造血干/祖细胞移植及体外培养扩增技术[8,9]。然而由于正常骨髓中HSC所占比例甚微且绝大多数处于高度静止期、造血调控细胞和负调控因子的干扰以及RV只能转染处于增殖周期的靶细胞等诸多不利因素的影响,使HSC的转基因效率甚低,已极大地阻碍了临床应用HSC作为基因治疗的靶细胞。如何改善或克服这一困境已成当务之急。采取HGFs联合预激造血细胞用以增加转基因效率是当今的重要策略之一[1,2],它极大地取益于对造血细胞本质及调控的深入认识,通过合理组合几种早期作用HGFs可能极大地改善RV介导的外源基因在造血细胞中的转染效率与表达,这在动物及新近人的造血细胞体外实验中得以验证[9,10]。其中心原则是要选用能促使处于Go期的HSC进入增殖周期并且还要维持其功能的HGFs。在我们的研究中选用了SCF、IL3及IL6的不同组合,证实三种HGFs的任何组合均可显著的改善LacZ-NeoR双标志基因在人骨髓造血细胞中的转染效率及表达,并且尤以SCF+IL3+IL6的组合为最佳,此结果与国际上报道相一致[9,10],可望作为临床应用的重要依据。
, http://www.100md.com
通过3H-TdR自杀实验及BrdU-PI双标FCM实验发现,SCF、IL3及IL6的联合预激明显提高了造血细胞和CFU-GM群体中S期的比例,这可能是HGFs预激改善转基因效率的重要机理之一。推测处于S期的造血细胞可能更有利于RV介导的外源基因的整合与表达。此结果有别于日本学者所报道的,他们认为植物原生质体细胞的M期和胸腺嘧啶核苷激酶缺陷鼠成纤维细胞系G2/M期最有利于电转基因的整合。
*全军留学归国启动基金资助
参考文献
1 Nienhuis AW,McDonagh KT,Bodine DM.Gene transfer into hematopoietic stem cells.Cancer,1991,67:2700.
2 奚永志.基因治疗——遗传性疾病治疗的最佳策略.解放军医学杂志,1995,20:1581.
, 百拇医药
3 Ward M,Richardson C,Pioli P,et al.Transfer and expression of the human multiple durg resistance gene in human CD34+ cells.Blood,1994,84:1408.
4 Moore KA,Deisseroth AB,Reading CL,et al.Stromal support enhances cell free retroviral vector transduction of human bone marrow long-term culture intiating cells.Blood,1992,79:1392.
5 Seth P,Brinkmann U,Schwartz GN,et al.Adenovirus mediated gene transfer to human breast tumor cells:An approach for cancer gene therapy and bone marrow purging.Cancer Res,1996,56:1346.
, 百拇医药
6 张双喜,奚永志,唐佩弦,等.人正常外周血与骨髓CD34及CD系列分化抗原的表达和细胞周期状态.中国免疫学杂志,1996,12:330.
7 Karlsson S.Treatment of genetic defects in hematopoietic cell function by gene transfer.Blood,1991,78:2481.
8 奚永志,唐佩弦.检测人类原始造血细胞的几种有效途径.中国病理生理杂志,1996,12:328.
9 Luskey BD,Rosenblatt M,Zsebo K,et al.Stem cell factor,interleukin 3,and interleukin 6 promote retroviral-mediated gene transfer into murine hematopoietic cells.Blood,1992,80:396.
10 Zolta JA,Crooks GM,Overell RW,et al.Retroviral vector mediated gene transfer into primitive human hematopoietic progenitor cells:Effects of mast cell growth factor combined with other cytokines.Exp Hematol,1992,20:1065.
收稿日期:1997年3月17日
修稿日期:1998年7月20日, 百拇医药
单位:奚永志 孔繁华 军事医学科学院附属医院免疫学研究室(北京100039)
关键词:人类;血细胞生成;逆转录病毒科;造血细胞生长因子
中国病理生理杂志990203 摘 要 目的:本文探索了不同组合的造血生长因子SCF、IL3及IL6对逆转录病毒(RV)介导的LacZ-NeoR双标志基因转染人骨髓造血细胞转染效率、表达水平的影响及其相关机理。方法:采用RV转染人骨髓非粘附造血细胞(NABMC)及经SCF、IL3及IL6不同组合预激48 h后的NABMC。经荧光素二-β-D-半乳糖呋喃苷脂(FDG)标记的半乳糖苷酶、G418RCFU-GM及PCR/Sourthern-blot检测NeoR和LacZ基因的表达。结果:早期造血生长因子(HGFs)的预激明显改善了RV介导的LacZ-NeoR基因在人骨髓造血细胞中的转染效率与表达水平,SCF+IL3+IL6>SCF+IL3>IL3+IL6>SCF+IL6。氚标记脱氧胸苷(3H-TdR)自杀及5-溴脱氧尿苷-碘化丙啶(BrdU-PI)双标流式细胞仪(FCM)检测显示,HGFs预激后人骨髓造血细胞及CFU-GM的S期比例显著提高。结论:SCF+IL3+IL6的联合预激可显著改善RV介导的外源基因在人骨髓造血细胞中的转染效率与表达水平,这可能与HGFs预激后明显提高人骨髓造血细胞及CFU-GM的S期比例密切相关。
, 百拇医药
Mechanisms of hematopoietic growth factors promote retroviral-mediated LacZ-NeoR double marker genes into hematopoietic cells of human bone marrow
XI Yong-Zhi,KONG Fan-Hua
Department of Immunology,Affiliated Hospital for Academy of Medical Sciences,Beijing(100039)
Abstract AIM:To examine prestimulation effects of different combinations of SCF、IL3 and IL6 on transfer efficiency,expression levels and related mechanism of retroviral-mediated LacZ-NeoR double marker genes into hematopoietic cells of human bone marrow.METHODS:Nonadherent hematopoletic cells,either directly or after prestimulation with different combinations of SCF,IL3 and IL6 for 48 hours,was transfected with supernatants from BAG-PA317 amphotropic packaging cell line in the presence of protamine sulfate.Transfer efficiency and expression levels of retroviral-mediated LacZ-NeoR into these target cell were analyzed by FDG staining of FCM for β-galactosidase,PCR/sourthern-blot and G418 selective culture of CFU-GM separately.RESULTS:Compared to control,prestimulation of hematopoietic cells with different combinations of SCF,IL3 and IL6 markedly enhanced the transfer efficency of LacZ-NeoR double marker genes into hematopoietic cells.The most potent combinations of HGFs were SCF+IL3+IL6 (48.4%)>SCF+IL3(43.2%)>IL3+IL6(41.4%)>SCF+IL6(40.5%) respectively.Cell-cycle analysis of hematopoietic cells made by FCM with double staining of bromodexyuridine and propidium idodide demonstrated an highly proporation of hematopoietic cells in S phase after prestimulation with HGFs.[3H]-thymidine suicide tests of cultured hematopoietic progenitor cells also indicated increasing percentage of CFU-GM in S phase after prestimulation with HGFs.CONCLUSION: Prestimlation with SCF+IL3+IL6 combination could effectively promote the transfter efficiency of retroviral-mediated gene into human hematopoietic cells,which are associated with increased proporation of hematopoietic cells in S phase.
, http://www.100md.com
MeSH Human;Hematopoiesis;Retroviridae;Hematopoietic cell growth factors
人类造血干细胞(hematopoietic stem cell,HSC)的基因转染效率甚低已成为HSC用于基因治疗的最大障碍之一[1,2]。目前人们已采用高纯度的CD34+造血细胞、造血细胞长期培养体系、腺病毒载体及HGFs的预处理等策略试图克服这一困境[3~5]。本研究探讨了SCF、IL3、IL6几种早期HGFs的联合预激改善RV介导的LacZ-NeoR双标志基因在人骨髓造血细胞中转染效率的可能性及其作用机制。
材料与方法
1.人骨髓细胞制备:取胸外科无血液疾患切除的肋骨,无菌下分出单个核细胞(MNC)备用。
, http://www.100md.com
2.包装细胞系及逆转录病毒载体BAG的来源与构建:pDOL是源于Moloney小鼠白血病病毒为基础的载体,将β-半乳糖苷酶LacZ基因克隆该载体后形成含有LacZ与Tn5新霉素耐药NeoR可选择的双标志基因的BAG逆转录病毒载体。LacZ位于NeoR的上游,两者的启动子分别是5′LTR和SV40。按常规方法转化、扩增提取质粒DNA。
3.BAG-PA317的产生及滴度测度:采用电转法将BAG质粒DNA首先转入嗜单向型Ψ2中,经G418压力选出BAG-Ψ2株,收集培养48h上清,在含有8mg/L硫酸渔精蛋白的条件下穿梭感染嗜双向型PA317包装细胞,尔后更换含600mg/L G418的D10培养基筛选,挑选并扩增BAG-PA317 G418R克隆。用常规感染NIH3T3细胞的方法测定其产假病毒滴度。收集产生高滴度的BAG-PA317上清,经0.45 μm滤膜过滤后用于转染造血细胞。
4.基因转染:转基因实验共分NABMC组和经IL3+IL6、SCF+IL3、SCF+IL6及SCF+IL3+IL6预激48 h5组。转染条件为1×109/L的NABMC或HGFs预激后的NABMC、20%FCS-IMDM、BAG-PA317上清10mL、渔精蛋白8mg/L、SCF100ng+IL3 100U+IL6100U/mL。期间每8h更换新鲜体系。SCF、IL3及IL6分别为Amgen、德国Behrigwerke及荷兰TNO所惠赠。
, 百拇医药
5.FDG标记β-半乳糖苷酶的FCM检测:分取转染前及HGFs预激转染后的NABMC于37℃水浴5 min,加入100μL 2mmol/L FDG(Sigma)后轻震均,继续于37℃水浴1min后迅置冰浴上,加入1800 μL冰浴等渗培养液和1μmol/L碘化丙啶(PI)孵育60min,在FCM上检测,计算机收集分析数据。
6.[3H]-TdR自杀实验:分取NABMC和HGFs预激后的NABMC 2×108/L,加入7.4×104Bq甲基[3H]-TdR(18.5×1010Bq/mmol,Amersham),对照组加入相同浓度的未标记脱氧胸苷TdR(Sigma),37 ℃孵育1h后加入含未标记TdR 100mg/L的冷IMDM,中止[3H]-TdR的继续掺入,经IMDM洗两遍后做CFU-GM培养,14d后倒置镜下计数集落。
, http://www.100md.com CFU-GM的S%=

7.BrdU-PI双标记FCM检测细胞周期:参照我们已建立的方法[6],分取HGFs预激前、后的NABMC 1×109/L,加入终浓度为5mg/L的BrdU于37℃孵育30min,用70%乙醇固定。尔后依次采用4mol/L HCl、0.1mol/L硼酸钠处理30min。用含0.5% Tween-20的PBS洗3遍后加入抗BrdU单抗(BD)孵育20 min,PBS洗2遍后加入终浓度5mg/L PI继续孵育20min,在FCM上检测。
8.PCR/Sourthern-blot检测NeoR基因:扩增NeoR基因的引物:Primer I:5′ATC ATG GCT GAT GCA ATG CG3′;Primer Ⅱ:5′ AGA TCA TCC TGA TCG AGA AG3′由荷兰TNO所惠赠。随机分取G418RCFU-GM集落进行PCR反应,条件为94℃ 5min,然后进行35个循环反应(94℃ 30s,55℃ 1min,72℃ 1min,72℃延伸5min),取10μL PCR产物进行琼脂糖电泳,按《分子克隆实验指南》常规方法进行Sourthern-blot 杂交,Neo探针用32P进行标记。
, 百拇医药
结 果
(一)LacZ-NeoR双标志基因在NABMC中的转染:经电脉冲转移、Ψ2PA317穿梭感染、G418高压力选择和有限稀释法筛选,获得一株产假病毒滴度为2.7×105CFU/mL的BAG-PA317,取其上清转染NABMC。在5次分离实验中,NeoR基因在CFU-GM的表达分别为4.1%、0.8%、1.1%、3.3%和3.5%,平均为2.56%±1.50%,并且x-gal原位染色检测LacZ在转染的CFU-GM中的表达所得结果于之相同。
(二)HGFs预激后对NABMC基因转染效率的影响:采用IL3+IL6、SCF+IL3、SCF+IL6和SCF+IL3+IL6预激NABMC 48 h后再进行转染的结果表明,4种组合HGFs的预激均可使LacZ-NeoR的转染效率较对照组NABMC显著提高,在4次分离实验中,G418RCFU-GM分别平均为SCF+IL3+IL6(43.9%±3.85%)>SCF+IL3(39.55%±4.25%)>IL3+IL6(38.95%±2.24%)>SCF+IL6(37.83%±3.98%)>对照(1.63%±1.14%)。FDG标记β-半乳糖苷酶的FCM检测及PCR扩增G418RCFU-GM中NeoR基因的Sourthern-blot 印迹均得以证实,见图1、2。
, 百拇医药
(三)HGFs预激对NABMC细胞周期的改变:为探究HGFs预激显著改善RV介导的LacZ-NeoR双标志基因在NABMC中转染效率的可能机制,采用[3H]-TdR自杀和BrdU-PI双标记FCM检测HGFs预激前、后NABMC的细胞周期变化。结果表明,在4次3H-TdR自杀分离实验中,经HGFs预激后,CFU-GM的S期比例明显高于对照组,分别平均为SCF+IL3+IL6(55.45%±2.33%)>SCF+IL3(49.83%±2.73%)>IL3+IL6(45.03%±4.31%)>SCF+IL6(43.43%±2.41%)>对照(14.08%±2.24%)。BrdU-PI双标记FCM的检测亦显示HGFs预激后造血细胞的S期比例显著增加,见图3。

Fig 1 PCR analysis of individual colonies grown from BAG-PA317 infected BM CFU-GM,amplified with neo-specific primers by PCR and hybridized to neo-specific probe by Southern-blot.Lane 1,BAG-PA317 packaging cell(positive control);lane 2 to 3,uninfected normal NABMC(negative control);lane 4 through 12,G418R CFU-GM colonies
, 百拇医药
图1 PCR-扩增转染前后人骨髓CFU-GM中的NeoR基因,并采用Southern-blot印迹杂交检测

Fig 2 Cytometric analysis for the expression levels of LacZ gene by FDG staining for β-galactosidase.A:uninfected NABMC;B:infected NABMC prestimulated with SCF+IL3+IL6图2 流式细胞仪检测FDG染色的β-半乳糖苷酶的表达水平

Fig 3 Cytometric analysis for cell-cycle of hematopoietic cells from human bone marrow prestimulated with HGFs or no HGFs using double staining with BrdU and PI.X-and Y-axises show the intensity of FITC(FL1) and PI(FL2),indicating DNA contents of cells and cell incorporating Brdu,respectively 图3 流式细胞仪检测HGFs预激前后BrdU-PI双标记人骨髓造血细胞的细胞周期状态
, http://www.100md.com
讨 论
HSC作为基因治疗的理想靶细胞除了具备靶细胞通常应具备的条件特征外,它还具有如下优势;(1)许多遗传病与造血细胞异常有关[2];(2)造血细胞能将目的基因产物直接释入血循环而达到靶器官或在循环中发挥作用;3.临床与实验室有成熟的造血干/祖细胞移植及体外培养扩增技术[8,9]。然而由于正常骨髓中HSC所占比例甚微且绝大多数处于高度静止期、造血调控细胞和负调控因子的干扰以及RV只能转染处于增殖周期的靶细胞等诸多不利因素的影响,使HSC的转基因效率甚低,已极大地阻碍了临床应用HSC作为基因治疗的靶细胞。如何改善或克服这一困境已成当务之急。采取HGFs联合预激造血细胞用以增加转基因效率是当今的重要策略之一[1,2],它极大地取益于对造血细胞本质及调控的深入认识,通过合理组合几种早期作用HGFs可能极大地改善RV介导的外源基因在造血细胞中的转染效率与表达,这在动物及新近人的造血细胞体外实验中得以验证[9,10]。其中心原则是要选用能促使处于Go期的HSC进入增殖周期并且还要维持其功能的HGFs。在我们的研究中选用了SCF、IL3及IL6的不同组合,证实三种HGFs的任何组合均可显著的改善LacZ-NeoR双标志基因在人骨髓造血细胞中的转染效率及表达,并且尤以SCF+IL3+IL6的组合为最佳,此结果与国际上报道相一致[9,10],可望作为临床应用的重要依据。
, http://www.100md.com
通过3H-TdR自杀实验及BrdU-PI双标FCM实验发现,SCF、IL3及IL6的联合预激明显提高了造血细胞和CFU-GM群体中S期的比例,这可能是HGFs预激改善转基因效率的重要机理之一。推测处于S期的造血细胞可能更有利于RV介导的外源基因的整合与表达。此结果有别于日本学者所报道的,他们认为植物原生质体细胞的M期和胸腺嘧啶核苷激酶缺陷鼠成纤维细胞系G2/M期最有利于电转基因的整合。
*全军留学归国启动基金资助
参考文献
1 Nienhuis AW,McDonagh KT,Bodine DM.Gene transfer into hematopoietic stem cells.Cancer,1991,67:2700.
2 奚永志.基因治疗——遗传性疾病治疗的最佳策略.解放军医学杂志,1995,20:1581.
, 百拇医药
3 Ward M,Richardson C,Pioli P,et al.Transfer and expression of the human multiple durg resistance gene in human CD34+ cells.Blood,1994,84:1408.
4 Moore KA,Deisseroth AB,Reading CL,et al.Stromal support enhances cell free retroviral vector transduction of human bone marrow long-term culture intiating cells.Blood,1992,79:1392.
5 Seth P,Brinkmann U,Schwartz GN,et al.Adenovirus mediated gene transfer to human breast tumor cells:An approach for cancer gene therapy and bone marrow purging.Cancer Res,1996,56:1346.
, 百拇医药
6 张双喜,奚永志,唐佩弦,等.人正常外周血与骨髓CD34及CD系列分化抗原的表达和细胞周期状态.中国免疫学杂志,1996,12:330.
7 Karlsson S.Treatment of genetic defects in hematopoietic cell function by gene transfer.Blood,1991,78:2481.
8 奚永志,唐佩弦.检测人类原始造血细胞的几种有效途径.中国病理生理杂志,1996,12:328.
9 Luskey BD,Rosenblatt M,Zsebo K,et al.Stem cell factor,interleukin 3,and interleukin 6 promote retroviral-mediated gene transfer into murine hematopoietic cells.Blood,1992,80:396.
10 Zolta JA,Crooks GM,Overell RW,et al.Retroviral vector mediated gene transfer into primitive human hematopoietic progenitor cells:Effects of mast cell growth factor combined with other cytokines.Exp Hematol,1992,20:1065.
收稿日期:1997年3月17日
修稿日期:1998年7月20日, 百拇医药