重组B7-1逆转录病毒载体的构建及其对T细胞功能的影响
作者:黄贵清 李成荣 赵晓东 杨锡强 蒋莉萍
单位:400014 重庆医科大学附属儿童医院免疫室
关键词:逆转录病毒科;白血病;T淋巴细胞;抗原;CD80
中华儿科杂志/990406 【摘要】 目的 探索转B7-1基因治疗白血病的可能性。方法 通过逆转录多聚酶键反应(RT-PCR)获得人B7-1 cDNA,经酶切后克隆至逆转录病毒载体PLXSN,用磷酸钙沉淀法将其导入包装细胞PA 317,获高效表达B7-1的重组病毒,用重组病毒感染人白血病细胞株K 562和HL 60,获得稳定表达B7-1分子的肿瘤细胞,将其与人外周血单个核细胞(PBMC)混合培养,检测3HTdR掺入和细胞因子白细胞介素2(IL-2)和γ-干扰素(INF-γ)的表达。结果 B7+K 562、B7+-1HL60较载体修饰K 562(neo-K 562)、野生型K 562(Wild-K 562)和nco-HL-60、Wild-HL-60组HTdR掺入明显增强,B7+K 562组为3 680 cpm、neo-K 562组为645 cpm、Wild-K 562组为866 cpm、B7+HL60组为3 980 cpm、neo-HL 60组为486 cpm、Wild-HL-60组为742 cpm。转B7-1基因的白血病细胞能诱导PBMC产生IL-2及IFN-γ。结论 转B7-1基因的肿瘤细胞能促进T细胞增殖和分化,推测可能进一步诱导细胞毒性T淋巴细胞杀伤活性,为在临床开展转B7-1基因治疗小儿白血病打下基础。
, 百拇医药
Construction of the recombinant B7-1 retroviral vector and its effect on the function of T cells HUANG Guiqing, LI Chengrong, ZHAO Xiaodong, et al. Children′s Hospital, Chongqing Medical University, Chongqing 400014
【Abstract】 Objective To explore the possibility of transferring B7-1 gene for the treatment of leukemia. Methods B7-1 cDNA was obtained by reverse transcription polymerase chain reaction and recombined to retroviral vector PLXSN. Calcium phosphate-DNA precipitation method was used to transfer PLB 7-1 SN into packaging cells PA317. Human leukemia cells K 562 and HL-60 were infected with higher titer virus. B7-1 protein expression was confirmed by FACS technique. After PBMCs from healthy donor were cultured with B7-1+ K 562 or B7-1+ HL60, 3 HTdR incorporation and IL-2 and IFN-γ expression were determined. Results A significantly increased 3HTdR incorporation in B7-1+ leukemia cell groups was observed (3 680 cpm in K 562 and 3 980 cpm in HL60, respectively) as compared with those in B7 leukemia cell groups (645 cpm in neo-K 562, 866 cpm in Wild-K 562 and 486 cpm in neo-HL-60, 742 cpm in Wild-HL-60). Interleukin-2 and Interferon-γ expressions were found in PBMC cultured with B7-1 transfected K 562 and HL-60 cell lines, but not found in those cultured with wild or neo-cell lines. Conclusion B7-1 transfected K 562 and HL-60 cell lines could induce the proliferation and differentiation of the T cells. It is likely that B7-1 transfected cells may be capable of inducing the activity of cytotoxic T lymphocyte, and that B7-1 transgene therapy is possible for the treatment of leukemia in childhood.
, 百拇医药
【Key words】 Retroviridoe Leukemia T-lymphocytes Antigent, CD80
B7-1(CD80)是存在于抗原提呈细胞(APC)膜上的糖蛋白分子,与T细胞表面的CD28结合能协同细胞免疫反应、促进T细胞增殖、产生白细胞介素α(IL-2)等淋巴因子。自B7分子首次被报道以来,转B7基因治疗恶性肿瘤一直为肿瘤免疫的研究热点之一。为研究转B7基因治疗白血病的可行性,本研究构建了重组B7-1逆转录病毒载体,并就B7-1基因对T细胞增殖和细胞因子表达的影响进行了初步研究。
材料和方法
一、试剂和细胞株
Oligo(dT)15。MLv-RT,dNTP,Taq酶及各种限制性内切酶均为Gibco公司产品。丝裂霉素c购自Promega公司,鼠抗人CD 80(anti-B7-1)购自美国Ancell公司,FITC-羊抗鼠免疫球蛋白购自成都华美公司,白血病细胞株K 562及HL-60由重庆医科大学汤为学教授赠送,NIH3T3细胞及EB病毒株B958购自重庆医科大学病理生理教研室,PA 317细胞由第三军医大学分子生物学教研室刘昕博士赠送。EBV转化的B淋巴细胞株由我室制备。
, http://www.100md.com
二、构建重组B7-1逆转录病毒载体
1.B7-1cDNA的克隆:从EBV转化的B淋巴细胞中提取总RNA,经逆转录酶合成cDNA,根据基因库报道的B7-1序列设计两对引物[1]。用巢式聚合酶链反应技术(PCR)方法合成B7-1cDNA。
2.克隆B7-1基因到逆转录病毒载体:用限制性内切酶BamHⅠ和EcoRⅠ酶切B7-1基因及逆转录病毒载体由Miller(USA)赠送,T4连结酶连结并转染人大肠杆菌Mc1061,筛选阳性菌落,PCR和酶切鉴定B7-1阳性克隆。用碱裂变法扩增纯化质粒PLB7SN。
3.B7-1基因测序:采用双脱氧测序法,全自动测序仪ABI Prism 377测序。
4.病毒包装及滴度检测:用磷酸钙沉淀法[2]转染PLB7SN和对照逆转录病毒载体人包装细胞PA 317,G 418筛选阳性克隆。病毒上清感染NTH 3T3细胞,G 418筛选,8天后计数克隆数,所获重组病毒滴度为2×105 CFU/ml。
, 百拇医药
5.感染肿瘤细胞:用重组B7-1病毒上清2 ml感染HL-60和K 562,同时以空载体LXSN作对照,G 418筛选阳性克隆,获抗G 418的阳性克隆株B7-1+ HL-60,neo-HL-60(转空载体细胞),B7-1+ K562和neo-k 562,RT-PCR方法检测B7-1 mRNA表达,流式细胞仪(FACS)检测B7-1蛋白表达[3]。
三、转B7-1基因肿瘤细胞对T细胞功能的影响
1.以淋巴细胞分离液从正常肝素抗凝血分离外周血单个核细胞(PBMC),用丝裂霉素C(40 μg/L×106 37℃,1小时)[4]处理的肿瘤细胞[B7+K 562,载体修饰(neo)-K 562,野生型(wild)-K 562,野生型细胞)]及B7+HL-60,neo-HL-60,wild-HL-60)作为刺激细胞,加PBMC(1×105/孔)于55孔培养板,分别加入各种刺激细胞(1×104/孔),37℃,5%CO2培养5天,加3HTdR(1 μci/孔)后继续培养16小时,收集细胞测定HTdR掺入值。
, 百拇医药
2.取1×106PBMC(1 ml)于24孔板,分别加入丝裂霉素c处理的肿瘤细胞1×105/孔(100 μl),混匀后置37℃、5%CO2培养,培养后12、24、48小时收集细胞提取总RNA,用RT-PCR测IL-2和IFN-γ基因表达。IL-2和IFN-γ引物合成及PCR程序参照文献[5]。同时用β-actin PCR作为RNA内部质控。
结果
一、重组B7-1逆转录病毒载体的构建
利用巢式PCR方法从EBV-B淋巴细胞中获得B7-1基因(875 bp),纯化后连结到逆转录病毒载体,分别用DNA内切酶BamHⅠ、EcoRⅠ及SacⅠ酶切,电泳观察。BamHⅠ消化后得一条带,显示质粒环已打开,BamHⅠ,EcoRⅠ消化后得载体(5.8 kb)及B7基因(875 bp)两条带,重组体有两个SacⅠ酶切位点,用其酶切后得三条带,分别为1.7 kb,1.9 kb,3.1 kb(图1)。PCR检测质粒有B7-1基因表达。用抗CD 80(AntiB7-1)单克隆抗体经FACS检测B7-1蛋白表达,发现B7+细胞有B7-1蛋白表达,而转染空载体及野生型细胞无B7-1分子表达(图2,3)。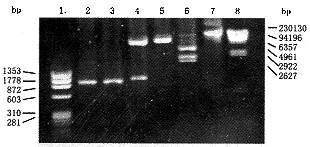
, http://www.100md.com
1.Φ×174分子量标记;2.B7-1 PCR扩增产物;
3.EBU转化B细胞B7-1扩增产物;4.EcoRⅠ和BamHI消化B7-1-PLXSN;
5.Bam HI消化-B7-1-PLXSN;6.Sac Ⅰ消化B7-1-PLXSN;
7.未消化的B7-1-PLXSN;8.入DNA/Hind Ⅲ分子量标记
图1 B7-1-PLXSN酶切图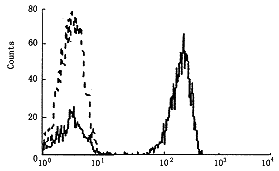
图2 流式细胞仪检测B7+-1细胞B7-1分子表达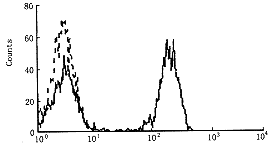
, http://www.100md.com
图3 流式细胞仪检测野生型肿瘤细胞B7-1分子表达
二、3HTdR掺入结果
通过肿瘤细胞与PBMC混合培养,B7+ K 562、B7+HL60较neo-K 562、Wild-K 562和neo-HL60、Wild-HL60组HTdR掺入值明显增加,B7+K 562组为3680 cpm,neo-K 562组为645 cpm,Wild-K 562组为866 cpm,B7HL60组为3980 cpm,neo-HL60组为486 cpm,Wild-HL60组为742 cpm,结果以直方图表示(图4)。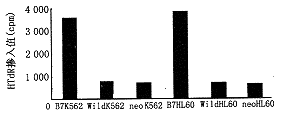
图4 转染B7-1基因瘤细胞诱导T细胞增殖示意图
, http://www.100md.com
三、IL-2、IFN-γ mRNA表达
1.B7+HL60,B7+K 562与PBMC混合培养12、24和48小时均测得IL-2 mRNA表达(458 bp图5)。同样条件下培养12、24和48小时空载体细胞组及野生型细胞组均无IL-2产生。
1.B7+-1HL-60,诱导48小时;2.B7+-1HL-60,诱导24小时;
3.B7+-1HL-60,诱导12小时;4.Φ×174分子量标记;
5.B7-1K562诱导12小时;
, http://www.100md.com
6.B7-1K562诱导24小时;7.B7-1K562诱导48小时
图5 B7-1HL-60、B7+-1K562诱导T细胞IL-2 mRNA产生
2.B7+HL60,B7+ K 562与PBMC混合培养24、48小时均能测得表达(494 bp),12小时不能测得IFN-γ mRNA表达(图6)。同样条件下培养12、24和48小时空载体细胞组及野生型细胞组均无IFN-γ产生。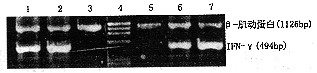
1.B7+-1HL-60,诱导48小时;2.B7+-1HL-60,诱导24小时;
, 百拇医药
3.B7+-1HL-60,诱导12小时;4.Φ×174分子量标记;
5.B7+-1K562诱导12小时;6.B7+-1K562诱导24小时;
7.B7+-1K562诱导48小时
图6 B7+-1HL-60、B7+-1K562诱导T细胞表达IFN-γ mRNA
讨论
本研究通过RT-PCR方法克隆B7-1基因,构建重组B7-1逆转录病毒载体,感染白血病细胞株,获稳定表达B7-1基因的阳性白血病细胞克隆,FACS技术证实转染肿瘤细胞表达B7-1蛋白,并证实转染B7-1的白血病细胞与PBMC混合培养后3 HTdR增殖活性增强、PBMC分泌细胞因子IL-2和IFN-γ,空载体及野生型肿瘤细胞无此作用,说明转B7-1基因的肿瘤细胞能诱导T细胞增殖和分化,其机制为B7-1+ HL60,B7-1+K 562诱导PBMC IL-2 mRNA转录,从而促进T细胞增殖、分泌一系列细胞因子。由于IFN-γ具有诱导细胞毒T淋巴细胞活化、增加MHC-I类抗原表达等多种生物学活性的功能,故推测转B7-1基因的白血病细胞可能直接诱导细胞毒T淋巴细胞杀伤活性。
, 百拇医药
近年来转B7-1基因治疗恶性肿瘤的研究方兴未艾,但对白血病细胞影响的因素尚不多见。白血病是儿童时期常见的恶性肿瘤之一,严重威胁着儿童的生命健康,特别是髓系白血病的初治缓解率低,死亡率和复发率高,治疗相当困难。本研究证实转B7-1基因的白血病细胞能诱导T细胞活化,为开展转基因治疗白血病奠定了理论基础。
本课题由国家自然科学基金资助(基金编号:39470733)
参考文献
1 黄贵清,李成荣,杨锡强,等.B细胞活化因子B7-1cDNA的克隆及其在白血病细胞的表达.重庆医科大学学报,1998,2:137-139.
2 Sambrook J, Fritsch EF, Maniatis T. Molecular cloning, a laboratory manual. 2nd. New York: Cold Spring Harbor Laboratory Press, 1989.321-325.
, http://www.100md.com
3 Li YW, Hellstrom KE, Newby SA, et al. Costimulation by CD48 and B7-1 induces immunity against poorly immunogenic tumors. J Exp Med, 1996, 183:639-644.
4 Natesan M, Ziba RW, Hans R. Costimulation of IL-4 production by murine B7-1 and B7-2 Molecules. J Immunol, 1996, 156:2783-2791.
5 Sandhya LD, Anands L, Henry W, et al. A standardized approach to PCR-Based semiquantitation of multiple cytokine gene transcripts fron small cell samples. Lymphokine cytokine Res, 1993, 12:59-67.
(收稿:1998-01-23 修回:1998-03-24), 百拇医药
单位:400014 重庆医科大学附属儿童医院免疫室
关键词:逆转录病毒科;白血病;T淋巴细胞;抗原;CD80
中华儿科杂志/990406 【摘要】 目的 探索转B7-1基因治疗白血病的可能性。方法 通过逆转录多聚酶键反应(RT-PCR)获得人B7-1 cDNA,经酶切后克隆至逆转录病毒载体PLXSN,用磷酸钙沉淀法将其导入包装细胞PA 317,获高效表达B7-1的重组病毒,用重组病毒感染人白血病细胞株K 562和HL 60,获得稳定表达B7-1分子的肿瘤细胞,将其与人外周血单个核细胞(PBMC)混合培养,检测3HTdR掺入和细胞因子白细胞介素2(IL-2)和γ-干扰素(INF-γ)的表达。结果 B7+K 562、B7+-1HL60较载体修饰K 562(neo-K 562)、野生型K 562(Wild-K 562)和nco-HL-60、Wild-HL-60组HTdR掺入明显增强,B7+K 562组为3 680 cpm、neo-K 562组为645 cpm、Wild-K 562组为866 cpm、B7+HL60组为3 980 cpm、neo-HL 60组为486 cpm、Wild-HL-60组为742 cpm。转B7-1基因的白血病细胞能诱导PBMC产生IL-2及IFN-γ。结论 转B7-1基因的肿瘤细胞能促进T细胞增殖和分化,推测可能进一步诱导细胞毒性T淋巴细胞杀伤活性,为在临床开展转B7-1基因治疗小儿白血病打下基础。
, 百拇医药
Construction of the recombinant B7-1 retroviral vector and its effect on the function of T cells HUANG Guiqing, LI Chengrong, ZHAO Xiaodong, et al. Children′s Hospital, Chongqing Medical University, Chongqing 400014
【Abstract】 Objective To explore the possibility of transferring B7-1 gene for the treatment of leukemia. Methods B7-1 cDNA was obtained by reverse transcription polymerase chain reaction and recombined to retroviral vector PLXSN. Calcium phosphate-DNA precipitation method was used to transfer PLB 7-1 SN into packaging cells PA317. Human leukemia cells K 562 and HL-60 were infected with higher titer virus. B7-1 protein expression was confirmed by FACS technique. After PBMCs from healthy donor were cultured with B7-1+ K 562 or B7-1+ HL60, 3 HTdR incorporation and IL-2 and IFN-γ expression were determined. Results A significantly increased 3HTdR incorporation in B7-1+ leukemia cell groups was observed (3 680 cpm in K 562 and 3 980 cpm in HL60, respectively) as compared with those in B7 leukemia cell groups (645 cpm in neo-K 562, 866 cpm in Wild-K 562 and 486 cpm in neo-HL-60, 742 cpm in Wild-HL-60). Interleukin-2 and Interferon-γ expressions were found in PBMC cultured with B7-1 transfected K 562 and HL-60 cell lines, but not found in those cultured with wild or neo-cell lines. Conclusion B7-1 transfected K 562 and HL-60 cell lines could induce the proliferation and differentiation of the T cells. It is likely that B7-1 transfected cells may be capable of inducing the activity of cytotoxic T lymphocyte, and that B7-1 transgene therapy is possible for the treatment of leukemia in childhood.
, 百拇医药
【Key words】 Retroviridoe Leukemia T-lymphocytes Antigent, CD80
B7-1(CD80)是存在于抗原提呈细胞(APC)膜上的糖蛋白分子,与T细胞表面的CD28结合能协同细胞免疫反应、促进T细胞增殖、产生白细胞介素α(IL-2)等淋巴因子。自B7分子首次被报道以来,转B7基因治疗恶性肿瘤一直为肿瘤免疫的研究热点之一。为研究转B7基因治疗白血病的可行性,本研究构建了重组B7-1逆转录病毒载体,并就B7-1基因对T细胞增殖和细胞因子表达的影响进行了初步研究。
材料和方法
一、试剂和细胞株
Oligo(dT)15。MLv-RT,dNTP,Taq酶及各种限制性内切酶均为Gibco公司产品。丝裂霉素c购自Promega公司,鼠抗人CD 80(anti-B7-1)购自美国Ancell公司,FITC-羊抗鼠免疫球蛋白购自成都华美公司,白血病细胞株K 562及HL-60由重庆医科大学汤为学教授赠送,NIH3T3细胞及EB病毒株B958购自重庆医科大学病理生理教研室,PA 317细胞由第三军医大学分子生物学教研室刘昕博士赠送。EBV转化的B淋巴细胞株由我室制备。
, http://www.100md.com
二、构建重组B7-1逆转录病毒载体
1.B7-1cDNA的克隆:从EBV转化的B淋巴细胞中提取总RNA,经逆转录酶合成cDNA,根据基因库报道的B7-1序列设计两对引物[1]。用巢式聚合酶链反应技术(PCR)方法合成B7-1cDNA。
2.克隆B7-1基因到逆转录病毒载体:用限制性内切酶BamHⅠ和EcoRⅠ酶切B7-1基因及逆转录病毒载体由Miller(USA)赠送,T4连结酶连结并转染人大肠杆菌Mc1061,筛选阳性菌落,PCR和酶切鉴定B7-1阳性克隆。用碱裂变法扩增纯化质粒PLB7SN。
3.B7-1基因测序:采用双脱氧测序法,全自动测序仪ABI Prism 377测序。
4.病毒包装及滴度检测:用磷酸钙沉淀法[2]转染PLB7SN和对照逆转录病毒载体人包装细胞PA 317,G 418筛选阳性克隆。病毒上清感染NTH 3T3细胞,G 418筛选,8天后计数克隆数,所获重组病毒滴度为2×105 CFU/ml。
, 百拇医药
5.感染肿瘤细胞:用重组B7-1病毒上清2 ml感染HL-60和K 562,同时以空载体LXSN作对照,G 418筛选阳性克隆,获抗G 418的阳性克隆株B7-1+ HL-60,neo-HL-60(转空载体细胞),B7-1+ K562和neo-k 562,RT-PCR方法检测B7-1 mRNA表达,流式细胞仪(FACS)检测B7-1蛋白表达[3]。
三、转B7-1基因肿瘤细胞对T细胞功能的影响
1.以淋巴细胞分离液从正常肝素抗凝血分离外周血单个核细胞(PBMC),用丝裂霉素C(40 μg/L×106 37℃,1小时)[4]处理的肿瘤细胞[B7+K 562,载体修饰(neo)-K 562,野生型(wild)-K 562,野生型细胞)]及B7+HL-60,neo-HL-60,wild-HL-60)作为刺激细胞,加PBMC(1×105/孔)于55孔培养板,分别加入各种刺激细胞(1×104/孔),37℃,5%CO2培养5天,加3HTdR(1 μci/孔)后继续培养16小时,收集细胞测定HTdR掺入值。
, 百拇医药
2.取1×106PBMC(1 ml)于24孔板,分别加入丝裂霉素c处理的肿瘤细胞1×105/孔(100 μl),混匀后置37℃、5%CO2培养,培养后12、24、48小时收集细胞提取总RNA,用RT-PCR测IL-2和IFN-γ基因表达。IL-2和IFN-γ引物合成及PCR程序参照文献[5]。同时用β-actin PCR作为RNA内部质控。
结果
一、重组B7-1逆转录病毒载体的构建
利用巢式PCR方法从EBV-B淋巴细胞中获得B7-1基因(875 bp),纯化后连结到逆转录病毒载体,分别用DNA内切酶BamHⅠ、EcoRⅠ及SacⅠ酶切,电泳观察。BamHⅠ消化后得一条带,显示质粒环已打开,BamHⅠ,EcoRⅠ消化后得载体(5.8 kb)及B7基因(875 bp)两条带,重组体有两个SacⅠ酶切位点,用其酶切后得三条带,分别为1.7 kb,1.9 kb,3.1 kb(图1)。PCR检测质粒有B7-1基因表达。用抗CD 80(AntiB7-1)单克隆抗体经FACS检测B7-1蛋白表达,发现B7+细胞有B7-1蛋白表达,而转染空载体及野生型细胞无B7-1分子表达(图2,3)。

, http://www.100md.com
1.Φ×174分子量标记;2.B7-1 PCR扩增产物;
3.EBU转化B细胞B7-1扩增产物;4.EcoRⅠ和BamHI消化B7-1-PLXSN;
5.Bam HI消化-B7-1-PLXSN;6.Sac Ⅰ消化B7-1-PLXSN;
7.未消化的B7-1-PLXSN;8.入DNA/Hind Ⅲ分子量标记
图1 B7-1-PLXSN酶切图

图2 流式细胞仪检测B7+-1细胞B7-1分子表达

, http://www.100md.com
图3 流式细胞仪检测野生型肿瘤细胞B7-1分子表达
二、3HTdR掺入结果
通过肿瘤细胞与PBMC混合培养,B7+ K 562、B7+HL60较neo-K 562、Wild-K 562和neo-HL60、Wild-HL60组HTdR掺入值明显增加,B7+K 562组为3680 cpm,neo-K 562组为645 cpm,Wild-K 562组为866 cpm,B7HL60组为3980 cpm,neo-HL60组为486 cpm,Wild-HL60组为742 cpm,结果以直方图表示(图4)。

图4 转染B7-1基因瘤细胞诱导T细胞增殖示意图
, http://www.100md.com
三、IL-2、IFN-γ mRNA表达
1.B7+HL60,B7+K 562与PBMC混合培养12、24和48小时均测得IL-2 mRNA表达(458 bp图5)。同样条件下培养12、24和48小时空载体细胞组及野生型细胞组均无IL-2产生。

1.B7+-1HL-60,诱导48小时;2.B7+-1HL-60,诱导24小时;
3.B7+-1HL-60,诱导12小时;4.Φ×174分子量标记;
5.B7-1K562诱导12小时;
, http://www.100md.com
6.B7-1K562诱导24小时;7.B7-1K562诱导48小时
图5 B7-1HL-60、B7+-1K562诱导T细胞IL-2 mRNA产生
2.B7+HL60,B7+ K 562与PBMC混合培养24、48小时均能测得表达(494 bp),12小时不能测得IFN-γ mRNA表达(图6)。同样条件下培养12、24和48小时空载体细胞组及野生型细胞组均无IFN-γ产生。

1.B7+-1HL-60,诱导48小时;2.B7+-1HL-60,诱导24小时;
, 百拇医药
3.B7+-1HL-60,诱导12小时;4.Φ×174分子量标记;
5.B7+-1K562诱导12小时;6.B7+-1K562诱导24小时;
7.B7+-1K562诱导48小时
图6 B7+-1HL-60、B7+-1K562诱导T细胞表达IFN-γ mRNA
讨论
本研究通过RT-PCR方法克隆B7-1基因,构建重组B7-1逆转录病毒载体,感染白血病细胞株,获稳定表达B7-1基因的阳性白血病细胞克隆,FACS技术证实转染肿瘤细胞表达B7-1蛋白,并证实转染B7-1的白血病细胞与PBMC混合培养后3 HTdR增殖活性增强、PBMC分泌细胞因子IL-2和IFN-γ,空载体及野生型肿瘤细胞无此作用,说明转B7-1基因的肿瘤细胞能诱导T细胞增殖和分化,其机制为B7-1+ HL60,B7-1+K 562诱导PBMC IL-2 mRNA转录,从而促进T细胞增殖、分泌一系列细胞因子。由于IFN-γ具有诱导细胞毒T淋巴细胞活化、增加MHC-I类抗原表达等多种生物学活性的功能,故推测转B7-1基因的白血病细胞可能直接诱导细胞毒T淋巴细胞杀伤活性。
, 百拇医药
近年来转B7-1基因治疗恶性肿瘤的研究方兴未艾,但对白血病细胞影响的因素尚不多见。白血病是儿童时期常见的恶性肿瘤之一,严重威胁着儿童的生命健康,特别是髓系白血病的初治缓解率低,死亡率和复发率高,治疗相当困难。本研究证实转B7-1基因的白血病细胞能诱导T细胞活化,为开展转基因治疗白血病奠定了理论基础。
本课题由国家自然科学基金资助(基金编号:39470733)
参考文献
1 黄贵清,李成荣,杨锡强,等.B细胞活化因子B7-1cDNA的克隆及其在白血病细胞的表达.重庆医科大学学报,1998,2:137-139.
2 Sambrook J, Fritsch EF, Maniatis T. Molecular cloning, a laboratory manual. 2nd. New York: Cold Spring Harbor Laboratory Press, 1989.321-325.
, http://www.100md.com
3 Li YW, Hellstrom KE, Newby SA, et al. Costimulation by CD48 and B7-1 induces immunity against poorly immunogenic tumors. J Exp Med, 1996, 183:639-644.
4 Natesan M, Ziba RW, Hans R. Costimulation of IL-4 production by murine B7-1 and B7-2 Molecules. J Immunol, 1996, 156:2783-2791.
5 Sandhya LD, Anands L, Henry W, et al. A standardized approach to PCR-Based semiquantitation of multiple cytokine gene transcripts fron small cell samples. Lymphokine cytokine Res, 1993, 12:59-67.
(收稿:1998-01-23 修回:1998-03-24), 百拇医药