去窦弓神经大鼠的心肌组织重构
作者:陶 霞 缪朝玉 杨友才 苏定冯
单位:
关键词:去窦弓神经;重构;心肌
第二军医大学学报980406 摘要 目的: 研究组织特异性表达的胞嘧啶脱氨酶(CD)基因在裸鼠体内对人类大肠癌和肝细胞癌的治疗作用。方法: 将CD基因修饰的大肠癌LoVo细胞移植到裸鼠体内,观察对全身给予5-氟胞嘧啶(5-FC)的反应,用含CD基因的重组病毒产生细胞和5-FC治疗人肝癌裸鼠模型,并用PCR法确定体内基因转移效果,骨髓涂片检查体内基因治疗对造血细胞的影响。结果: 转CD基因对LoVo细胞的致瘤性无影响,全身给予5-FC治疗60 d,转CD基因的大肠癌肿瘤明显缩小;CEA启动子调控的CD(CEA/CD)基因修饰的LoVo细胞形成的肿瘤在5-FC作用下消退。重组病毒在体内可以感染肿瘤、骨髓细胞,给予5-FC后取得了一定的抗肝细胞癌效果。CEA/CD治疗组未发现明显的骨髓抑制,而LTR调控CD的治疗组出现了明显的骨髓抑制。结论: 组织特异性转录调控序列调控的CD基因体内基因治疗,较普通启动子调控的CD基因具有明显的安全性和有效性。
, 百拇医药
中国图书资料分类法分类号 R730.59
Tissue-specific cytosine deaminase gene therapy of human carcinomas in nude mice
Cao Guangwen, Cui Long, Gao Jun, Qi Zhongtian ( Department of Microbiology, Department of Basic Medicine,Second Military Medical University, Shanghai, 200433)
Abstract Objective: To investigate the therapeutic effect of tissue-specifically expressed cytosine deaminase gene on human colorectal and hepatocellular carcinomas. Methods: CD gene-modified LoVo cells were implanted into BALB/c nude mice. The retrovirus-producing cells were introduced into established human hepatocellular carcinoma models. 5-fluorocytosine (5-FC) was systemically administrated. PCR was employed to examine in vivo infection of the retroviruses and smear examination of bone marrow was used to evaluate effect of the in vivo gene therapy on hematopoietic cells. Results: CD gene transfer alone did not alter the tumorigenicity of LoVo cells. The tumor established by modified LoVo cells significantly regressed following 5-FC treatment. Complete regression was achieved in the colorectal carcinoma modified with the CEA promoter drived CD gene (CEA/CD) following 5 -FC treatment for 60 d. The recombinant retrovirus produced in situ can infect cancer cells and bone marrow cells in vivo. Anti -hepatoma effect was achieved in the models following 5-FC treatment. Significant arrest of bone marrow was found in the LTR drived CD gene (LTR/CD) group. But in the CEA/CD treatment group, arrest of bone marrow could not be found. Conclusion: In vivo gene therapy with CD gene under the control of tumor tissue- specific promoter is effective and safe, as compared with the universal promoter.
, 百拇医药
Key words colorectal carcinoma; hepatocellular carcinoma; cytosine deaminase; gene therapy
肝细胞癌和大肠癌在我国是两类常见肿瘤。我们采用5-氟胞嘧啶(5-FC)/胞嘧啶脱氨酶(CD)系统, 应用不同的组织特异性转录调控序列探索对这两大类癌症的治疗新途径。组织特异性前药转换基因治疗主要适用于体内基因治疗, 其主要目的是免除肿瘤化疗的副作用, 增强化疗效果, 其中包括诱导的旁观者效应。本实验在以往工作基础上[1~4], 在裸鼠体内探索人类肿瘤基因治疗方法。
1 材料和方法
1.1 动物与瘤株 BALB/c裸鼠,2月龄,雌性,购于上海肿瘤研究所。荷SMMC-7721, LTNM肝癌模型的BALB/c裸鼠的制备按文献[5]。人大肠癌细胞LoVo, LoVo-CD2, LoVo-G1CEACDNa及其产病毒细胞的来源和制备见文献[2,4]。ACD2和G1CEACDNa两重组逆转录病毒载体为本室构建, 其结构见文献[1,3]。
, http://www.100md.com
1.2 体内致瘤试验 裸鼠分别皮下接种(2~5)×106 LoVo-CD2,LoVo-ACD2,LoVo-G1CEACDNa, 对侧移植未转基因的亲代LoVo, 观察成瘤情况。
1.3 Ex vivo基因治疗 分别于裸鼠股外侧皮下接种5×106 LoVo-G1CEACDNa,LoVo-CD2,LoVo, 待肿瘤平均直径达0.5~1.0 cm时腹腔注射5-FC(Sigma公司) 500 mg/kg, 连续治疗60 d。肿瘤重量估算见文献[6]。
1.4 原位肝癌基因治疗 已建立的人肝癌裸鼠模型分别于植瘤部位和腹腔同时分别注射3×106产病毒包装细胞PA317-CD2, PA317-ACD2和PA317-G1CEACDNa。7 d后腹腔注射5-FC 500 mg/kg, 连续7 d,设PBS对照。每3 d测肿瘤大小, 处死动物后取植肿瘤部位组织、胸骨和股骨骨髓进行病理检查。取肿瘤组织、小肠组织和骨髓、肝、肾等组织细胞, 常规方法抽提基因组DNA, 用PCR法检测NeoR基因以确定重组病毒感染。引物序列为5-CGT TGT CAC TGA AGC GGG AAG G-3和5-ACA AGA CCG GCT TCC ATC CG-3,由Promega合成。
, http://www.100md.com
1.5 统计学处理 应用χ2检验判断差异显著性。
2 结 果
2.1 转CD基因大肠癌体内致瘤性及对5-FC治疗的反应 转CD基因LoVo 细胞接种裸鼠后,与接种同剂量亲代LoVo细胞生长状况相同,CD基因的转染和表达不影响LoVo致瘤性。但在全身性给予前药5-FC后,转CD 基因肿瘤细胞生长停滞,其中CEA/CD修饰的LoVo细胞形成的肿瘤用5-FC治疗60 d后,实体瘤不能触及。组织学检查证实5-FC治疗30 d后亲代LoVo瘤体内肿瘤细胞分裂活跃,转CEA/CD的LoVo肿瘤细胞出现空泡变性,有散在炎细胞和肿瘤细胞(图1A),治疗60 d可见成纤维细胞以及纤维化(图1B)。
, 百拇医药
图1 转CEA/CD人大肠癌在5-FC全身治疗后组织学检查
Fig 1 Histological examination of the CEA/CD modified human colorectal carcinoma following
5-FC systemic administration
A: 30 d after 5-FC treatment; B: 60 d after 5-FC treatment
2.2 CD基因原位转染和5-FC对人肝癌模型的治疗作用 裸鼠接种LTNM和SMMC-7721在2周后成瘤,成瘤率为93.75%。荷人肝细胞癌LTNM模型分别用 PA317-G1CEACDNa, PA317-ACD2和PA317-CD2产病毒包装细胞肿瘤原位注射后, 分别腹腔注射5-FC或PBS,结果PA317-G1CEACDNa+5-FC治疗组与PA317对照组相比,肿瘤消退显著,在18和24 d后分别P<0.05和P<0.01,提示G1CEACDNa+5-FC对LTNM有明显的治疗作用,并且随着5-FC治疗时间的延长,PA317-ACD2和PA317-CD2与5-FC联合对LTNM均有明确的治疗作用。在SMMC-7721模型中取得的治疗结果与LTNM有所不同, 在治疗第24天时, PA317-ACD2和PA317-CD2联合5-FC组与对照组相比,肿瘤明显缩小,分别为P<0.01和P<0.05,而G1CEACDNa+5-FC无明确的治疗作用。
, http://www.100md.com
2.3 重组逆转录病毒体内对组织的感染情况 将上述接种肿瘤并注射重组逆转录病毒包装细胞的肿瘤组织、裸鼠小肠组织、肝组织、肾组织和骨髓细胞取出, 按常规方法抽提基因组DNA, 用PCR检测NeoR基因, 结果从所有动物肿瘤组织、骨髓细胞以及2/10裸鼠的肠组织中扩出了真核细胞核内本不存在的NeoR基因(图2), 而在其他组织中没有扩出。提示从包装细胞中释出的重组逆转录病毒在裸鼠血中没有被补体灭活, 可在体内感染并整合于处于分裂期的细胞基因组中。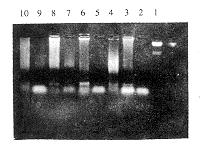
图 2 LTNM模型体内基因治疗后检测NeoR基因
Fig 2 Detection of NeoR gene following in vivo gene
, http://www.100md.com
therapy in LTNM models
Lane l: λDNA HindⅢ marker; Lane 2~4: Tumor, rectum and
bone marrow cells following ACD2 infection; Lane 5~7:
Following CD2 infection; Lane 8~10: Following
G1CEACDNa infection
2.4 组织特异性CD基因体内基因治疗对骨髓细胞的保护作用 应用重组逆转录病毒载体全身转基因后, PCR结果证实重组病毒在体内感染肿瘤和骨髓细胞。治疗24 d后, PA317-G1CEACDNa联合5-FC治疗组和PA317-ACD2联合5-FC治疗组的骨髓内有核细胞和成熟红细胞比率与PBS对照组相比无显著差别(P>0.05)。而PA317-CD2联合5-FC治疗组出现明显的骨髓抑制(P<0.05,图3)。
, http://www.100md.com
图 3 3种体内基因治疗方案引起的骨髓抑制情况
Fig 3 Arrest of bone marrow caused by the 3 protocols
of in vivo gene therapy
□ Femur; □ Sternum; A: G1CEACDNa only; B: G1CEACDNa
+5-FC; C:CD2+5-FC;D:5-FC; E:ACD2+5-FC
3 讨 论
肿瘤特异性基因治疗由几大部分组成, 其中应用肿瘤特征蛋白“持家基因”转录调控序列调控治疗基因在肿瘤细胞中的表达是该项研究的核心内容。我们在以往的研究中应用组织特异性调控序列调控细胞因子基因、“自杀基因”和毒性基因在肿瘤原位转基因后取得了较好的抗肿瘤效果[6~10]。“自杀基因”,如TK和CD 基因等用于肿瘤基因治疗的研究工作在国内已经得到广泛开展, 并且确证转“自杀基因”肿瘤细胞可被低毒性前药所杀伤,同时又诱导出了明显的“旁观者效应”[11,12]。In vivo法是基因治疗的发展方向,治疗基因、尤其是毒性治疗基因在肿瘤细胞中特异表达是in vivo基因治疗的根本保证。应用特异性调控序列调控“自杀基因”在体外也得到了较理想的效果[1~4]。 人类肿瘤在动物体内实验结果不可能完全模拟出将来临床实验的情况,因为裸鼠和SCID小鼠免疫功能是缺陷的。本项研究中,大肠癌CD基因治疗体内研究结果与我们的体外研究结果是一致的。在肝细胞癌研究中, 由于我们体外表达用的HepG2 肝癌细胞在裸鼠体内难以成瘤,故采用成熟的裸鼠肝癌模型进行原位转基因治疗。虽然取得了一些治疗效果,有些结果并不理想, LTNM为AFP高分泌人肝细胞癌瘤株,但ACD2联合5-FC治疗过程中并没有取得预期的效果。其原因可能有以下几种: (1)AFP 增强子对LTR的调控作用十分有限, 因为LTR中有病毒自已的增强子样序列;(2)产病毒包装细胞原位注射后,如果CD基因在包装细胞中表达,投入前药后包装细胞也可能被杀死而失去产生重组病毒的能力;(3)包装细胞在产生重组病毒能力上有一定的差异; (4)裸鼠T细胞免疫功能缺陷,不足以产生有力的“旁观者效应”等。“旁观者效应”一般认为是细胞间的连接使化疗药物传递和启动凋亡基因,但在体内免疫因素也可能起重要的作用。但是意外发现G1CEACDNa联合5-FC治疗组有明确的抗肝癌模型的效果,提示人肝细胞癌瘤株基因组中CEA基因是开放的。
, 百拇医药
应用肿瘤组织特异性前药转换基因治疗一个重要原因是防止化疗副作用。体内转基因后我们发现所有动物的肿瘤组织、骨髓细胞和部分动物的小肠粘膜细胞可被体内产生的逆转录病毒所感染和整合,因此存在着全身给予前药有引起化疗样副作用的危险, 实验中我们观察到,随着治疗时间的延长,组织特异性基因治疗逐渐表现出保护骨髓细胞不被杀伤的能力。这点为我们以后开展基因治疗提供了有说服力的证据。
致 谢: 感谢本校病理解剖学教研室陶文照教授、长海医院检验科沈茜研究员给本研究的帮助。
参 考 文 献
1 崔 龙, 曹广文, 王元和, 等. 含CD基因的人大肠癌特异性逆转录病毒载体的构建. 第二军医大学学报, 1996, 17(3): 289
2 高 军, 曹广文, 戚中田, 等. 逆转录病毒介导的人肝癌特异性HSV-tk/ACV的体外 抗肝癌的作用. 第二军医大学学报, 1996, 17(6): 505
, http://www.100md.com
3 Gao J, Cao GW, Qi ZT, et al. Construction of retroviral vector carrying HSV-tk gene under the control of human AFP enhancer core sequence and human pgk promoter. China Natl J New Gastroenterol, 1997, 3(1): 9
4 崔 龙, 曹广文, 杜 平, 等. 胞嘧啶脱氨酶基因体外特异性前药转换抗大肠癌作用研究. 外科杂志, 1997, 2(2): 84
5 宝建中, 陶文照. 克隆化人肝癌裸鼠移植瘤的建立及其转移性状观察. 肿瘤防治研究, 1995, 22(1): 65
6 曹广文, 戚中田, 潘 欣, 等. 酪氨酸启动子调控的胞嘧啶脱氨酶基因治疗恶性黑色素瘤. 第二军医大学学报, 1998, 19(3): 205
, 百拇医药
7 Cao GW, Kuriyama S, Du P, et al. Complete regression of established murine hepatocellular carcinoma by in vivo tumor necrosis factor-α gene transfer. Gastroenterology, 1997, 112(2): 501
8 Cao GW, Kuriyama S, Du P, et al. Construction of retroviral vectors to induce strong hepatoma-specific expression of cytokine genes. J Gastroenterol Hepatol, 1996, 11(12):1053
9 曹广文, 杜 平, 孔宪涛, 等. 携带hIL-2 cDNA 的逆转录病毒载体的构建及其在人肝癌细胞中的特异表达研究. 中华微生物和免疫学杂志, 1996,16(4): 245
, 百拇医药
10 曹广文, 戚中田, 栗山茂树, 等. 假单孢杆菌外毒素基因的克隆及用于裸鼠大肠癌基因治疗. 第二军医大学学报,1998,19(2):106
11 高振强, 高志萍, 张 涛, 等. 肿瘤特异表达的单纯疱疹病毒胸苷激酶基因对人肺腺癌的实验治疗. 中国科学*C辑, 1997, 27(4): 360
12 赵亚刚, 张学庸, 惠宏襄, 等. HSV-TK 基因治疗系统对人胃癌细胞的杀伤作用. 细胞与分子免疫学杂志, 1996, 12(2): 31
(1997-12-02收稿, 1998-06-24修回)
第二军医大学学报 1998 Aug; 19(4)∶322, http://www.100md.com
单位:
关键词:去窦弓神经;重构;心肌
第二军医大学学报980406 摘要 目的: 研究组织特异性表达的胞嘧啶脱氨酶(CD)基因在裸鼠体内对人类大肠癌和肝细胞癌的治疗作用。方法: 将CD基因修饰的大肠癌LoVo细胞移植到裸鼠体内,观察对全身给予5-氟胞嘧啶(5-FC)的反应,用含CD基因的重组病毒产生细胞和5-FC治疗人肝癌裸鼠模型,并用PCR法确定体内基因转移效果,骨髓涂片检查体内基因治疗对造血细胞的影响。结果: 转CD基因对LoVo细胞的致瘤性无影响,全身给予5-FC治疗60 d,转CD基因的大肠癌肿瘤明显缩小;CEA启动子调控的CD(CEA/CD)基因修饰的LoVo细胞形成的肿瘤在5-FC作用下消退。重组病毒在体内可以感染肿瘤、骨髓细胞,给予5-FC后取得了一定的抗肝细胞癌效果。CEA/CD治疗组未发现明显的骨髓抑制,而LTR调控CD的治疗组出现了明显的骨髓抑制。结论: 组织特异性转录调控序列调控的CD基因体内基因治疗,较普通启动子调控的CD基因具有明显的安全性和有效性。
, 百拇医药
中国图书资料分类法分类号 R730.59
Tissue-specific cytosine deaminase gene therapy of human carcinomas in nude mice
Cao Guangwen, Cui Long, Gao Jun, Qi Zhongtian ( Department of Microbiology, Department of Basic Medicine,Second Military Medical University, Shanghai, 200433)
Abstract Objective: To investigate the therapeutic effect of tissue-specifically expressed cytosine deaminase gene on human colorectal and hepatocellular carcinomas. Methods: CD gene-modified LoVo cells were implanted into BALB/c nude mice. The retrovirus-producing cells were introduced into established human hepatocellular carcinoma models. 5-fluorocytosine (5-FC) was systemically administrated. PCR was employed to examine in vivo infection of the retroviruses and smear examination of bone marrow was used to evaluate effect of the in vivo gene therapy on hematopoietic cells. Results: CD gene transfer alone did not alter the tumorigenicity of LoVo cells. The tumor established by modified LoVo cells significantly regressed following 5-FC treatment. Complete regression was achieved in the colorectal carcinoma modified with the CEA promoter drived CD gene (CEA/CD) following 5 -FC treatment for 60 d. The recombinant retrovirus produced in situ can infect cancer cells and bone marrow cells in vivo. Anti -hepatoma effect was achieved in the models following 5-FC treatment. Significant arrest of bone marrow was found in the LTR drived CD gene (LTR/CD) group. But in the CEA/CD treatment group, arrest of bone marrow could not be found. Conclusion: In vivo gene therapy with CD gene under the control of tumor tissue- specific promoter is effective and safe, as compared with the universal promoter.
, 百拇医药
Key words colorectal carcinoma; hepatocellular carcinoma; cytosine deaminase; gene therapy
肝细胞癌和大肠癌在我国是两类常见肿瘤。我们采用5-氟胞嘧啶(5-FC)/胞嘧啶脱氨酶(CD)系统, 应用不同的组织特异性转录调控序列探索对这两大类癌症的治疗新途径。组织特异性前药转换基因治疗主要适用于体内基因治疗, 其主要目的是免除肿瘤化疗的副作用, 增强化疗效果, 其中包括诱导的旁观者效应。本实验在以往工作基础上[1~4], 在裸鼠体内探索人类肿瘤基因治疗方法。
1 材料和方法
1.1 动物与瘤株 BALB/c裸鼠,2月龄,雌性,购于上海肿瘤研究所。荷SMMC-7721, LTNM肝癌模型的BALB/c裸鼠的制备按文献[5]。人大肠癌细胞LoVo, LoVo-CD2, LoVo-G1CEACDNa及其产病毒细胞的来源和制备见文献[2,4]。ACD2和G1CEACDNa两重组逆转录病毒载体为本室构建, 其结构见文献[1,3]。
, http://www.100md.com
1.2 体内致瘤试验 裸鼠分别皮下接种(2~5)×106 LoVo-CD2,LoVo-ACD2,LoVo-G1CEACDNa, 对侧移植未转基因的亲代LoVo, 观察成瘤情况。
1.3 Ex vivo基因治疗 分别于裸鼠股外侧皮下接种5×106 LoVo-G1CEACDNa,LoVo-CD2,LoVo, 待肿瘤平均直径达0.5~1.0 cm时腹腔注射5-FC(Sigma公司) 500 mg/kg, 连续治疗60 d。肿瘤重量估算见文献[6]。
1.4 原位肝癌基因治疗 已建立的人肝癌裸鼠模型分别于植瘤部位和腹腔同时分别注射3×106产病毒包装细胞PA317-CD2, PA317-ACD2和PA317-G1CEACDNa。7 d后腹腔注射5-FC 500 mg/kg, 连续7 d,设PBS对照。每3 d测肿瘤大小, 处死动物后取植肿瘤部位组织、胸骨和股骨骨髓进行病理检查。取肿瘤组织、小肠组织和骨髓、肝、肾等组织细胞, 常规方法抽提基因组DNA, 用PCR法检测NeoR基因以确定重组病毒感染。引物序列为5-CGT TGT CAC TGA AGC GGG AAG G-3和5-ACA AGA CCG GCT TCC ATC CG-3,由Promega合成。
, http://www.100md.com
1.5 统计学处理 应用χ2检验判断差异显著性。
2 结 果
2.1 转CD基因大肠癌体内致瘤性及对5-FC治疗的反应 转CD基因LoVo 细胞接种裸鼠后,与接种同剂量亲代LoVo细胞生长状况相同,CD基因的转染和表达不影响LoVo致瘤性。但在全身性给予前药5-FC后,转CD 基因肿瘤细胞生长停滞,其中CEA/CD修饰的LoVo细胞形成的肿瘤用5-FC治疗60 d后,实体瘤不能触及。组织学检查证实5-FC治疗30 d后亲代LoVo瘤体内肿瘤细胞分裂活跃,转CEA/CD的LoVo肿瘤细胞出现空泡变性,有散在炎细胞和肿瘤细胞(图1A),治疗60 d可见成纤维细胞以及纤维化(图1B)。

, 百拇医药
图1 转CEA/CD人大肠癌在5-FC全身治疗后组织学检查
Fig 1 Histological examination of the CEA/CD modified human colorectal carcinoma following
5-FC systemic administration
A: 30 d after 5-FC treatment; B: 60 d after 5-FC treatment
2.2 CD基因原位转染和5-FC对人肝癌模型的治疗作用 裸鼠接种LTNM和SMMC-7721在2周后成瘤,成瘤率为93.75%。荷人肝细胞癌LTNM模型分别用 PA317-G1CEACDNa, PA317-ACD2和PA317-CD2产病毒包装细胞肿瘤原位注射后, 分别腹腔注射5-FC或PBS,结果PA317-G1CEACDNa+5-FC治疗组与PA317对照组相比,肿瘤消退显著,在18和24 d后分别P<0.05和P<0.01,提示G1CEACDNa+5-FC对LTNM有明显的治疗作用,并且随着5-FC治疗时间的延长,PA317-ACD2和PA317-CD2与5-FC联合对LTNM均有明确的治疗作用。在SMMC-7721模型中取得的治疗结果与LTNM有所不同, 在治疗第24天时, PA317-ACD2和PA317-CD2联合5-FC组与对照组相比,肿瘤明显缩小,分别为P<0.01和P<0.05,而G1CEACDNa+5-FC无明确的治疗作用。
, http://www.100md.com
2.3 重组逆转录病毒体内对组织的感染情况 将上述接种肿瘤并注射重组逆转录病毒包装细胞的肿瘤组织、裸鼠小肠组织、肝组织、肾组织和骨髓细胞取出, 按常规方法抽提基因组DNA, 用PCR检测NeoR基因, 结果从所有动物肿瘤组织、骨髓细胞以及2/10裸鼠的肠组织中扩出了真核细胞核内本不存在的NeoR基因(图2), 而在其他组织中没有扩出。提示从包装细胞中释出的重组逆转录病毒在裸鼠血中没有被补体灭活, 可在体内感染并整合于处于分裂期的细胞基因组中。

图 2 LTNM模型体内基因治疗后检测NeoR基因
Fig 2 Detection of NeoR gene following in vivo gene
, http://www.100md.com
therapy in LTNM models
Lane l: λDNA HindⅢ marker; Lane 2~4: Tumor, rectum and
bone marrow cells following ACD2 infection; Lane 5~7:
Following CD2 infection; Lane 8~10: Following
G1CEACDNa infection
2.4 组织特异性CD基因体内基因治疗对骨髓细胞的保护作用 应用重组逆转录病毒载体全身转基因后, PCR结果证实重组病毒在体内感染肿瘤和骨髓细胞。治疗24 d后, PA317-G1CEACDNa联合5-FC治疗组和PA317-ACD2联合5-FC治疗组的骨髓内有核细胞和成熟红细胞比率与PBS对照组相比无显著差别(P>0.05)。而PA317-CD2联合5-FC治疗组出现明显的骨髓抑制(P<0.05,图3)。

, http://www.100md.com
图 3 3种体内基因治疗方案引起的骨髓抑制情况
Fig 3 Arrest of bone marrow caused by the 3 protocols
of in vivo gene therapy
□ Femur; □ Sternum; A: G1CEACDNa only; B: G1CEACDNa
+5-FC; C:CD2+5-FC;D:5-FC; E:ACD2+5-FC
3 讨 论
肿瘤特异性基因治疗由几大部分组成, 其中应用肿瘤特征蛋白“持家基因”转录调控序列调控治疗基因在肿瘤细胞中的表达是该项研究的核心内容。我们在以往的研究中应用组织特异性调控序列调控细胞因子基因、“自杀基因”和毒性基因在肿瘤原位转基因后取得了较好的抗肿瘤效果[6~10]。“自杀基因”,如TK和CD 基因等用于肿瘤基因治疗的研究工作在国内已经得到广泛开展, 并且确证转“自杀基因”肿瘤细胞可被低毒性前药所杀伤,同时又诱导出了明显的“旁观者效应”[11,12]。In vivo法是基因治疗的发展方向,治疗基因、尤其是毒性治疗基因在肿瘤细胞中特异表达是in vivo基因治疗的根本保证。应用特异性调控序列调控“自杀基因”在体外也得到了较理想的效果[1~4]。 人类肿瘤在动物体内实验结果不可能完全模拟出将来临床实验的情况,因为裸鼠和SCID小鼠免疫功能是缺陷的。本项研究中,大肠癌CD基因治疗体内研究结果与我们的体外研究结果是一致的。在肝细胞癌研究中, 由于我们体外表达用的HepG2 肝癌细胞在裸鼠体内难以成瘤,故采用成熟的裸鼠肝癌模型进行原位转基因治疗。虽然取得了一些治疗效果,有些结果并不理想, LTNM为AFP高分泌人肝细胞癌瘤株,但ACD2联合5-FC治疗过程中并没有取得预期的效果。其原因可能有以下几种: (1)AFP 增强子对LTR的调控作用十分有限, 因为LTR中有病毒自已的增强子样序列;(2)产病毒包装细胞原位注射后,如果CD基因在包装细胞中表达,投入前药后包装细胞也可能被杀死而失去产生重组病毒的能力;(3)包装细胞在产生重组病毒能力上有一定的差异; (4)裸鼠T细胞免疫功能缺陷,不足以产生有力的“旁观者效应”等。“旁观者效应”一般认为是细胞间的连接使化疗药物传递和启动凋亡基因,但在体内免疫因素也可能起重要的作用。但是意外发现G1CEACDNa联合5-FC治疗组有明确的抗肝癌模型的效果,提示人肝细胞癌瘤株基因组中CEA基因是开放的。
, 百拇医药
应用肿瘤组织特异性前药转换基因治疗一个重要原因是防止化疗副作用。体内转基因后我们发现所有动物的肿瘤组织、骨髓细胞和部分动物的小肠粘膜细胞可被体内产生的逆转录病毒所感染和整合,因此存在着全身给予前药有引起化疗样副作用的危险, 实验中我们观察到,随着治疗时间的延长,组织特异性基因治疗逐渐表现出保护骨髓细胞不被杀伤的能力。这点为我们以后开展基因治疗提供了有说服力的证据。
致 谢: 感谢本校病理解剖学教研室陶文照教授、长海医院检验科沈茜研究员给本研究的帮助。
参 考 文 献
1 崔 龙, 曹广文, 王元和, 等. 含CD基因的人大肠癌特异性逆转录病毒载体的构建. 第二军医大学学报, 1996, 17(3): 289
2 高 军, 曹广文, 戚中田, 等. 逆转录病毒介导的人肝癌特异性HSV-tk/ACV的体外 抗肝癌的作用. 第二军医大学学报, 1996, 17(6): 505
, http://www.100md.com
3 Gao J, Cao GW, Qi ZT, et al. Construction of retroviral vector carrying HSV-tk gene under the control of human AFP enhancer core sequence and human pgk promoter. China Natl J New Gastroenterol, 1997, 3(1): 9
4 崔 龙, 曹广文, 杜 平, 等. 胞嘧啶脱氨酶基因体外特异性前药转换抗大肠癌作用研究. 外科杂志, 1997, 2(2): 84
5 宝建中, 陶文照. 克隆化人肝癌裸鼠移植瘤的建立及其转移性状观察. 肿瘤防治研究, 1995, 22(1): 65
6 曹广文, 戚中田, 潘 欣, 等. 酪氨酸启动子调控的胞嘧啶脱氨酶基因治疗恶性黑色素瘤. 第二军医大学学报, 1998, 19(3): 205
, 百拇医药
7 Cao GW, Kuriyama S, Du P, et al. Complete regression of established murine hepatocellular carcinoma by in vivo tumor necrosis factor-α gene transfer. Gastroenterology, 1997, 112(2): 501
8 Cao GW, Kuriyama S, Du P, et al. Construction of retroviral vectors to induce strong hepatoma-specific expression of cytokine genes. J Gastroenterol Hepatol, 1996, 11(12):1053
9 曹广文, 杜 平, 孔宪涛, 等. 携带hIL-2 cDNA 的逆转录病毒载体的构建及其在人肝癌细胞中的特异表达研究. 中华微生物和免疫学杂志, 1996,16(4): 245
, 百拇医药
10 曹广文, 戚中田, 栗山茂树, 等. 假单孢杆菌外毒素基因的克隆及用于裸鼠大肠癌基因治疗. 第二军医大学学报,1998,19(2):106
11 高振强, 高志萍, 张 涛, 等. 肿瘤特异表达的单纯疱疹病毒胸苷激酶基因对人肺腺癌的实验治疗. 中国科学*C辑, 1997, 27(4): 360
12 赵亚刚, 张学庸, 惠宏襄, 等. HSV-TK 基因治疗系统对人胃癌细胞的杀伤作用. 细胞与分子免疫学杂志, 1996, 12(2): 31
(1997-12-02收稿, 1998-06-24修回)
第二军医大学学报 1998 Aug; 19(4)∶322, http://www.100md.com