双歧杆菌的全肽聚糖对裸鼠腹腔巨噬细胞产生IL-6、IL-12及一氧化氮的影响
作者:王立生 潘令嘉 施理 张亚历 周殿元
单位:(第一军医大学南方医院全军消化内科研究所, 广东 广州 510515)
关键词:二裂菌属;肽多糖;巨噬细胞;白细胞介素类;一氧化氮
中国病理生理杂志000216
[摘 要] 目的:探讨分叉双歧杆菌(B. bifidum)的全肽聚糖对巨噬细胞功能的调节作用。方法:首先用全肽聚糖注射于裸鼠腹腔,以ELISA法测定裸鼠腹腔巨噬细胞产生的IL-6和IL-12含量,同时用Griess试剂检测一氧化氮(NO)的水平。结果:全肽聚糖注射组裸鼠腹腔巨噬细胞产生的IL-6、IL-12及NO含量分别为732.54±190.30(pg/mL)、816.37±96.40(pg/mL)和48.90±6.51(μmol/L);对照组分别为303.78±171.75(pg/mL)、510.27±123.46(pg/mL)以及30.67±12.83(μmol/L),三者比较均具有显著差异(P<0.01)。结论:分叉双歧杆菌的全肽聚糖能激活巨噬细胞,使之分泌多量的IL-6、IL-12及NO,这些细胞毒性效应分子介导了全肽聚糖的多种重要生理功能。
, 百拇医药
[中图分类号] R318.04 [文献标识码] A
[文章编号] 1000-4718(2000)02-0153-04
Influence of whole peptidoglycan of bifidobacterium on interleukin 6, interleukin 12 and nitric oxide produced by peritoneal macrophages of nude mice
WANG Li-sheng, PAN Lin-jia, SHI Li, ZHANG Ya-li, ZHOU Dian-yuan
(PLA Institute for Digestive Medicine,Nan Fan Hospital,The First Military
, 百拇医药
Medical University,Guangzhou 510515, China)
[Abstract] AIM: To deplore the adjustion of whole peptidoglycan of bifidobacterium bifidum to functions of macrophages.METHODS:Levels of interleukin 6, interleukin 12 produced by peritoneal macrophages of nude mice was detected by ELISA method, and the content of nitric oxide (NO) was detected by using Griess reagent, after whole peptidoglycan were injected into nude mice peritoneally. RESULTS:The content of interleukin 6, interleukin 12 and NO secreted from peritoneal macrophages of nude mice in the whole peptidoglycan injection group was 732.54±190.30(pg/mL)、816.37±96.40(pg/mL) and 48.90±6.51(μmol/L) respectively.It was 303.78±171.75(pg/mL), 510.27±123.46(pg/mL) and 30.67±12.83(μmol/L) respectively in the control group. In view of the content of interleukin 6, interleukin 12 and NO, there existed significant difference when whole peptidoglycan injection group was compared with control group(P<0.01).CONCLUSION:The result suggested that whole peptidoglycan of bifidobacterium bifidum could activate macrophages to secrete large amount of interleukin 6, interleukin 12 and NO. These cytotoxicity effectors mediated many kinds of important physiological functions of bifidobacterium.
, http://www.100md.com
[MeSH] Bifidobacterium; Peptidoglycan;Macrophages; Interleukins; Nitric oxide
已知卡介苗(BCG)、溶血性链球菌A组Ⅲ型低毒变异株(OK-432)以及短小棒状杆菌(corynebacterium parvum)等多种微生物均能激活机体免疫系统中的巨噬细胞,使之产生多种一定量的细胞毒性效应分子。双歧杆菌是人体及动物肠道内数量占优势的生理性有益菌。全肽聚糖(whole peptidoglycan,WPG)是双歧杆菌细胞壁中的最主要成份。它作为一种无毒付作用的生物反应调节剂,能激活巨噬细胞产生多量的interleukin-1(IL-1)、interleukin-6(IL-6)及tumor necrosing factor-α(TNF-α)等细胞毒性效应分子[1]。本文以ELISA法检测了分叉双歧杆菌(B.bifidum)的WPG刺激裸鼠腹腔巨噬细胞后产生的IL-6和IL-12的含量,同时用 Griess试剂测定一氧化氮(nitric oxide, NO)的水平,旨在探讨WPG对巨噬细胞功能的调节作用。
, 百拇医药
材 料 和 方 法
一、 WPG
按Sekine介绍的方法从分叉双歧杆菌细胞壁中提取而成[2]。由重庆医科大学检验系胡宏教授惠赠。具体操作是将分叉双歧杆菌接种于BL肉汤,37 ℃厌氧培养72 h,4 000 r/min离心30 min,收集细菌沉淀,生理盐水反复洗涤后,置65 ℃水浴箱内处理40 min。然后将15 g热处理过的细菌加至50 mL 0.5% Triton X-100溶液中,80~85 ℃水浴1 h,并连续搅拌溶液。然后,使溶液立即冷却,并用重蒸水彻底洗涤。再用甲醇:水(2∶1V/V),甲醇,丙酮连续洗涤,去除不可溶残渣中的去垢剂。在残渣中加入40 mL内含10 mmol MgCl2,胰酶(1 mg/mL),Dnase(100 μg/mL),Rnase(150 μg/mL),pH7.2 Tris-HCl缓冲液,37℃孵育14 h, 4℃ 2 000 r/min离心40 min以分离不可溶残渣,并用含胰蛋白酶(0.5 mg/mL), α-糜蛋白酶(0.5 mg/mL),Tris-HCl缓冲液40 mL,37℃消化14 h。残渣用含胃蛋白酶(1 mg/mL)的0.01 N HCl 20 mL处理,然后用含蛋白酶E(1 mg/mL)的pH7.4 Tris-HCl缓冲液20 mL 37 ℃消化14 h。蛋白酶消化过的残渣经甲醇,甲醇:氯仿(1∶1,V/V)及氯仿40 mL洗涤脱脂。脱脂的提取物用含蛋白酶E(1 mg/mL),pH7.4 Tris-HCl缓冲液20 mL 37℃消化14h,共3次,然后用蒸馏水连续透析3 d。最后,不可溶的提取物经0.005 mol/L H2SO4 10 mL 85~95℃处理5 min,立即冷却,4 ℃15 000 r/min离心30 min。沉渣用水透析7 d,冻干保存。同时对提取物进行了氨基酸组分、DNA、RNA、己糖以及戊糖等化学成份的分析,并用扫描电镜观察了它的超微结构。分叉双歧杆菌是从健康婴儿粪便中分离纯化而得,经中国医学科学院微生物所鉴定,编号是Bif1101,保存于30%甘油布氏肉汤中。
, 百拇医药
二、实验动物
BALB/C(nu/nu),6~8周龄,雌雄各半,体重18~23 g,购于本校实验动物中心,饲养于SPF级动物室。
三、实验分组及WPG的处理措施
实验动物分两组。(1)WPG注射组:10只裸小鼠,于实验的第1 d向裸鼠腹腔注射10%硫乙醇酸盐肉汤2 mL[1],第2 d起腹腔注射WPG 0.25 mg(相当于1×109个双歧杆菌),每天1次,连续5 d;(2)对照组:动物数量及第1 d的处理措施均同WPG注射组,不同之处为第2 d起向其腹腔注射PBS液0.2 mL,每天1次,连续5 d。
四、 裸鼠腹腔巨噬细胞的收集及培养
于实验的第7 d处死全部动物,常规消毒裸鼠腹部皮肤,以冷的D-Hanks液灌洗腹腔,洗出液1000 r/min离心10 min,去上清,沉渣以无血清RPMI 1640培养液重悬两次,调细胞数为1×106/mL,吸取100 μL细胞悬液加至96孔细胞培养板中,置37 ℃ 5% CO2孵育箱中培养2 h,洗去未贴壁细胞,再加含10%小牛血清的RPMI 1640培养液及LPS(终浓度为10 ng/mL)继续培养,诱导24 h后收集孔内上清,置-30 ℃保存。
, http://www.100md.com
五、 IL-6含量的测定
采用ELISA法。试剂盒购自法国IMMUNOTE-CH公司。具体操作程序为:(1)将不同稀释度的待测血清及IL-6标准品加至已包被抗鼠IL-6单抗的96孔细胞培养板中,100 μL/孔,室温孵育90 min;(2)加入乙酰胆碱酯酶标记的二抗,100 μL/孔,室温(18~25℃)孵育120 min;(3)吸弃孔内液体,用冲洗液充分洗涤板孔,扣干;(4)各孔内加入200 μL反应底物(含乙酰胆碱的磷酸钾缓冲液,pH7.4),避光室温孵育30 min;(5)加入终止液,50 μL/孔;(6)于酶标仪上读取405 nm处的吸光值(A值)。
六、 IL-12含量的测定
采用ELISA法,试剂盒购自上述公司。具体操作程序为:(1)将不同稀释度的IL-12标准品及待测上清加至已包被抗鼠IL-12单抗的96孔细胞培养板中,100 μL/孔,室温(18~25 ℃)孵育120 min;(2)吸弃孔内液体,用冲洗液反复冲洗3次,扣干;(3)加入生物素化二抗,500 μL/孔,然后再加入过氧化物酶标链酶亲和素(HPR-avidin),100 μL/孔,室温下孵育30 min;(4)冲洗液反复冲洗,扣干;(5)加入反应底物TMB,100 μL/孔,室温下避光反应30 min;(6)加入终止液(2N H2SO4),50 μL/孔;(7)于酶标仪上读取450 nm处的吸光值(A值)。
, http://www.100md.com
七、 Griess试剂
以蒸馏水配制0.1%盐酸萘乙二胺(Sigma产品),5%磷酸配制1%磺胺嘧啶(Sigma产品)。临用前两者等量混合即可。
八、 NO2标准曲线的制备
将1 mmol/L的NaNO2 对倍稀释后,加入等体积的Griess试剂。室温下轻轻摇振10 min,于Bio-Rad 550型酶标仪上读取波长550 nm处的 A值,每一样品设3个复孔,取其平均值。
九、 NO水平的测定
取待测上清100 μL,加入 30%硫酸锌5 μL去除蛋白质,5 000 r/min离心10 min,收集其上清,与等体积的Griess试剂混合。室温下轻轻摇振10 min,于酶标仪上读取波长550 nm的吸光值(A值)。
, http://www.100md.com
十、统计处理
数据以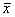 ±s表示,均数差异显著性用t检验判定。
±s表示,均数差异显著性用t检验判定。
结 果
一、 WPG对裸鼠腹腔巨噬细胞产生IL-6及IL-12的影响
ELISA法检测IL-6及IL-12含量的结果表明:WPG注射组裸鼠腹腔巨噬细胞体外在LPS诱导下产生IL-6及IL-12的量显著高于对照组(P<0.01),见表1。
表1 裸鼠腹腔巨噬细胞培养上清IL-6、IL-12及NO-2含量检测的结果
Tab 1 The content of IL-6, IL-12 and NO-2 in the supernatant of cultured peritoneal macrophages of nude mice(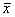 ±s,n=10) Group
±s,n=10) Group
, http://www.100md.com
IL-6(pg/mL)
IL-12(pg/mL)
NO-2 (μmol/L)
Control
303.78±171.75
510.27±123.46
30.67±12.83
WPG injection
732.54±190.30*
816.37±96.40*
, 百拇医药
48.90±6.51*
*P<0.01, vs control
二、 WPG刺激裸鼠腹腔巨噬细胞后产生的NO-2含量
将一系列不同浓度的NaNO-2标准品与测定的对应A值作一标准曲线,并进行直线相关回归分析,得出其直线回归方程为Y=0.013+0.022X,r=0.999,说明两者具有极好的相关性。将不同标本测得的A值代入该直线回归方程中,即得到相应的NO-2含量。实验发现WPG注射组的裸鼠腹腔巨噬细胞产生NO-2的量显著高于对照组(P<0.01),具体见表1。由于生成的NO很快被氧化成NO-2,因此以Griess试剂测定的NO-2含量间接反映了NO的水平。
, http://www.100md.com
讨 论
WPG是双歧杆菌的固有成份,它保持了全菌的一些重要生物学特性,如抗感染,抗突变以及抗衰老等。此外它也能激活巨噬细胞,提高机体的非特异性免疫反应及免疫监视功能。Sekine等[1]报道婴儿型双歧杆菌的WPG能激活小鼠腹腔巨噬细胞,使其IL-1、IL-6及TNF-α的mRNA表达增强。我们也证实分叉双歧杆菌的WPG能显著增强裸鼠腹腔巨噬细胞的吞噬能力以及能量代谢水平[3]。本文结果中,裸鼠腹腔注射分叉双歧杆菌的WPG后,其腹腔巨噬细胞产生的IL-6、IL-12及NO含量显著增高,提示WPG激活巨噬细胞的同时,也使之分泌了多量的细胞因子以及重要介质。
IL-6能促进B淋巴细胞的分化成熟及分泌抗体,也能活化T 淋巴细胞及提高NK细胞的杀伤能力[4]。它在体内外具有广谱的抗肿瘤作用。Mule等[5]报道IL-6能显著抑制小鼠皮下移植的结肠癌MC-38的生长。IL-12能激活T 淋巴细胞及NK细胞产生多量的IFN-γ,同时能抑制肿瘤新生血管的形成,因而具有显著的抑瘤效应[6]。近已证实它能明显促使Meth A纤维肉瘤、黑色素瘤、Lewis肺癌和肾细胞癌等多种肿瘤的消退[7]。NO是激活的巨噬细胞杀灭肿瘤细胞及病原微生物的主要效应分子,它可通过以下途径来抑制多种肿瘤的生长,(1)灭活肿瘤细胞三羧酸循环中的乌头酸酶,阻断它的能量代谢[8];(2)直接诱导肿瘤细胞的凋亡[9]。已知WPG在体内具有显著的抑瘤效应。Sekine等[10]证实婴儿型双歧杆菌的WPG能显著抑制小鼠皮下移植的Meth A纤维肉瘤的生长。Ishihara等[11]将青春型双歧杆菌的WPG注射于恶性黑色素瘤患者的皮肤转移灶内,发现它能使转移灶体积明显缩小,效果和IFN-γ相当。由于WPG 激活巨噬细胞产生的上述重要介质均具有广谱的抑瘤活性,因此它们的诱生可能参与了WPG的抑瘤过程。
, 百拇医药
[参 考 文 献]
[1] Sekine K,Ohta J,Pnishi M,et al.Analysis of antitumor properties of effector cells stimulated with a cell wall preparation (WPG) of bifidobacterium infantis[J].Biol Pharm Bull,1995,18:148~153.
[2] Sekine K,Toida T,Saito M,et al.A new morphologically characterized cell wall preparation (Whole peptidoglycan) from bifidobacterium infantis with a higher efficacy on the regression of an established tumor in mice[J].Cancer Res,1985, 45:1300~1307.
, 百拇医药
[3] 王立生,潘令嘉.双歧杆菌的表面分子对裸鼠腹腔巨噬细胞激活作用的初步观察[J].现代胃肠病与内镜杂志,1999, 3:21~23.
[4] Luger TA,Krutmann J,Kirnbauet R,et al.IFN-B2/IL-6 augments the activity of human natual killer cells[J].J Immunol,1989, 143:1206~1209.
[5] Mule JJ,Mcintosh JK,Jablons DM,et al.Antitumor activity of recombinant interleukin 6 in mice[J].J Exp Med,1990, 171:629~636.
[6] Gately MK,Warrier RR,Honasoge S,et al.Administration of recombinant IL-12 to normal mice enhances cytolytic lymphocyte activity and induces production of IFN-γ in vivo[J].Int Immunol,1994, 6:157~167.
, 百拇医药
[7] Brunda MJ,Luestro L,Warrier RR,et al.Antitumor and antimetastatic activity of interleukin 12 against murine tumors[J].J Exp Med,1993,178:1223~1230.
[8] Macmicking J,Xie QW,Stuehr DJ,et al.Nitric oxide and macrophage functions[J].Annu Rev Immunol,1997, 15:323~350.
[9] Xie K,Huang S,Dong Z,et al.Transfection with the inducible nitric oxide synthase gene suppresses tumorigenicity and abrogates metastasis by K-1735 murine melanoma cells[J].J Exp Med,1995, 181:1333~1343.
, http://www.100md.com
[10] Sekine K,Watanabe SE,Ohta J,et al.Induction and activation of tumoricidal cells in vivo and in vitro by the bacterial cell wall of bifidobacterium infantis[J].Bifidobacteria Microflora,1994, 13:65~72.
[11] Ishihara K,Hayasaka K,Yamazaki N.Current status of melanoma treatment with interferon,cytokines and other biological response modifiers in Japan[J].J Invest Dermol,1989, 92:326~328.
[收稿日期] 1998-12-02 [修回日期] 1999-04-30, 百拇医药
单位:(第一军医大学南方医院全军消化内科研究所, 广东 广州 510515)
关键词:二裂菌属;肽多糖;巨噬细胞;白细胞介素类;一氧化氮
中国病理生理杂志000216
[摘 要] 目的:探讨分叉双歧杆菌(B. bifidum)的全肽聚糖对巨噬细胞功能的调节作用。方法:首先用全肽聚糖注射于裸鼠腹腔,以ELISA法测定裸鼠腹腔巨噬细胞产生的IL-6和IL-12含量,同时用Griess试剂检测一氧化氮(NO)的水平。结果:全肽聚糖注射组裸鼠腹腔巨噬细胞产生的IL-6、IL-12及NO含量分别为732.54±190.30(pg/mL)、816.37±96.40(pg/mL)和48.90±6.51(μmol/L);对照组分别为303.78±171.75(pg/mL)、510.27±123.46(pg/mL)以及30.67±12.83(μmol/L),三者比较均具有显著差异(P<0.01)。结论:分叉双歧杆菌的全肽聚糖能激活巨噬细胞,使之分泌多量的IL-6、IL-12及NO,这些细胞毒性效应分子介导了全肽聚糖的多种重要生理功能。
, 百拇医药
[中图分类号] R318.04 [文献标识码] A
[文章编号] 1000-4718(2000)02-0153-04
Influence of whole peptidoglycan of bifidobacterium on interleukin 6, interleukin 12 and nitric oxide produced by peritoneal macrophages of nude mice
WANG Li-sheng, PAN Lin-jia, SHI Li, ZHANG Ya-li, ZHOU Dian-yuan
(PLA Institute for Digestive Medicine,Nan Fan Hospital,The First Military
, 百拇医药
Medical University,Guangzhou 510515, China)
[Abstract] AIM: To deplore the adjustion of whole peptidoglycan of bifidobacterium bifidum to functions of macrophages.METHODS:Levels of interleukin 6, interleukin 12 produced by peritoneal macrophages of nude mice was detected by ELISA method, and the content of nitric oxide (NO) was detected by using Griess reagent, after whole peptidoglycan were injected into nude mice peritoneally. RESULTS:The content of interleukin 6, interleukin 12 and NO secreted from peritoneal macrophages of nude mice in the whole peptidoglycan injection group was 732.54±190.30(pg/mL)、816.37±96.40(pg/mL) and 48.90±6.51(μmol/L) respectively.It was 303.78±171.75(pg/mL), 510.27±123.46(pg/mL) and 30.67±12.83(μmol/L) respectively in the control group. In view of the content of interleukin 6, interleukin 12 and NO, there existed significant difference when whole peptidoglycan injection group was compared with control group(P<0.01).CONCLUSION:The result suggested that whole peptidoglycan of bifidobacterium bifidum could activate macrophages to secrete large amount of interleukin 6, interleukin 12 and NO. These cytotoxicity effectors mediated many kinds of important physiological functions of bifidobacterium.
, http://www.100md.com
[MeSH] Bifidobacterium; Peptidoglycan;Macrophages; Interleukins; Nitric oxide
已知卡介苗(BCG)、溶血性链球菌A组Ⅲ型低毒变异株(OK-432)以及短小棒状杆菌(corynebacterium parvum)等多种微生物均能激活机体免疫系统中的巨噬细胞,使之产生多种一定量的细胞毒性效应分子。双歧杆菌是人体及动物肠道内数量占优势的生理性有益菌。全肽聚糖(whole peptidoglycan,WPG)是双歧杆菌细胞壁中的最主要成份。它作为一种无毒付作用的生物反应调节剂,能激活巨噬细胞产生多量的interleukin-1(IL-1)、interleukin-6(IL-6)及tumor necrosing factor-α(TNF-α)等细胞毒性效应分子[1]。本文以ELISA法检测了分叉双歧杆菌(B.bifidum)的WPG刺激裸鼠腹腔巨噬细胞后产生的IL-6和IL-12的含量,同时用 Griess试剂测定一氧化氮(nitric oxide, NO)的水平,旨在探讨WPG对巨噬细胞功能的调节作用。
, 百拇医药
材 料 和 方 法
一、 WPG
按Sekine介绍的方法从分叉双歧杆菌细胞壁中提取而成[2]。由重庆医科大学检验系胡宏教授惠赠。具体操作是将分叉双歧杆菌接种于BL肉汤,37 ℃厌氧培养72 h,4 000 r/min离心30 min,收集细菌沉淀,生理盐水反复洗涤后,置65 ℃水浴箱内处理40 min。然后将15 g热处理过的细菌加至50 mL 0.5% Triton X-100溶液中,80~85 ℃水浴1 h,并连续搅拌溶液。然后,使溶液立即冷却,并用重蒸水彻底洗涤。再用甲醇:水(2∶1V/V),甲醇,丙酮连续洗涤,去除不可溶残渣中的去垢剂。在残渣中加入40 mL内含10 mmol MgCl2,胰酶(1 mg/mL),Dnase(100 μg/mL),Rnase(150 μg/mL),pH7.2 Tris-HCl缓冲液,37℃孵育14 h, 4℃ 2 000 r/min离心40 min以分离不可溶残渣,并用含胰蛋白酶(0.5 mg/mL), α-糜蛋白酶(0.5 mg/mL),Tris-HCl缓冲液40 mL,37℃消化14 h。残渣用含胃蛋白酶(1 mg/mL)的0.01 N HCl 20 mL处理,然后用含蛋白酶E(1 mg/mL)的pH7.4 Tris-HCl缓冲液20 mL 37 ℃消化14 h。蛋白酶消化过的残渣经甲醇,甲醇:氯仿(1∶1,V/V)及氯仿40 mL洗涤脱脂。脱脂的提取物用含蛋白酶E(1 mg/mL),pH7.4 Tris-HCl缓冲液20 mL 37℃消化14h,共3次,然后用蒸馏水连续透析3 d。最后,不可溶的提取物经0.005 mol/L H2SO4 10 mL 85~95℃处理5 min,立即冷却,4 ℃15 000 r/min离心30 min。沉渣用水透析7 d,冻干保存。同时对提取物进行了氨基酸组分、DNA、RNA、己糖以及戊糖等化学成份的分析,并用扫描电镜观察了它的超微结构。分叉双歧杆菌是从健康婴儿粪便中分离纯化而得,经中国医学科学院微生物所鉴定,编号是Bif1101,保存于30%甘油布氏肉汤中。
, 百拇医药
二、实验动物
BALB/C(nu/nu),6~8周龄,雌雄各半,体重18~23 g,购于本校实验动物中心,饲养于SPF级动物室。
三、实验分组及WPG的处理措施
实验动物分两组。(1)WPG注射组:10只裸小鼠,于实验的第1 d向裸鼠腹腔注射10%硫乙醇酸盐肉汤2 mL[1],第2 d起腹腔注射WPG 0.25 mg(相当于1×109个双歧杆菌),每天1次,连续5 d;(2)对照组:动物数量及第1 d的处理措施均同WPG注射组,不同之处为第2 d起向其腹腔注射PBS液0.2 mL,每天1次,连续5 d。
四、 裸鼠腹腔巨噬细胞的收集及培养
于实验的第7 d处死全部动物,常规消毒裸鼠腹部皮肤,以冷的D-Hanks液灌洗腹腔,洗出液1000 r/min离心10 min,去上清,沉渣以无血清RPMI 1640培养液重悬两次,调细胞数为1×106/mL,吸取100 μL细胞悬液加至96孔细胞培养板中,置37 ℃ 5% CO2孵育箱中培养2 h,洗去未贴壁细胞,再加含10%小牛血清的RPMI 1640培养液及LPS(终浓度为10 ng/mL)继续培养,诱导24 h后收集孔内上清,置-30 ℃保存。
, http://www.100md.com
五、 IL-6含量的测定
采用ELISA法。试剂盒购自法国IMMUNOTE-CH公司。具体操作程序为:(1)将不同稀释度的待测血清及IL-6标准品加至已包被抗鼠IL-6单抗的96孔细胞培养板中,100 μL/孔,室温孵育90 min;(2)加入乙酰胆碱酯酶标记的二抗,100 μL/孔,室温(18~25℃)孵育120 min;(3)吸弃孔内液体,用冲洗液充分洗涤板孔,扣干;(4)各孔内加入200 μL反应底物(含乙酰胆碱的磷酸钾缓冲液,pH7.4),避光室温孵育30 min;(5)加入终止液,50 μL/孔;(6)于酶标仪上读取405 nm处的吸光值(A值)。
六、 IL-12含量的测定
采用ELISA法,试剂盒购自上述公司。具体操作程序为:(1)将不同稀释度的IL-12标准品及待测上清加至已包被抗鼠IL-12单抗的96孔细胞培养板中,100 μL/孔,室温(18~25 ℃)孵育120 min;(2)吸弃孔内液体,用冲洗液反复冲洗3次,扣干;(3)加入生物素化二抗,500 μL/孔,然后再加入过氧化物酶标链酶亲和素(HPR-avidin),100 μL/孔,室温下孵育30 min;(4)冲洗液反复冲洗,扣干;(5)加入反应底物TMB,100 μL/孔,室温下避光反应30 min;(6)加入终止液(2N H2SO4),50 μL/孔;(7)于酶标仪上读取450 nm处的吸光值(A值)。
, http://www.100md.com
七、 Griess试剂
以蒸馏水配制0.1%盐酸萘乙二胺(Sigma产品),5%磷酸配制1%磺胺嘧啶(Sigma产品)。临用前两者等量混合即可。
八、 NO2标准曲线的制备
将1 mmol/L的NaNO2 对倍稀释后,加入等体积的Griess试剂。室温下轻轻摇振10 min,于Bio-Rad 550型酶标仪上读取波长550 nm处的 A值,每一样品设3个复孔,取其平均值。
九、 NO水平的测定
取待测上清100 μL,加入 30%硫酸锌5 μL去除蛋白质,5 000 r/min离心10 min,收集其上清,与等体积的Griess试剂混合。室温下轻轻摇振10 min,于酶标仪上读取波长550 nm的吸光值(A值)。
, http://www.100md.com
十、统计处理
数据以
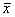 ±s表示,均数差异显著性用t检验判定。
±s表示,均数差异显著性用t检验判定。结 果
一、 WPG对裸鼠腹腔巨噬细胞产生IL-6及IL-12的影响
ELISA法检测IL-6及IL-12含量的结果表明:WPG注射组裸鼠腹腔巨噬细胞体外在LPS诱导下产生IL-6及IL-12的量显著高于对照组(P<0.01),见表1。
表1 裸鼠腹腔巨噬细胞培养上清IL-6、IL-12及NO-2含量检测的结果
Tab 1 The content of IL-6, IL-12 and NO-2 in the supernatant of cultured peritoneal macrophages of nude mice(
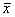 ±s,n=10) Group
±s,n=10) Group, http://www.100md.com
IL-6(pg/mL)
IL-12(pg/mL)
NO-2 (μmol/L)
Control
303.78±171.75
510.27±123.46
30.67±12.83
WPG injection
732.54±190.30*
816.37±96.40*
, 百拇医药
48.90±6.51*
*P<0.01, vs control
二、 WPG刺激裸鼠腹腔巨噬细胞后产生的NO-2含量
将一系列不同浓度的NaNO-2标准品与测定的对应A值作一标准曲线,并进行直线相关回归分析,得出其直线回归方程为Y=0.013+0.022X,r=0.999,说明两者具有极好的相关性。将不同标本测得的A值代入该直线回归方程中,即得到相应的NO-2含量。实验发现WPG注射组的裸鼠腹腔巨噬细胞产生NO-2的量显著高于对照组(P<0.01),具体见表1。由于生成的NO很快被氧化成NO-2,因此以Griess试剂测定的NO-2含量间接反映了NO的水平。
, http://www.100md.com
讨 论
WPG是双歧杆菌的固有成份,它保持了全菌的一些重要生物学特性,如抗感染,抗突变以及抗衰老等。此外它也能激活巨噬细胞,提高机体的非特异性免疫反应及免疫监视功能。Sekine等[1]报道婴儿型双歧杆菌的WPG能激活小鼠腹腔巨噬细胞,使其IL-1、IL-6及TNF-α的mRNA表达增强。我们也证实分叉双歧杆菌的WPG能显著增强裸鼠腹腔巨噬细胞的吞噬能力以及能量代谢水平[3]。本文结果中,裸鼠腹腔注射分叉双歧杆菌的WPG后,其腹腔巨噬细胞产生的IL-6、IL-12及NO含量显著增高,提示WPG激活巨噬细胞的同时,也使之分泌了多量的细胞因子以及重要介质。
IL-6能促进B淋巴细胞的分化成熟及分泌抗体,也能活化T 淋巴细胞及提高NK细胞的杀伤能力[4]。它在体内外具有广谱的抗肿瘤作用。Mule等[5]报道IL-6能显著抑制小鼠皮下移植的结肠癌MC-38的生长。IL-12能激活T 淋巴细胞及NK细胞产生多量的IFN-γ,同时能抑制肿瘤新生血管的形成,因而具有显著的抑瘤效应[6]。近已证实它能明显促使Meth A纤维肉瘤、黑色素瘤、Lewis肺癌和肾细胞癌等多种肿瘤的消退[7]。NO是激活的巨噬细胞杀灭肿瘤细胞及病原微生物的主要效应分子,它可通过以下途径来抑制多种肿瘤的生长,(1)灭活肿瘤细胞三羧酸循环中的乌头酸酶,阻断它的能量代谢[8];(2)直接诱导肿瘤细胞的凋亡[9]。已知WPG在体内具有显著的抑瘤效应。Sekine等[10]证实婴儿型双歧杆菌的WPG能显著抑制小鼠皮下移植的Meth A纤维肉瘤的生长。Ishihara等[11]将青春型双歧杆菌的WPG注射于恶性黑色素瘤患者的皮肤转移灶内,发现它能使转移灶体积明显缩小,效果和IFN-γ相当。由于WPG 激活巨噬细胞产生的上述重要介质均具有广谱的抑瘤活性,因此它们的诱生可能参与了WPG的抑瘤过程。
, 百拇医药
[参 考 文 献]
[1] Sekine K,Ohta J,Pnishi M,et al.Analysis of antitumor properties of effector cells stimulated with a cell wall preparation (WPG) of bifidobacterium infantis[J].Biol Pharm Bull,1995,18:148~153.
[2] Sekine K,Toida T,Saito M,et al.A new morphologically characterized cell wall preparation (Whole peptidoglycan) from bifidobacterium infantis with a higher efficacy on the regression of an established tumor in mice[J].Cancer Res,1985, 45:1300~1307.
, 百拇医药
[3] 王立生,潘令嘉.双歧杆菌的表面分子对裸鼠腹腔巨噬细胞激活作用的初步观察[J].现代胃肠病与内镜杂志,1999, 3:21~23.
[4] Luger TA,Krutmann J,Kirnbauet R,et al.IFN-B2/IL-6 augments the activity of human natual killer cells[J].J Immunol,1989, 143:1206~1209.
[5] Mule JJ,Mcintosh JK,Jablons DM,et al.Antitumor activity of recombinant interleukin 6 in mice[J].J Exp Med,1990, 171:629~636.
[6] Gately MK,Warrier RR,Honasoge S,et al.Administration of recombinant IL-12 to normal mice enhances cytolytic lymphocyte activity and induces production of IFN-γ in vivo[J].Int Immunol,1994, 6:157~167.
, 百拇医药
[7] Brunda MJ,Luestro L,Warrier RR,et al.Antitumor and antimetastatic activity of interleukin 12 against murine tumors[J].J Exp Med,1993,178:1223~1230.
[8] Macmicking J,Xie QW,Stuehr DJ,et al.Nitric oxide and macrophage functions[J].Annu Rev Immunol,1997, 15:323~350.
[9] Xie K,Huang S,Dong Z,et al.Transfection with the inducible nitric oxide synthase gene suppresses tumorigenicity and abrogates metastasis by K-1735 murine melanoma cells[J].J Exp Med,1995, 181:1333~1343.
, http://www.100md.com
[10] Sekine K,Watanabe SE,Ohta J,et al.Induction and activation of tumoricidal cells in vivo and in vitro by the bacterial cell wall of bifidobacterium infantis[J].Bifidobacteria Microflora,1994, 13:65~72.
[11] Ishihara K,Hayasaka K,Yamazaki N.Current status of melanoma treatment with interferon,cytokines and other biological response modifiers in Japan[J].J Invest Dermol,1989, 92:326~328.
[收稿日期] 1998-12-02 [修回日期] 1999-04-30, 百拇医药