MIF基因修饰的FBL3红白血病细胞的生物学性质
作者:刘艳君 田野苹 曹雪涛 于益芝 厉永建 弭静 张明徽 陶群
单位:刘艳君(第二军医大学基础医学部免疫学教研室, 上海 200433.);田野苹(第二军医大学基础医学部免疫学教研室, 上海 200433.);曹雪涛(第二军医大学基础医学部免疫学教研室, 上海 200433.);于益芝(第二军医大学基础医学部免疫学教研室, 上海 200433.);厉永建(第二军医大学基础医学部免疫学教研室, 上海 200433.)
关键词:巨噬细胞游走抑制因子;腺病毒;基因修饰;红白血病细胞
第二军医大学学报000809 [摘要] 目的:研究巨噬细胞游走抑制因子(MIF)基因修饰的FBL3红白血病细胞的生物学性质变化,为探讨其体内诱导抗肿瘤免疫反应的作用奠定基础。方法:以腺病毒介导,将MIF基因导入小鼠FBL3红白血病细胞,观察其体外生物学性质变化。将MIF基因修饰的FBL3细胞(MIF-FBL3)接种小鼠体内,观察其致瘤性和局部病理学变化,同时检测细胞因子mRNA表达。结果:腺病毒能有效地将MIF基因导入FBL3细胞,MIF的分泌可持续10 d。MIF-FBL3细胞形态、增殖能力及表面MHC-Ⅰ,MHC-Ⅱ,B7-1,B7-2,ICAM-1等分子的表达与野生型FBL3细胞相比无明显变化,但在小鼠体内的致瘤性降低,小鼠存活期延长,肿瘤局部可检测出mTNF-α mRNA和mLtn mRNA的表达,并有明显的单核和淋巴细胞浸润。结论:MIF-FBL3细胞体外生物学性质无明显改变,但可能通过分泌MIF在体内激活抗肿瘤免疫功能。
, 百拇医药
[中图分类号] R 730.5 [文献标识码] A
[文章编号] 0258-879X(2000)08-0727-04
Biologic characteristics of MIF gene-modified FBL3 erythroleukemia cell
LIU Yan-Jun TIAN Ye-Ping CAO Xue-Tao YU Yi-Zhi LI Yong-Jian MI Jing ZHANG Ming-Hui TAO Qun
(Department of Immunology, Department of Basic Medicine, Second Military Medical University, Shanghai 200433, China)
, 百拇医药
[ABSTRACT] Objective: To study the role of MIF gene-modified FBL3 erythroleukemia cells (MIF-FBL3) in the induction of antitumor immune responses in vivo. The biologic characteristics of MIF-FBL3 cell were investigated. Methods: The FBL3 cells were transfected by recombinant adenovirus with the gene encoding human MIF (AdexlhMIF). The biologic characteristics of MIF-FBL3 were determined in vitro. The tumorigenicity of MIF-FBL3 in vivo and the pathologic changes of tumor local tissues were observed after the mice were inoculated with MIF-FBL3. The expression of cytokines mRNA in tumor local tissues was detected simultaneously. Results: The transfection efficiency of AdexlhMIF was high and MIF secretion of MIF-FBL3 could last up to 10 days. Although no changes in the morphology, the proliferative ability and the expression of MHC-Ⅰ, MHC-Ⅱ, B7-1,B7-2, ICAM-1 molecules of MIF-FBL3 were observed in vitro,the tumorigenicity of MIF-FBL3 decreased in vivo. The survival periods of the mice inoculated with MIF-FBL3 were prolonged markedly. In the tumor local tissues of the mice inoculated with MIF-FBL3, mTNF-α mRNA and mLtn mRNA could be detected and the infiltration of monocytes and lymphocytes was obvious. Conclusion: The biologic characteristics of MIF-FBL3 remain unchanged in vitro and the antitumor immune functions may be activated by MIF secreted from MIF-FBL3 in vivo.
, 百拇医药
[KEY WORDS] microphage migration-inhibitory factor; adenovirus; gene modification; erythroleukemia cell
巨噬细胞游走抑制因子(macrophage migration inhibitory factor, MIF)曾长期被认为仅是T细胞激活后产生的一种可以抑制巨噬细胞游走的细胞因子,其在感染、炎症和迟发型变态反应等过程中起着重要作用[1~4]。近年来发现MIF分布广泛,具有多种生物学活性,尤其是能促进巨噬细胞释放IL-1,TNF-α,NO, H2O2等,并通过这些因子增强巨噬细胞在体外的杀瘤作用,但目前对MIF在体内抗肿瘤免疫中的作用尚不清楚。因此,本实验应用MIF重组腺病毒AdexlhMIF转染小鼠FBL3红白血病细胞,观察了MIF基因修饰的FBL3细胞体外生物学性质的变化,并对其体内致瘤性、肿瘤局部细胞因子表达水平及组织病理学变化进行了研究,以期为探讨MIF基因修饰的瘤苗在体内诱导抗肿瘤免疫反应的作用奠定基础。
, 百拇医药
1 材料和方法
1.1 动物和细胞株 C57BL/6小鼠,6~8周龄,雄性,SPF级,购自上海西普尔-必凯实验动物有限公司;小鼠红白血病细胞株FBL3细胞由美国克利夫兰医学中心陈卫博士惠赠;人胚肾细胞株293细胞由德国MDC分子医学中心Blankenstein教授惠赠。
1.2 主要试剂 受CMV启动子转录调控、携带目的基因的重组腺病毒AdexlhMIF和AdexlLacZ由日本东京癌症化疗中心分子生物治疗研究部Hirofumi Hamada博士惠赠;MTT购自Fluka公司;X-gal(5-溴-4-氯-3-吲哚-β-半乳糖苷)购自华美生物试剂公司;荧光标记的抗小鼠MHC-Ⅱ,B7-1,B7-2,ICAM-1抗体,抗小鼠MHC-Ⅰ抗体和荧光标记的大鼠抗小鼠二抗,购自PharMingen公司;MIF检测试剂盒,购自R & D公司。
1.3 腺病毒介导的MIF基因修饰FBL3细胞 采用人胚肾细胞株293细胞扩增腺病毒,微量细胞病变法测定病毒滴度[5]。FBL3细胞采用RPMI 1640完全培养基(含10%FCS, 100 U/ml青霉素、100 U/ml链霉素)培养,于对数生长期时更换新鲜的无血清RPMI 1640培养液,按MOI值20分别加入AdexlhMIF或AdexlLacZ,置于37℃,5% CO2孵箱中培养,开始30 min内每10 min振摇1次,使腺病毒与细胞充分接触,继续培养2 h,收集细胞用RPMI 1640洗去未转染的腺病毒,加入新鲜的完全RPMI 1640培养液备用。采用X-gal染色法检测转染率>90%。
, 百拇医药
1.4 MIF基因修饰的FBL3细胞体外增殖能力测定 采用MTT法检测。
1.5 MIF体外分泌水平检测 按ELISA试剂盒说明进行。
1.6 MIF基因修饰FBL3细胞后表面分子检测 转染AdexlhMIF的FBL3细胞培养36~48 h后,以PBS洗2遍,重悬于200 μl PBS中,分别加入荧光标记的抗小鼠MHC-Ⅱ,B7-1,B7-2抗体和抗小鼠MHC-Ⅰ一抗,标记体系为1 μg抗体/2×105个细胞,4℃暗室中孵育30 min,PBS洗2遍。间接标记时再加入荧光标记的二抗,4℃暗室孵育30 min,PBS洗2遍,用流式细胞仪检测荧光强度。
1.7 荷瘤小鼠的制备及致瘤性观察 将小鼠随机分为3组(10只/组),A组:野生型FBL3细胞组(wt-FBL3);B组:AdexlhLacZ转染的FBL3细胞组(LacZ-FBL3);C组:AdexlhMIF转染的FBL3细胞组(MIF-FBL3),分别于左股外侧接种相应的FBL3细胞,每只小鼠接种3×106个(0.1 ml),观察肿瘤生长情况,采用瘤体长短径乘积(mm2)表示肿瘤大小,同时观察各组小鼠存活时间。
, 百拇医药
1.8 肿瘤局部细胞因子表达的检测 于肿瘤发生第17天分别取各实验组小鼠肿瘤组织,以异硫氰酸胍一步法制备总RNA, RT-PCR检测mIL-2, mIL-4, mTNF-α, mLtn等细胞因子的mRNA。 PCR引物序列及扩增参数如下, mIL-2上游引物:5′-TCCACTTCAAGCTCTACAG-3′; 下游引物:5′-GAGTCAAATCCAGAACATGCC-3′。 PCR参数:95℃, 20 s; 54℃, 30 s; 72℃, 30 s; 35个循环。 mIL-4上游引物:5′-ATTATGCATATCCAC-GGATGCGACAA-3′; 下游引物:5′-AAGGATCCTTACGAGTAATCCATTTGCATGA-3′。 PCR参数:95℃, 20 s; 57℃, 30 s; 72℃, 30 s; 35个循环。 mTNF-α上游引物:5′-GCAGGTCTACTTTG-GAGTCA-3′;下游引物:5′-ACATTCGAGGCTCC-
AGTGAA -3′。PCR参数:95℃,20 s;55℃,30 s;72℃,30 s;35个循环。mLtn上游引物:5′-GGAAT-TCGACCTCAGCCATGAGACTTCTC-3′;下游引物:5′-CGGGATCCTTACCCAGTCAGGGTTAC-TGCTGTG-3′。PCR参数:94℃,1 min;60℃,1 min;72℃,2 min;25个循环。
, 百拇医药
1.9 肿瘤局部组织病理分析 于荷瘤第17天处死小鼠,取肿瘤组织做病理学分析,标本用10%中性甲醛固定,经梯度乙醇脱水,二甲苯透明,石蜡包埋,常规切片,苏木精-伊红(H-E)染色后镜检。
1.10 统计学处理 采用未配对计量资料t检验。
2 结 果
2.1 腺病毒介导的MIF基因修饰FBL3细胞后体外MIF分泌水平 由图1可见,AdexlhMIF转染FBL3细胞后4 h即可从其培养上清中检测到MIF,36 h达高峰,为48.6 ng/ml,转染10 d后仍能检测到MIF;而对照腺病毒AdexlLacZ转染的FBL3和野生型FBL3细胞培养上清中均未检测到MIF。
2.2 MIF基因修饰的FBL3细胞体外增殖能力 FBL3细胞分别转染重组腺病毒AdexlhMIF或AdexlLacZ后,培养过程中镜下观察二者与野生型FBL3在形态上无明显差异。培养36~48 h后分别收集各组细胞检测其增殖情况,表明各组间差异不显著(P<0.05)。
, 百拇医药
2.3 MIF基因修饰的FBL3细胞表面分子的表达 FACS检测结果显示,AdexlhMIF转染的FBL3细胞表面的MHC-Ⅰ, MHC-Ⅱ, B7-1, B7-2, ICAM-1分子表达水平与AdexlLacZ-转染的FBL3及野生型FBL3细胞之间无差异。
图4 接种wt-FBL3,LacZ-FBL3和MIF-FBL3的小鼠肿瘤局部组织病理学观察
Fig4 Pathologic analysis of the tumor tissue from the mice inoculated with wt -FBL3,LacZ-FBL3and MIF-FBL 3 Cells(×200)A:wt-FBL3;B:LacZ-FBL3;C:MIF-FBL3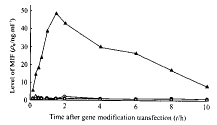
, 百拇医药
图 1 MIF基因修饰FBL3细胞后
培养上清中MIF分泌水平
Fig 1 Level of MIF in supernatants of FBL3
cells modified by MIF gene
○: wt-FBL3; △: LacZ-FBL3; ▲: MIF-FBL3
2.4 MIF基因修饰的FBL3细胞小鼠体内接种后的生长情况 LacZ-FBL3和wt-FBL3组的小鼠在接种瘤细胞8 d后,即可在皮下触摸到瘤体,且瘤体体积增大较快,而MIF-FBL3组出现肿瘤的时间明显延迟,且肿瘤生长缓慢(图2),与对照组相比差异显著(P<0.05)。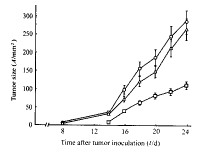
, http://www.100md.com
图 2 MIF基因修饰的FBL3细胞
在小鼠体内的生长情况
Fig 2 Growth of MIF gene-modified
FBL3 cells in mice
○: wt-FBL3; △: LacZ-FBL3; □: MIF-FBL3
2.5 小鼠存活期的改变 由图3可见,wt-FBL3组和LacZ-FBL3组小鼠在接种瘤细胞后34 d内全部死亡,而MIF-FBL3组与对照组相比存活期明显延长(P<0.05)。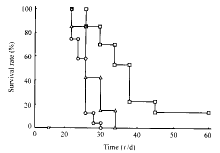
图 3 接种MIF基因修饰的FBL3
, 百拇医药
细胞后小鼠的存活期
Fig 3 Survival time of the mice inoculated
with MIF gene-modified FBL3 cells
○: wt-FBL3; △: LacZ-FBL3; □: MIF-FBL3
2.6 肿瘤局部组织病理学观察 如图4(图见封三)所示,wt-FBL3组(图4A)和LacZ-FBL3组(图4B)肿瘤细胞增殖活跃,可见核分裂相,并向肌肉组织浸润性生长,瘤灶周围炎性细胞浸润少;而MIF-FBL3组肿瘤生长缓慢,肿瘤周围有明显的炎性细胞浸润,以单核和淋巴细胞为主,并且可见少量粒细胞,肿瘤周围有纤维组织和肉芽组织增生(图4C)。
2.7 肿瘤局部组织细胞因子表达的变化 从图5中可以看出,MIF-FBL3组肿瘤局部mTNF-α和mLtn mRNA表达较LacZ-FBL3组明显增强,wt-FBL3组不表达mTNF-α mRNA,而表达mLtn mRNA很低,mIL-2和mIL-4 mRNA在各组小鼠肿瘤局部均未见表达,表明体内接种MIF基因修饰的FBL3细胞后,局部分泌的MIF可诱导TNF-α,Ltn的表达。
, 百拇医药
3 讨 论
MIF最初是作为T细胞分泌的一种可以抑制巨噬细胞游走的因子而被发现的,以后的研究资料表明,MIF可由多种细胞产生,参与感染、内毒素血症、迟发型变态反应等病理过程,对炎症和免疫反应具有调节作用。现已发现MIF在体外能促使巨噬细胞分泌IL-1β, TNF-α, IFN-γ, NO等因子,进而增强巨噬细胞杀伤肿瘤细胞的作用[6],但MIF在体内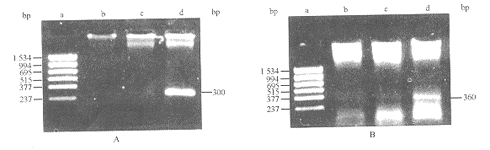
图 5 接种3种FBL3的小鼠肿瘤局部mTNF-α mRNA(A)和mLtn mRNA(B)的表达
Fig 5 Expression of mTNF-α mRNA(A) and mLtn mRNA(B) in the tumor
tissues from the mice inoculated with 3 types of FBL3 cells
, 百拇医药
a: Marker; b: wt-FBL3; c: LacZ-FBL3; d: MIF-FBL3
抗肿瘤免疫中是否起作用尚不了解。本实验是基于目前对MIF生物活性的认识和已获得MIF腺病毒载体的有利条件下,研究重组MIF腺病毒转染的瘤细胞在体外的生物学性质变化,观察其体内致瘤性及肿瘤局部病理学改变,探讨其体内诱导抗肿瘤免疫的作用和用于肿瘤基因治疗的可行性。
由于腺病毒具有转染范围广、转染效率高、操作简便、安全性好等优点[5]而成为较常用的基因转染载体,我们利用X-gal显色证实AdexlLacZ转染FBL3细胞的转染效率达90%以上。对AdexlhMIF转染的FBL3细胞培养上清中MIF的检测表明,转染后4 h MIF即可有一定表达,36 h达高峰(48.6 ng/ml),并可持续约10 d,该结果表明腺病毒载体介导的基因转染是一种高效的基因转染系统,用于MIF基因转染FBL3细胞是切实可行的。
, http://www.100md.com
与AdexlLacZ转染的FBL3细胞和野生型FBL3细胞相比较,AdexlhMIF转染的FBL3细胞形态没有明显变化,体外增殖能力无显著差别,细胞表面MHC-Ⅰ, MHC-Ⅱ, B7-1, B7-2, ICAM-1等分子的表达水平未见明显改变,说明腺病毒转染及分泌到上清中的MIF对FBL3细胞体外生物学特征无明显的直接影响。进一步将MIF基因修饰的FBL3细胞接种入小鼠体内,结果发现肿瘤出现延迟、生长缓慢,小鼠存活期与对照组相比明显延长,局部TNF-α mRNA和Ltn mRNA的表达增加,同时有明显的单核和淋巴细胞浸润,表明局部分泌的MIF能有效地诱发肿瘤局部的免疫反应。该结果预示,若将MIF基因修饰的瘤细胞制备成瘤苗有可能会在体内诱导出抗肿瘤免疫反应,达到抑制肿瘤生长的目的,我们将对此进行深入研究。
[基金项目] 国家自然科学基金资助项目(39670280).
[作者简介] 刘艳君(1972-),女(汉族),硕士,现在第一军医大学免疫学教研室.
, 百拇医药
作者单位:弭静(第二军医大学基础医学部免疫学教研室, 上海 200433.)
张明徽(第二军医大学基础医学部免疫学教研室, 上海 200433.)
陶群(第二军医大学基础医学部免疫学教研室, 上海 200433.)
[参 考 文 献]
[1] Malorny U, Goebeler M, Gutwald J, et al. Differences in migration inhibitory factor production by C57BL/6 and BALB/c mice in allergic and irritant contact dermatitis[J]. Int Arch Allergy Appl Immunol, 1990,92(4):356-360.
, 百拇医药
[2] Calandra T, Echtenacher B, Roy DL, et al. Protection from septic shock by neutralization of macrophage migration inhibitory factor[J]. Nat Med, 2000,6(2): 164-170.
[3] Bernhagen J, Calandra T, Mitchell RA, et al. MIF is a pituitary-derived cytokine that potentiates lethal endotoxaemia[J]. Nature,1993,365(6448):756-759.
[4] Bernhagen J, Bacher M, Calandra T. An essential role for macrophage migration inhibitory factor in the tuberculin delayed-type hypersensitivity reaction[J]. J Exp Med,1996,183(1):277-282.
, http://www.100md.com
[5] Kozarsky KF, Wilson JM. Gene therapy: adenovirus vectors[J]. Curr Opin Genet Dev,1993,3(3):499-503.
[6] Pozzi LA, Weiser WY. Human recombinant migration inhibitory factor activates human macrophages to kill tumor cells[J].Cell Immunol,1992,145(2):372-379.
[收稿日期] 2000-03-10
[修回日期] 2000-06-30, 百拇医药
单位:刘艳君(第二军医大学基础医学部免疫学教研室, 上海 200433.);田野苹(第二军医大学基础医学部免疫学教研室, 上海 200433.);曹雪涛(第二军医大学基础医学部免疫学教研室, 上海 200433.);于益芝(第二军医大学基础医学部免疫学教研室, 上海 200433.);厉永建(第二军医大学基础医学部免疫学教研室, 上海 200433.)
关键词:巨噬细胞游走抑制因子;腺病毒;基因修饰;红白血病细胞
第二军医大学学报000809 [摘要] 目的:研究巨噬细胞游走抑制因子(MIF)基因修饰的FBL3红白血病细胞的生物学性质变化,为探讨其体内诱导抗肿瘤免疫反应的作用奠定基础。方法:以腺病毒介导,将MIF基因导入小鼠FBL3红白血病细胞,观察其体外生物学性质变化。将MIF基因修饰的FBL3细胞(MIF-FBL3)接种小鼠体内,观察其致瘤性和局部病理学变化,同时检测细胞因子mRNA表达。结果:腺病毒能有效地将MIF基因导入FBL3细胞,MIF的分泌可持续10 d。MIF-FBL3细胞形态、增殖能力及表面MHC-Ⅰ,MHC-Ⅱ,B7-1,B7-2,ICAM-1等分子的表达与野生型FBL3细胞相比无明显变化,但在小鼠体内的致瘤性降低,小鼠存活期延长,肿瘤局部可检测出mTNF-α mRNA和mLtn mRNA的表达,并有明显的单核和淋巴细胞浸润。结论:MIF-FBL3细胞体外生物学性质无明显改变,但可能通过分泌MIF在体内激活抗肿瘤免疫功能。
, 百拇医药
[中图分类号] R 730.5 [文献标识码] A
[文章编号] 0258-879X(2000)08-0727-04
Biologic characteristics of MIF gene-modified FBL3 erythroleukemia cell
LIU Yan-Jun TIAN Ye-Ping CAO Xue-Tao YU Yi-Zhi LI Yong-Jian MI Jing ZHANG Ming-Hui TAO Qun
(Department of Immunology, Department of Basic Medicine, Second Military Medical University, Shanghai 200433, China)
, 百拇医药
[ABSTRACT] Objective: To study the role of MIF gene-modified FBL3 erythroleukemia cells (MIF-FBL3) in the induction of antitumor immune responses in vivo. The biologic characteristics of MIF-FBL3 cell were investigated. Methods: The FBL3 cells were transfected by recombinant adenovirus with the gene encoding human MIF (AdexlhMIF). The biologic characteristics of MIF-FBL3 were determined in vitro. The tumorigenicity of MIF-FBL3 in vivo and the pathologic changes of tumor local tissues were observed after the mice were inoculated with MIF-FBL3. The expression of cytokines mRNA in tumor local tissues was detected simultaneously. Results: The transfection efficiency of AdexlhMIF was high and MIF secretion of MIF-FBL3 could last up to 10 days. Although no changes in the morphology, the proliferative ability and the expression of MHC-Ⅰ, MHC-Ⅱ, B7-1,B7-2, ICAM-1 molecules of MIF-FBL3 were observed in vitro,the tumorigenicity of MIF-FBL3 decreased in vivo. The survival periods of the mice inoculated with MIF-FBL3 were prolonged markedly. In the tumor local tissues of the mice inoculated with MIF-FBL3, mTNF-α mRNA and mLtn mRNA could be detected and the infiltration of monocytes and lymphocytes was obvious. Conclusion: The biologic characteristics of MIF-FBL3 remain unchanged in vitro and the antitumor immune functions may be activated by MIF secreted from MIF-FBL3 in vivo.
, 百拇医药
[KEY WORDS] microphage migration-inhibitory factor; adenovirus; gene modification; erythroleukemia cell
巨噬细胞游走抑制因子(macrophage migration inhibitory factor, MIF)曾长期被认为仅是T细胞激活后产生的一种可以抑制巨噬细胞游走的细胞因子,其在感染、炎症和迟发型变态反应等过程中起着重要作用[1~4]。近年来发现MIF分布广泛,具有多种生物学活性,尤其是能促进巨噬细胞释放IL-1,TNF-α,NO, H2O2等,并通过这些因子增强巨噬细胞在体外的杀瘤作用,但目前对MIF在体内抗肿瘤免疫中的作用尚不清楚。因此,本实验应用MIF重组腺病毒AdexlhMIF转染小鼠FBL3红白血病细胞,观察了MIF基因修饰的FBL3细胞体外生物学性质的变化,并对其体内致瘤性、肿瘤局部细胞因子表达水平及组织病理学变化进行了研究,以期为探讨MIF基因修饰的瘤苗在体内诱导抗肿瘤免疫反应的作用奠定基础。
, 百拇医药
1 材料和方法
1.1 动物和细胞株 C57BL/6小鼠,6~8周龄,雄性,SPF级,购自上海西普尔-必凯实验动物有限公司;小鼠红白血病细胞株FBL3细胞由美国克利夫兰医学中心陈卫博士惠赠;人胚肾细胞株293细胞由德国MDC分子医学中心Blankenstein教授惠赠。
1.2 主要试剂 受CMV启动子转录调控、携带目的基因的重组腺病毒AdexlhMIF和AdexlLacZ由日本东京癌症化疗中心分子生物治疗研究部Hirofumi Hamada博士惠赠;MTT购自Fluka公司;X-gal(5-溴-4-氯-3-吲哚-β-半乳糖苷)购自华美生物试剂公司;荧光标记的抗小鼠MHC-Ⅱ,B7-1,B7-2,ICAM-1抗体,抗小鼠MHC-Ⅰ抗体和荧光标记的大鼠抗小鼠二抗,购自PharMingen公司;MIF检测试剂盒,购自R & D公司。
1.3 腺病毒介导的MIF基因修饰FBL3细胞 采用人胚肾细胞株293细胞扩增腺病毒,微量细胞病变法测定病毒滴度[5]。FBL3细胞采用RPMI 1640完全培养基(含10%FCS, 100 U/ml青霉素、100 U/ml链霉素)培养,于对数生长期时更换新鲜的无血清RPMI 1640培养液,按MOI值20分别加入AdexlhMIF或AdexlLacZ,置于37℃,5% CO2孵箱中培养,开始30 min内每10 min振摇1次,使腺病毒与细胞充分接触,继续培养2 h,收集细胞用RPMI 1640洗去未转染的腺病毒,加入新鲜的完全RPMI 1640培养液备用。采用X-gal染色法检测转染率>90%。
, 百拇医药
1.4 MIF基因修饰的FBL3细胞体外增殖能力测定 采用MTT法检测。
1.5 MIF体外分泌水平检测 按ELISA试剂盒说明进行。
1.6 MIF基因修饰FBL3细胞后表面分子检测 转染AdexlhMIF的FBL3细胞培养36~48 h后,以PBS洗2遍,重悬于200 μl PBS中,分别加入荧光标记的抗小鼠MHC-Ⅱ,B7-1,B7-2抗体和抗小鼠MHC-Ⅰ一抗,标记体系为1 μg抗体/2×105个细胞,4℃暗室中孵育30 min,PBS洗2遍。间接标记时再加入荧光标记的二抗,4℃暗室孵育30 min,PBS洗2遍,用流式细胞仪检测荧光强度。
1.7 荷瘤小鼠的制备及致瘤性观察 将小鼠随机分为3组(10只/组),A组:野生型FBL3细胞组(wt-FBL3);B组:AdexlhLacZ转染的FBL3细胞组(LacZ-FBL3);C组:AdexlhMIF转染的FBL3细胞组(MIF-FBL3),分别于左股外侧接种相应的FBL3细胞,每只小鼠接种3×106个(0.1 ml),观察肿瘤生长情况,采用瘤体长短径乘积(mm2)表示肿瘤大小,同时观察各组小鼠存活时间。
, 百拇医药
1.8 肿瘤局部细胞因子表达的检测 于肿瘤发生第17天分别取各实验组小鼠肿瘤组织,以异硫氰酸胍一步法制备总RNA, RT-PCR检测mIL-2, mIL-4, mTNF-α, mLtn等细胞因子的mRNA。 PCR引物序列及扩增参数如下, mIL-2上游引物:5′-TCCACTTCAAGCTCTACAG-3′; 下游引物:5′-GAGTCAAATCCAGAACATGCC-3′。 PCR参数:95℃, 20 s; 54℃, 30 s; 72℃, 30 s; 35个循环。 mIL-4上游引物:5′-ATTATGCATATCCAC-GGATGCGACAA-3′; 下游引物:5′-AAGGATCCTTACGAGTAATCCATTTGCATGA-3′。 PCR参数:95℃, 20 s; 57℃, 30 s; 72℃, 30 s; 35个循环。 mTNF-α上游引物:5′-GCAGGTCTACTTTG-GAGTCA-3′;下游引物:5′-ACATTCGAGGCTCC-
AGTGAA -3′。PCR参数:95℃,20 s;55℃,30 s;72℃,30 s;35个循环。mLtn上游引物:5′-GGAAT-TCGACCTCAGCCATGAGACTTCTC-3′;下游引物:5′-CGGGATCCTTACCCAGTCAGGGTTAC-TGCTGTG-3′。PCR参数:94℃,1 min;60℃,1 min;72℃,2 min;25个循环。
, 百拇医药
1.9 肿瘤局部组织病理分析 于荷瘤第17天处死小鼠,取肿瘤组织做病理学分析,标本用10%中性甲醛固定,经梯度乙醇脱水,二甲苯透明,石蜡包埋,常规切片,苏木精-伊红(H-E)染色后镜检。
1.10 统计学处理 采用未配对计量资料t检验。
2 结 果
2.1 腺病毒介导的MIF基因修饰FBL3细胞后体外MIF分泌水平 由图1可见,AdexlhMIF转染FBL3细胞后4 h即可从其培养上清中检测到MIF,36 h达高峰,为48.6 ng/ml,转染10 d后仍能检测到MIF;而对照腺病毒AdexlLacZ转染的FBL3和野生型FBL3细胞培养上清中均未检测到MIF。
2.2 MIF基因修饰的FBL3细胞体外增殖能力 FBL3细胞分别转染重组腺病毒AdexlhMIF或AdexlLacZ后,培养过程中镜下观察二者与野生型FBL3在形态上无明显差异。培养36~48 h后分别收集各组细胞检测其增殖情况,表明各组间差异不显著(P<0.05)。
, 百拇医药
2.3 MIF基因修饰的FBL3细胞表面分子的表达 FACS检测结果显示,AdexlhMIF转染的FBL3细胞表面的MHC-Ⅰ, MHC-Ⅱ, B7-1, B7-2, ICAM-1分子表达水平与AdexlLacZ-转染的FBL3及野生型FBL3细胞之间无差异。

图4 接种wt-FBL3,LacZ-FBL3和MIF-FBL3的小鼠肿瘤局部组织病理学观察
Fig4 Pathologic analysis of the tumor tissue from the mice inoculated with wt -FBL3,LacZ-FBL3and MIF-FBL 3 Cells(×200)A:wt-FBL3;B:LacZ-FBL3;C:MIF-FBL3

, 百拇医药
图 1 MIF基因修饰FBL3细胞后
培养上清中MIF分泌水平
Fig 1 Level of MIF in supernatants of FBL3
cells modified by MIF gene
○: wt-FBL3; △: LacZ-FBL3; ▲: MIF-FBL3
2.4 MIF基因修饰的FBL3细胞小鼠体内接种后的生长情况 LacZ-FBL3和wt-FBL3组的小鼠在接种瘤细胞8 d后,即可在皮下触摸到瘤体,且瘤体体积增大较快,而MIF-FBL3组出现肿瘤的时间明显延迟,且肿瘤生长缓慢(图2),与对照组相比差异显著(P<0.05)。

, http://www.100md.com
图 2 MIF基因修饰的FBL3细胞
在小鼠体内的生长情况
Fig 2 Growth of MIF gene-modified
FBL3 cells in mice
○: wt-FBL3; △: LacZ-FBL3; □: MIF-FBL3
2.5 小鼠存活期的改变 由图3可见,wt-FBL3组和LacZ-FBL3组小鼠在接种瘤细胞后34 d内全部死亡,而MIF-FBL3组与对照组相比存活期明显延长(P<0.05)。

图 3 接种MIF基因修饰的FBL3
, 百拇医药
细胞后小鼠的存活期
Fig 3 Survival time of the mice inoculated
with MIF gene-modified FBL3 cells
○: wt-FBL3; △: LacZ-FBL3; □: MIF-FBL3
2.6 肿瘤局部组织病理学观察 如图4(图见封三)所示,wt-FBL3组(图4A)和LacZ-FBL3组(图4B)肿瘤细胞增殖活跃,可见核分裂相,并向肌肉组织浸润性生长,瘤灶周围炎性细胞浸润少;而MIF-FBL3组肿瘤生长缓慢,肿瘤周围有明显的炎性细胞浸润,以单核和淋巴细胞为主,并且可见少量粒细胞,肿瘤周围有纤维组织和肉芽组织增生(图4C)。
2.7 肿瘤局部组织细胞因子表达的变化 从图5中可以看出,MIF-FBL3组肿瘤局部mTNF-α和mLtn mRNA表达较LacZ-FBL3组明显增强,wt-FBL3组不表达mTNF-α mRNA,而表达mLtn mRNA很低,mIL-2和mIL-4 mRNA在各组小鼠肿瘤局部均未见表达,表明体内接种MIF基因修饰的FBL3细胞后,局部分泌的MIF可诱导TNF-α,Ltn的表达。
, 百拇医药
3 讨 论
MIF最初是作为T细胞分泌的一种可以抑制巨噬细胞游走的因子而被发现的,以后的研究资料表明,MIF可由多种细胞产生,参与感染、内毒素血症、迟发型变态反应等病理过程,对炎症和免疫反应具有调节作用。现已发现MIF在体外能促使巨噬细胞分泌IL-1β, TNF-α, IFN-γ, NO等因子,进而增强巨噬细胞杀伤肿瘤细胞的作用[6],但MIF在体内

图 5 接种3种FBL3的小鼠肿瘤局部mTNF-α mRNA(A)和mLtn mRNA(B)的表达
Fig 5 Expression of mTNF-α mRNA(A) and mLtn mRNA(B) in the tumor
tissues from the mice inoculated with 3 types of FBL3 cells
, 百拇医药
a: Marker; b: wt-FBL3; c: LacZ-FBL3; d: MIF-FBL3
抗肿瘤免疫中是否起作用尚不了解。本实验是基于目前对MIF生物活性的认识和已获得MIF腺病毒载体的有利条件下,研究重组MIF腺病毒转染的瘤细胞在体外的生物学性质变化,观察其体内致瘤性及肿瘤局部病理学改变,探讨其体内诱导抗肿瘤免疫的作用和用于肿瘤基因治疗的可行性。
由于腺病毒具有转染范围广、转染效率高、操作简便、安全性好等优点[5]而成为较常用的基因转染载体,我们利用X-gal显色证实AdexlLacZ转染FBL3细胞的转染效率达90%以上。对AdexlhMIF转染的FBL3细胞培养上清中MIF的检测表明,转染后4 h MIF即可有一定表达,36 h达高峰(48.6 ng/ml),并可持续约10 d,该结果表明腺病毒载体介导的基因转染是一种高效的基因转染系统,用于MIF基因转染FBL3细胞是切实可行的。
, http://www.100md.com
与AdexlLacZ转染的FBL3细胞和野生型FBL3细胞相比较,AdexlhMIF转染的FBL3细胞形态没有明显变化,体外增殖能力无显著差别,细胞表面MHC-Ⅰ, MHC-Ⅱ, B7-1, B7-2, ICAM-1等分子的表达水平未见明显改变,说明腺病毒转染及分泌到上清中的MIF对FBL3细胞体外生物学特征无明显的直接影响。进一步将MIF基因修饰的FBL3细胞接种入小鼠体内,结果发现肿瘤出现延迟、生长缓慢,小鼠存活期与对照组相比明显延长,局部TNF-α mRNA和Ltn mRNA的表达增加,同时有明显的单核和淋巴细胞浸润,表明局部分泌的MIF能有效地诱发肿瘤局部的免疫反应。该结果预示,若将MIF基因修饰的瘤细胞制备成瘤苗有可能会在体内诱导出抗肿瘤免疫反应,达到抑制肿瘤生长的目的,我们将对此进行深入研究。
[基金项目] 国家自然科学基金资助项目(39670280).
[作者简介] 刘艳君(1972-),女(汉族),硕士,现在第一军医大学免疫学教研室.
, 百拇医药
作者单位:弭静(第二军医大学基础医学部免疫学教研室, 上海 200433.)
张明徽(第二军医大学基础医学部免疫学教研室, 上海 200433.)
陶群(第二军医大学基础医学部免疫学教研室, 上海 200433.)
[参 考 文 献]
[1] Malorny U, Goebeler M, Gutwald J, et al. Differences in migration inhibitory factor production by C57BL/6 and BALB/c mice in allergic and irritant contact dermatitis[J]. Int Arch Allergy Appl Immunol, 1990,92(4):356-360.
, 百拇医药
[2] Calandra T, Echtenacher B, Roy DL, et al. Protection from septic shock by neutralization of macrophage migration inhibitory factor[J]. Nat Med, 2000,6(2): 164-170.
[3] Bernhagen J, Calandra T, Mitchell RA, et al. MIF is a pituitary-derived cytokine that potentiates lethal endotoxaemia[J]. Nature,1993,365(6448):756-759.
[4] Bernhagen J, Bacher M, Calandra T. An essential role for macrophage migration inhibitory factor in the tuberculin delayed-type hypersensitivity reaction[J]. J Exp Med,1996,183(1):277-282.
, http://www.100md.com
[5] Kozarsky KF, Wilson JM. Gene therapy: adenovirus vectors[J]. Curr Opin Genet Dev,1993,3(3):499-503.
[6] Pozzi LA, Weiser WY. Human recombinant migration inhibitory factor activates human macrophages to kill tumor cells[J].Cell Immunol,1992,145(2):372-379.
[收稿日期] 2000-03-10
[修回日期] 2000-06-30, 百拇医药