酵母双杂合体系研究丙型肝炎病毒进入肝细胞的受体
作者:梁庆华 蒋栋 谢尧 高建恩 范涛 陶其敏
单位:北京大学人民医院肝病研究所,北京 100044
关键词:肝炎病毒;丙型;病毒包膜蛋白质类;脂蛋白类;VLDL;酵母菌;肝炎;丙型
北京医科大学学报000617 [摘 要]目的:用酵母双杂合体系筛选肝细胞 cDNA文库,寻找与丙型肝炎(丙肝)病毒(hepatitis C virus,HCV)胞膜蛋白2(E2)相作用蛋白的基因,探讨HCV与肝细胞的相互作用,寻找HCV进入细胞的受体。方法:以HCV E2蛋白胞外区片段,构建酵母双杂合体系中“饵”载体,从成人肝细胞cDNA文库筛选与HCV E2相作用蛋白的基因。结果:筛出的阳性克隆基因序列分析后,经GenBank查询,与人的apo CⅢ同源,同源性为98%。结论:HCV E2蛋白能与人的apo CⅢ在酵母双杂合体系中结合,但其相互作用与HCV进入细胞间的关系待进一步研究。
, 百拇医药
[中图分类号]R512.6 [文献标识码]A
[文章编号]1000-1530(2000)06-0540-03
Study on the receptor of HCV entry into the hepatocyte by yeast two-hybrid system
LIANG Qing-Hua,JIANG Dong,XIE Yao,GAO Jian-En,FAN Tao,TAO Qi-Min
(Hepatology Institute,Peking University People's Hospital,Beijing 100044,China)
ABSTRACT Objective:To select the gene from human liver cDNA library which can transform the protein that can interact with HCV E2 protein by yeast two-hybrid system and look for the receptor by which HCV enters the host cell.Methods:Hepatitis C virus E2 gene without transmembrane domain was used to construct the “bait plasmid” to look for the gene from the cDNA library,which expressed the protein that could interact with the HCV E2 protein.Results:After sequencing the positive clone was provided to the GenBank.It showed that the cDNA was homologous to the human apolipoprotein CⅢ (identities 98%).Conclusion:HCV E2 protein can interact with human apoC Ⅲ in the yeast two hybrid system.But the relationship of the HCV-vLDL and the HCV entering the host is still being studied.
, 百拇医药
KEY WORDS Hepatitis C virus;Viral envelope proteins;Lipoproteins,VLDL;Yeasts;Hepatitis C
丙型肝炎病毒(hepatitis C virus,HCV)是导致经血液传播非甲非乙型肝炎的主要原因。其特征为较高的慢性化(70%以上)、持续感染,可导致肝癌、肝硬化及自身免疫性疾病。HCV感染具有宿主特异性。这有碍于HCV的体外研究。其宿主特异性又取决于病毒入胞的受体特异性,而HCV的入胞机制目前还不清楚[1]。
HCV属于黄病毒属,有包膜。其基因组编码两个包膜糖蛋白E1(gp31)和E2(gp70)。重组的E1/E2蛋白免疫黑猩猩后,能起到一定的保护作用[2]。缺乏E2单独表达的E1蛋白并不能离开内质网,而E1的正确折叠又需要与E2的共同表达。而E2蛋白能够独立正确表达,E2又是HCV的主要膜蛋白,含有中和表位[3],因此,能够通过研究E2阐明HCV与细胞作用的机制。
, 百拇医药
1 材料与方法
1.1 载体的构建
1.1.1 “诱饵”克隆的建立(图1) 将不含疏水区的HCV E2基因片段E2-661,以T4连接酶连于含GAL4结合结构域的pAS2-1载体上构成诱饵质粒pAS2-1-E2-661,转入酵母细胞后,Western blotting[4]鉴定是否有融合蛋白的表达,用滤膜法排除其自身激活作用。
1.1.2 对照克隆 阳性对照有:(1)表达DNA-BD/p53融合蛋白的载体pVA3-1,编码AD/SV40大T-抗原融合蛋白的载体pTD1-1,p53蛋白能够与SV40大T-抗原结合。(2)含有野生型全长GAL4基因的载体pCL1。阴性对照:在pAS2-1中装有核膜蛋白序列的载体pLAM5′-1。
, 百拇医药
图1 pAS2-1-E2-661“诱饵”质粒构建
Figure 1 Construction of pAS2-E2-661 “bait” plasmid
1.2 cDNA文库的滴定、扩增及质粒提取
成年人肝细胞的cDNA 文库购自Clontech 公司,cDNA 片段克隆于含GAL4激活结构域的pACT2载体上。文库滴定后,按其容量的4倍(1.4×107个克隆)进行扩增,收集菌体,以碱裂解法提取质粒[4]。
1.3 酵母菌株及培养基
AH109(trp,leu,his,ade2基因缺失,带有由3个不同启动装置MEL1,GAL1,和 GAL2所控制的报告基因LacZ,his,ade2)用YPD培养基培养,转化DNA结合结构域质粒后,用色氨酸营养缺乏培养基选择性培养(SD/-trp),转化cDNA文库后,用4种氨基酸营养缺乏培养基选择性培养(SD/-trp,leu,his,ade2)。
, http://www.100md.com
1.4 酵母转化方法
用乙酸锂转化法[5]。共转化后的酵母培养于SD/-trp,leu,his,ade2营养选择性培养基,30 ℃温育7 d。
1.5 LacZ活性测定
用滤膜转印法。将共转化后,生长于SD/-trp leu,his,ade2中的菌落分别印迹到无菌Whatman 滤纸上,液氮中浸泡10~15 s,2次,将滤纸菌面向上,置于浸有Z缓冲液/x-gal的滤纸上面,防止气泡产生,30 ℃温育,在25 min~8 h变蓝的菌落为阳性克隆,超过8 h变蓝的为假阳性。
1.6 分离实验排除Ⅰ类假阳性
利用分离实验[6]排除Ⅰ类假阳性(AD:cDNA 融合蛋白不与BD融合蛋白结合,自身能够激活报告基因;或者同时有多个pAD:cDNA转入了酵母,而其中之一具有自身激活作用)。将阳性克隆在无选择培养液YPD中培养过夜,再转入SD/-leu培养液中培养过夜后,将其稀释10倍,取100 μl 铺于SD/-leu培养皿中,30 ℃温育3 d,再将其分别接种于SD/-trp,SD/-his和SD/-trp,leu培养皿中,标明方向,30 ℃温育1~2 d。然后根据各个克隆在不同的选择性培养基上的生长情况进行判断,结论可能有4种情况:(1)真阳性;(2)假阳性(即AD:cDNA自身激活报告基因);(3)真阳性,但酵母细胞中同时还存在另一个无自身激活作用的pAD:cDNA;(4)自身激活作用的假阳性细胞中同时还存在另一个无自身激活作用的pAD:cDNA。
, 百拇医药
1.7 回转实验
用玻璃珠破细胞法[5]提取阳性酵母中的质粒,同时用CaCl2法将其转入大肠杆菌中[4],扩增、提取、纯化后,对质粒进行分析。
双酶切电泳分析质粒,将片段大小相同者进行归类(图2),再将同一类质粒以克隆位点两侧的引物做PCR扩增各克隆的插入片段。PCR产物纯化后,用HaeⅢ酶切分析鉴定相同的克隆(图3)。最后,将没有重复的真阳性pAD:cDNA质粒,分别回转入含有pAS2-1-E2-661的酵母AH109。铺于SD/-trp,leu,和SD/-trp,leu,his,ade2中,再次鉴定真阳性,同时可以评价分离实验的效果。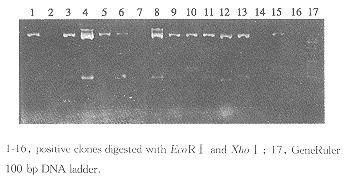
图2 阳性克隆的酶切鉴定
, 百拇医药
Figure 2 Positive clones verified by restriction endonucleases
1.8 确认第Ⅱ、Ⅲ类假阳性
将所筛阳性pAD:cDNA质粒分别转入含有阴性对照质粒pLAM5′-1和空质粒pAS2-1的酵母细胞中,用SD/-trp,leu,his,ade2培养基排除第Ⅱ、Ⅲ类假阳性。
1.9 DNA序列分析
阳性克隆测序后,提交GenBank数据库。
2 结果
2.1 “饵”载体的构建
“饵”载体pAS2-1-E2-661能在酵母细胞中稳定表达E2-661蛋白,没有报告基因激活作用,能够用于酵母双杂合的筛库工作。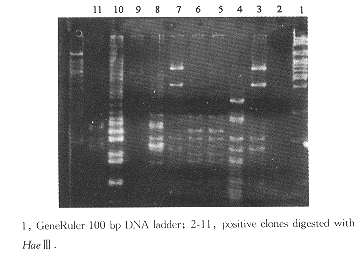
, 百拇医药
图3 阳性克隆的HaeⅢ酶切鉴定
Figure 3 Positive clones verified by restriction endonucleases HaeⅢ
2.2 文库筛选
用100 μg的cDNA质粒转化含有pAS2-1E2-661的酵母AH109,在SD/-trp,leu培养基上得到5×106转化子,其转化子数大于cDNA文库的容量4.5×106个克隆。因此,转化效率可保证被筛文库的完整性。在SD/-trp,leu,his,ade2培养基上得到68个大而饱满的阳性克隆。将其经LacZ活性测定,35个为LacZ+。分离及回转实验筛选后,排除了相同克隆及假阳性克隆。最后对6个进行了测序。
2.3 阳性克隆的DNA序列分析
, http://www.100md.com
对筛选出的具有代表性的阳性克隆进行序列分析。用载体pACT2多克隆位点的上游引物,对融合于GAL4的开放读码框架(ORF)进行测序。结果提交GenBank数据库后,其中2个与人的apoCⅢ同源,同源性98%(图4)。
3 讨论
酵母双杂合系统是一种在体内研究蛋白相互作用的方法[7],用于真核蛋白的研究更能保持蛋白的真核特征。它已广泛地应用于蛋白-蛋白相互作用[8],不仅应用于检测与病毒蛋白相作用的蛋白[9],而且已被用于蛋白与受体间的相互作用[10]。在酵母细胞中真核蛋白能够保持正常的形态及折叠,而受体是否糖基化对其亲和力几乎没有影响[11]。因此,酵母双杂合系统较最初设想的更适用于受体-配体间的作用。
, http://www.100md.com
图4 阳性克隆序列与人的apoCⅢ序列比较
Figure 4 Sequences of positive clones and the apoCⅢ cDNA
HCV E2蛋白是HCV的结构蛋白,由细胞和病毒的蛋白酶从HCV的多聚蛋白前体上切下。位于内质网腔的细胞信号肽酶与此结构区的形成有关[1]。E2的C末端有一疏水区,将此区删去(至少31aa)可产生一可溶的分泌型蛋白。而且,只要保持到661aa就可产生分泌型E2蛋白[3]。我们所克隆的饵载体pAS2-1-E2-661既保持了E2蛋白的正确折叠,又不会被锚定于ER。因此,可以用于酵母双杂合系统。
ApoCⅢ是极低密度脂蛋白(very low density lipoprotein,vLDL)的主要组成部分。Prince等[2]用PCR从vLDL颗粒中扩增出了HCV;经超速离心分离出HCV感染血清中的vLDL蛋白,用脱氧胆酸处理后,蔗糖悬浮得到高度纯化的病毒颗粒。这些颗粒均能被抗-HCV E2单克隆抗体捕获。从而说明E2存在于HCV颗粒表面,而此颗粒又能与vLDL结合。另一实验是在对继发于HCV感染的混合性冷球蛋白血症的研究中发现,HCV- vLDL的结合减少了HCV侵入肝细胞,从而提出:(1)HCV- vLDL 复合物的形成减少了HCV通过低密度脂蛋白受体(low density lipoprotein receptor,LDLR)进入肝细胞。(2)HCV- vLDL 复合物能够通过LDLR进入肝细胞,但它刺激机体产生的mRF又阻碍了其进入细胞。HCV- vLDL 复合物又是原始B淋巴细胞增殖的主要抗原物质。因此,混合性冷球蛋白血症患者发展为肝硬化的速度较慢[13]。
, 百拇医药
本实验利用酵母双杂合的方法,从成人肝细胞cDNA 文库中筛选出能与HCV 包膜糖蛋白Ⅲ相作用的蛋白vLDL。关于vLDL与HCV结合后是引导、还是阻止HCV进入肝细胞,还在继续研究。
参考文献
1,Saito T,Miyamura T,Ohbayashi A,et al.Hepatitis C virus infection is associated with the development of hepatocellular carcinoma[J].Proc Natl Acad Sci USA,1990,87:6547-6549
2,Choo QL,Kuo G,Ralston R,et al.Vaccination of Chimpanzees against infection by the HCV[J].Natl Acad Sci USA,1994,91:1294
, 百拇医药
3,Michalak JP,Wychowski C,Choukhi A,et al.Charactorization of truncated forms of hepatitis C glyproteins[J].J Gen Virol,1997,78:2299-2306
4,Ausubel FM,Brent R,Kingston RE,et al.Short protocols in molecular biology[M].3th ed.New York:John Wiley & Son Inc,1993.205-214
5,Gietz D,Jean S,Woods A,et al.Improved method for high efficiency transformation of intact yeast cells[J].Nucleic Acids Res,1992,20:1425
, 百拇医药
6,Bartel P,Chien CT,Sternglanz R,et al.Elimination of false positives that arise in using the two hybrid system[J].Biotechniques,1993,14:920-924
7,Fields S,Song OK.A novel genetic system to detect protein-protein interactions[J].Nature,1989,340(20):245-246
8,Lama J,Trono D.Human immunodeficiency virus typy Ⅰ matrix protein interacts with cellular protein HO3[J].J Virol,1998,72(2):1671-1676
9,Hsieh TY,Matsumoto M,Chou HC,et al.Hepatitis C virus core protein interactions with heterogeneous nuclear ribonucleoprotein K[J].J Biol Chem,1998,273(28):17651-17659
, 百拇医药
10,Konig S,Beterams G,Nassal M.Mapping of homologous interaction sites in the hepatitis B virus core protein[J].J Virol,1998,72(6):4997-5005
11,Ozenberger BA,Young KH.Functional interaction of ligands and receptors of the hemitopoietic superfamily in yeast[J].Mol Endocrinol,1995,9:1321-1329
12,Prince AM,Huima-Byron T,Parker TS,et al.Visualization of hepatitis C virions and putative defective interfering particles isolated from low density lipoproteins[J].J Viral Hepat,1996,3(1):11-17
13,Agnello V.The etiology and pathophysiology of mixed cryoglobulinemia secondary to hepatitis C virus infection[J].Springer Semin Immunopathol,1997,19(1):111-29
收稿日期:1999-05-07, http://www.100md.com
单位:北京大学人民医院肝病研究所,北京 100044
关键词:肝炎病毒;丙型;病毒包膜蛋白质类;脂蛋白类;VLDL;酵母菌;肝炎;丙型
北京医科大学学报000617 [摘 要]目的:用酵母双杂合体系筛选肝细胞 cDNA文库,寻找与丙型肝炎(丙肝)病毒(hepatitis C virus,HCV)胞膜蛋白2(E2)相作用蛋白的基因,探讨HCV与肝细胞的相互作用,寻找HCV进入细胞的受体。方法:以HCV E2蛋白胞外区片段,构建酵母双杂合体系中“饵”载体,从成人肝细胞cDNA文库筛选与HCV E2相作用蛋白的基因。结果:筛出的阳性克隆基因序列分析后,经GenBank查询,与人的apo CⅢ同源,同源性为98%。结论:HCV E2蛋白能与人的apo CⅢ在酵母双杂合体系中结合,但其相互作用与HCV进入细胞间的关系待进一步研究。
, 百拇医药
[中图分类号]R512.6 [文献标识码]A
[文章编号]1000-1530(2000)06-0540-03
Study on the receptor of HCV entry into the hepatocyte by yeast two-hybrid system
LIANG Qing-Hua,JIANG Dong,XIE Yao,GAO Jian-En,FAN Tao,TAO Qi-Min
(Hepatology Institute,Peking University People's Hospital,Beijing 100044,China)
ABSTRACT Objective:To select the gene from human liver cDNA library which can transform the protein that can interact with HCV E2 protein by yeast two-hybrid system and look for the receptor by which HCV enters the host cell.Methods:Hepatitis C virus E2 gene without transmembrane domain was used to construct the “bait plasmid” to look for the gene from the cDNA library,which expressed the protein that could interact with the HCV E2 protein.Results:After sequencing the positive clone was provided to the GenBank.It showed that the cDNA was homologous to the human apolipoprotein CⅢ (identities 98%).Conclusion:HCV E2 protein can interact with human apoC Ⅲ in the yeast two hybrid system.But the relationship of the HCV-vLDL and the HCV entering the host is still being studied.
, 百拇医药
KEY WORDS Hepatitis C virus;Viral envelope proteins;Lipoproteins,VLDL;Yeasts;Hepatitis C
丙型肝炎病毒(hepatitis C virus,HCV)是导致经血液传播非甲非乙型肝炎的主要原因。其特征为较高的慢性化(70%以上)、持续感染,可导致肝癌、肝硬化及自身免疫性疾病。HCV感染具有宿主特异性。这有碍于HCV的体外研究。其宿主特异性又取决于病毒入胞的受体特异性,而HCV的入胞机制目前还不清楚[1]。
HCV属于黄病毒属,有包膜。其基因组编码两个包膜糖蛋白E1(gp31)和E2(gp70)。重组的E1/E2蛋白免疫黑猩猩后,能起到一定的保护作用[2]。缺乏E2单独表达的E1蛋白并不能离开内质网,而E1的正确折叠又需要与E2的共同表达。而E2蛋白能够独立正确表达,E2又是HCV的主要膜蛋白,含有中和表位[3],因此,能够通过研究E2阐明HCV与细胞作用的机制。
, 百拇医药
1 材料与方法
1.1 载体的构建
1.1.1 “诱饵”克隆的建立(图1) 将不含疏水区的HCV E2基因片段E2-661,以T4连接酶连于含GAL4结合结构域的pAS2-1载体上构成诱饵质粒pAS2-1-E2-661,转入酵母细胞后,Western blotting[4]鉴定是否有融合蛋白的表达,用滤膜法排除其自身激活作用。
1.1.2 对照克隆 阳性对照有:(1)表达DNA-BD/p53融合蛋白的载体pVA3-1,编码AD/SV40大T-抗原融合蛋白的载体pTD1-1,p53蛋白能够与SV40大T-抗原结合。(2)含有野生型全长GAL4基因的载体pCL1。阴性对照:在pAS2-1中装有核膜蛋白序列的载体pLAM5′-1。

, 百拇医药
图1 pAS2-1-E2-661“诱饵”质粒构建
Figure 1 Construction of pAS2-E2-661 “bait” plasmid
1.2 cDNA文库的滴定、扩增及质粒提取
成年人肝细胞的cDNA 文库购自Clontech 公司,cDNA 片段克隆于含GAL4激活结构域的pACT2载体上。文库滴定后,按其容量的4倍(1.4×107个克隆)进行扩增,收集菌体,以碱裂解法提取质粒[4]。
1.3 酵母菌株及培养基
AH109(trp,leu,his,ade2基因缺失,带有由3个不同启动装置MEL1,GAL1,和 GAL2所控制的报告基因LacZ,his,ade2)用YPD培养基培养,转化DNA结合结构域质粒后,用色氨酸营养缺乏培养基选择性培养(SD/-trp),转化cDNA文库后,用4种氨基酸营养缺乏培养基选择性培养(SD/-trp,leu,his,ade2)。
, http://www.100md.com
1.4 酵母转化方法
用乙酸锂转化法[5]。共转化后的酵母培养于SD/-trp,leu,his,ade2营养选择性培养基,30 ℃温育7 d。
1.5 LacZ活性测定
用滤膜转印法。将共转化后,生长于SD/-trp leu,his,ade2中的菌落分别印迹到无菌Whatman 滤纸上,液氮中浸泡10~15 s,2次,将滤纸菌面向上,置于浸有Z缓冲液/x-gal的滤纸上面,防止气泡产生,30 ℃温育,在25 min~8 h变蓝的菌落为阳性克隆,超过8 h变蓝的为假阳性。
1.6 分离实验排除Ⅰ类假阳性
利用分离实验[6]排除Ⅰ类假阳性(AD:cDNA 融合蛋白不与BD融合蛋白结合,自身能够激活报告基因;或者同时有多个pAD:cDNA转入了酵母,而其中之一具有自身激活作用)。将阳性克隆在无选择培养液YPD中培养过夜,再转入SD/-leu培养液中培养过夜后,将其稀释10倍,取100 μl 铺于SD/-leu培养皿中,30 ℃温育3 d,再将其分别接种于SD/-trp,SD/-his和SD/-trp,leu培养皿中,标明方向,30 ℃温育1~2 d。然后根据各个克隆在不同的选择性培养基上的生长情况进行判断,结论可能有4种情况:(1)真阳性;(2)假阳性(即AD:cDNA自身激活报告基因);(3)真阳性,但酵母细胞中同时还存在另一个无自身激活作用的pAD:cDNA;(4)自身激活作用的假阳性细胞中同时还存在另一个无自身激活作用的pAD:cDNA。
, 百拇医药
1.7 回转实验
用玻璃珠破细胞法[5]提取阳性酵母中的质粒,同时用CaCl2法将其转入大肠杆菌中[4],扩增、提取、纯化后,对质粒进行分析。
双酶切电泳分析质粒,将片段大小相同者进行归类(图2),再将同一类质粒以克隆位点两侧的引物做PCR扩增各克隆的插入片段。PCR产物纯化后,用HaeⅢ酶切分析鉴定相同的克隆(图3)。最后,将没有重复的真阳性pAD:cDNA质粒,分别回转入含有pAS2-1-E2-661的酵母AH109。铺于SD/-trp,leu,和SD/-trp,leu,his,ade2中,再次鉴定真阳性,同时可以评价分离实验的效果。

图2 阳性克隆的酶切鉴定
, 百拇医药
Figure 2 Positive clones verified by restriction endonucleases
1.8 确认第Ⅱ、Ⅲ类假阳性
将所筛阳性pAD:cDNA质粒分别转入含有阴性对照质粒pLAM5′-1和空质粒pAS2-1的酵母细胞中,用SD/-trp,leu,his,ade2培养基排除第Ⅱ、Ⅲ类假阳性。
1.9 DNA序列分析
阳性克隆测序后,提交GenBank数据库。
2 结果
2.1 “饵”载体的构建
“饵”载体pAS2-1-E2-661能在酵母细胞中稳定表达E2-661蛋白,没有报告基因激活作用,能够用于酵母双杂合的筛库工作。

, 百拇医药
图3 阳性克隆的HaeⅢ酶切鉴定
Figure 3 Positive clones verified by restriction endonucleases HaeⅢ
2.2 文库筛选
用100 μg的cDNA质粒转化含有pAS2-1E2-661的酵母AH109,在SD/-trp,leu培养基上得到5×106转化子,其转化子数大于cDNA文库的容量4.5×106个克隆。因此,转化效率可保证被筛文库的完整性。在SD/-trp,leu,his,ade2培养基上得到68个大而饱满的阳性克隆。将其经LacZ活性测定,35个为LacZ+。分离及回转实验筛选后,排除了相同克隆及假阳性克隆。最后对6个进行了测序。
2.3 阳性克隆的DNA序列分析
, http://www.100md.com
对筛选出的具有代表性的阳性克隆进行序列分析。用载体pACT2多克隆位点的上游引物,对融合于GAL4的开放读码框架(ORF)进行测序。结果提交GenBank数据库后,其中2个与人的apoCⅢ同源,同源性98%(图4)。
3 讨论
酵母双杂合系统是一种在体内研究蛋白相互作用的方法[7],用于真核蛋白的研究更能保持蛋白的真核特征。它已广泛地应用于蛋白-蛋白相互作用[8],不仅应用于检测与病毒蛋白相作用的蛋白[9],而且已被用于蛋白与受体间的相互作用[10]。在酵母细胞中真核蛋白能够保持正常的形态及折叠,而受体是否糖基化对其亲和力几乎没有影响[11]。因此,酵母双杂合系统较最初设想的更适用于受体-配体间的作用。

, http://www.100md.com
图4 阳性克隆序列与人的apoCⅢ序列比较
Figure 4 Sequences of positive clones and the apoCⅢ cDNA
HCV E2蛋白是HCV的结构蛋白,由细胞和病毒的蛋白酶从HCV的多聚蛋白前体上切下。位于内质网腔的细胞信号肽酶与此结构区的形成有关[1]。E2的C末端有一疏水区,将此区删去(至少31aa)可产生一可溶的分泌型蛋白。而且,只要保持到661aa就可产生分泌型E2蛋白[3]。我们所克隆的饵载体pAS2-1-E2-661既保持了E2蛋白的正确折叠,又不会被锚定于ER。因此,可以用于酵母双杂合系统。
ApoCⅢ是极低密度脂蛋白(very low density lipoprotein,vLDL)的主要组成部分。Prince等[2]用PCR从vLDL颗粒中扩增出了HCV;经超速离心分离出HCV感染血清中的vLDL蛋白,用脱氧胆酸处理后,蔗糖悬浮得到高度纯化的病毒颗粒。这些颗粒均能被抗-HCV E2单克隆抗体捕获。从而说明E2存在于HCV颗粒表面,而此颗粒又能与vLDL结合。另一实验是在对继发于HCV感染的混合性冷球蛋白血症的研究中发现,HCV- vLDL的结合减少了HCV侵入肝细胞,从而提出:(1)HCV- vLDL 复合物的形成减少了HCV通过低密度脂蛋白受体(low density lipoprotein receptor,LDLR)进入肝细胞。(2)HCV- vLDL 复合物能够通过LDLR进入肝细胞,但它刺激机体产生的mRF又阻碍了其进入细胞。HCV- vLDL 复合物又是原始B淋巴细胞增殖的主要抗原物质。因此,混合性冷球蛋白血症患者发展为肝硬化的速度较慢[13]。
, 百拇医药
本实验利用酵母双杂合的方法,从成人肝细胞cDNA 文库中筛选出能与HCV 包膜糖蛋白Ⅲ相作用的蛋白vLDL。关于vLDL与HCV结合后是引导、还是阻止HCV进入肝细胞,还在继续研究。
参考文献
1,Saito T,Miyamura T,Ohbayashi A,et al.Hepatitis C virus infection is associated with the development of hepatocellular carcinoma[J].Proc Natl Acad Sci USA,1990,87:6547-6549
2,Choo QL,Kuo G,Ralston R,et al.Vaccination of Chimpanzees against infection by the HCV[J].Natl Acad Sci USA,1994,91:1294
, 百拇医药
3,Michalak JP,Wychowski C,Choukhi A,et al.Charactorization of truncated forms of hepatitis C glyproteins[J].J Gen Virol,1997,78:2299-2306
4,Ausubel FM,Brent R,Kingston RE,et al.Short protocols in molecular biology[M].3th ed.New York:John Wiley & Son Inc,1993.205-214
5,Gietz D,Jean S,Woods A,et al.Improved method for high efficiency transformation of intact yeast cells[J].Nucleic Acids Res,1992,20:1425
, 百拇医药
6,Bartel P,Chien CT,Sternglanz R,et al.Elimination of false positives that arise in using the two hybrid system[J].Biotechniques,1993,14:920-924
7,Fields S,Song OK.A novel genetic system to detect protein-protein interactions[J].Nature,1989,340(20):245-246
8,Lama J,Trono D.Human immunodeficiency virus typy Ⅰ matrix protein interacts with cellular protein HO3[J].J Virol,1998,72(2):1671-1676
9,Hsieh TY,Matsumoto M,Chou HC,et al.Hepatitis C virus core protein interactions with heterogeneous nuclear ribonucleoprotein K[J].J Biol Chem,1998,273(28):17651-17659
, 百拇医药
10,Konig S,Beterams G,Nassal M.Mapping of homologous interaction sites in the hepatitis B virus core protein[J].J Virol,1998,72(6):4997-5005
11,Ozenberger BA,Young KH.Functional interaction of ligands and receptors of the hemitopoietic superfamily in yeast[J].Mol Endocrinol,1995,9:1321-1329
12,Prince AM,Huima-Byron T,Parker TS,et al.Visualization of hepatitis C virions and putative defective interfering particles isolated from low density lipoproteins[J].J Viral Hepat,1996,3(1):11-17
13,Agnello V.The etiology and pathophysiology of mixed cryoglobulinemia secondary to hepatitis C virus infection[J].Springer Semin Immunopathol,1997,19(1):111-29
收稿日期:1999-05-07, http://www.100md.com