高渗氯化钠溶液对原代培养海马神经细胞容积的影响
作者:袁世荧曾邦雄
单位:同济医科大学附属协和医院麻醉学教研室,武汉市(430022)
关键词:海马神经细胞;细胞容积;高渗溶液
临床麻醉学杂志000310
摘要 目的:观察海马神经细胞的容积在不同浓度 高渗NaCl溶液中7天内的变化。方法 :原代培养妊娠大白鼠胚胎的海马神经细胞,用细胞内水分含量的测定方法测量其暴露于高 渗NaCl溶液15分钟后的细胞容积。结果:细胞暴露于不同浓度的NaCl溶液15分 钟,细胞容积与同一实验时间的对照值相比无显著性差异(P>0.05)。60分钟 后, 所有细胞明显肿胀。1天后至第7天,各组细胞容积基本恢复至对照组细胞容积水平(P> 0.05)。结论:海马神经细胞在暴露于高渗溶液后具有细胞容积调节功能。尽管当细 胞重 新置入等渗培养液后肿胀,但1天后直到第7天,细胞容积能够重新恢复至原来的水平。
, http://www.100md.com
Effect of Hypertonic NaCl Saline on Cell Volume of Cultured Hippocampal Neu rons in Vitro
Yuan Shiying,Zeng Bangxiong
(Department of Anesthesiology,Xiehe Hospi tal,Tongji Medical University,Wuhan 430022)
Abstract Objective: Changes of cell volum e in cultured hippocampal neurons in vit ro were observed after being exposed to the different concentrations of hyperton ic NaCl saline.Methods:Hippocampal neuro ns of the rat embryo were cultured primari lly and exposed to cell culture medium w i th 0.05%,0.10% and 0.25% NaCl solution f or 15min.Results:There were no significa nt differences(P>0.05) between cell vo lu me in experimental group and control gro up after exposed to hypertonic NaCl sali ne for 15min.After 60min,all neurons swe lled significantly.1 and 7 days later,al l neurons shrinked again and restored t heir volume to the value in control grou p (P>0.05).Conclusion:Hippocampal neur on s are able to restore their cell volume after exposed to hypertonic saline.
, 百拇医药
Key words Hippocampal neuron Cell volume Hypertoni c saline
对于颅脑损伤伴失血性休克病人的紧急治疗,高渗溶液(如7.5%NaCl)因能够快速恢复循环血容量、改善器官灌注和微循环、降低颅内压以及减轻脑水肿而重新得到重视和更进一步的研究[1~3]。
有关脑细胞在高渗环境中的反应,以及能否保持其容积的稳定,尚未见报道。由于海马组织对缺血、缺氧以及机械性损伤极为敏感,本实验原代培养大白鼠胚胎海马神经细胞,观察其容积在不同浓度高渗NaCl溶液中的变化。
材料与方法
细胞培养 将妊娠18~20天的大白鼠用乙醚处死。在细胞培养工作台下剖腹取出胚胎,将它断头,取出脑组织,分离出海马。海马神经细胞的培养按照Banker等[4]的方法进行。
, http://www.100md.com
不同浓度高渗溶液环境的模拟 用不同量的7.5%NaCl溶液与新鲜细胞培养基混合,使混合液中的NaCl浓度分别为0.05%、0.1%和0.25%。由于细胞培养基为等渗溶液,上述0.25%、0.1%以及0.05%NaCl的混合液的渗透量浓度分别为375、333和310mosm/L,分别与临床及实验研究中静脉注入7.5%NaCl末期、5分钟及15分钟时的血浆渗透量浓度相一致[3]。培养10~12天的海马神经细胞用于实验。吸弃细胞培养液,换入等量的上述各混合液,置入培养箱中。15分钟后吸弃混合液,用Hank′s缓冲液洗涤细胞两次。再换入新鲜细胞培养基,重新置回培养箱。分别在细胞暴露于混合液前及暴露于混合液后15分钟和(已换入新鲜培养基)60分钟、1天和7天测试细胞的容积。
细胞容积的测量 采用细胞内水分含量的测定方法[5],细胞容积用μ1/100μg蛋白质表示。
统计分析 所得结果以与对照组细胞容积(作为100)相比所得的平均相对细胞容积±标准差表示。实验组和对照组细胞容积的比较采用非参数统计方法的两组数据秩和检验法(Mann-Whithey法)。P<0.05表示有显著差异。
, 百拇医药
结果
海马神经细胞容积在1周内的变化如图1~3所示。每组样本例数为4~6培养皿。对照组细胞仅置于等渗培养液中。海马神经细胞置于0.05%、0.1%和0.25%NaCl混合液后15分钟,其细胞容积分别下降22.7%、25.7%和44.1%,但与同一实验时间的对照值相比无显著性差异(P>0.05)。60分钟后,所有细胞明显肿胀,分别比各自同一时间的对照组细胞容积增加27.9%、124.9%和141.3%(P<0.05)。1天后至第7天,各组细胞容积重新下降,基本恢复至对照组细胞容积水平(P>0.05)。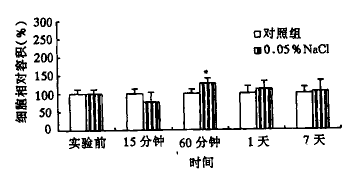
与对照组比较,*P<0.05 n=4~6
图1 海马神经细胞暴露于0.05%NaCl溶液15分钟
, http://www.100md.com 细胞容积的变化
与对照组比较,*P<0.05 n=4~6
图2 海马神经细胞暴露于0.1%NaCl溶液15分钟
细胞容积的变化
与对照组比较,*P<0.05 n=4~6
图3 海马神经细胞暴露于0.25%NaCl溶液15分钟
细胞容积的变化
讨论
, http://www.100md.com
一般来讲,细胞都具有在非等渗环境中调节自身容积的能力。当细胞置于高渗溶液中时,细胞膜内外形成一个内低外高的渗透浓度梯度。胞内水分流出到胞外,细胞容积缩小。随后通过不同的机制,细胞内渗透质浓度增加,胞外水分重新内流,细胞容积增大,基本恢复原来的容积,即“调节性容积增加”(regulatory volume increas e,RVI)。相反,当细胞置于低渗溶液中时,其容积先增加,随后又减少,即“调节性容积减少”(regulatory volume decrease,RVD)[6]。RVI和RVD是通过胞内电解质的累积或丢失所完成。RVI时细胞内电解质的累积借助于离子的容积激活运输系统进行。神经细胞的离子运输系统主要为Na+/K+/2Cl-共运,其他还有Na+/Cl-共运、Na+/H+、K+/H+交换及其有关的Cl-/HCO-3交换系统[7~9]。RVD时,神经细胞电解质(主要是KCl)的丢失主要通过细胞容积敏感性K+通道和Cl-通道[10]。
, 百拇医药
神经细胞是否也具有RVI和RVD功能,尚无最后定论[11~12]。在我们的实验中,暴露于各不同浓度高渗溶液中的海马神经细胞容积在15分钟后比对照组细胞容积减少22.7%~44.1%,与初始容积无统计学差异。由于实验的重点在于观察神经细胞1周内的改变,没有观察细胞容积在15分钟内的变化,我们因此不能断定此时细胞容积的减少是细胞的首先萎缩的结果,还是通过随后的RVI所部分恢复的容积。但至少能够说明,海马神经细胞在置于0.05%、0.10%及0.25%的NaCl和细胞培养液混合液15分钟后,其容积能够基本上恢复到初始细胞容积水平。
当细胞在高渗液15分钟后,其细胞内环境已趋向于细胞外的高渗环境,重新置于等渗培养液时,等渗的培养液相对于细胞为低渗。此时细胞外水分由于随渗透梯度而流向胞内。其细胞容积应该首先增加,随后通过RVD机制减少至初始容积。我们的实验观察到,60分钟时细胞容积分别明显增加27.9%~141.3%。而1天后细胞容积重新减少,基本上恢复至增加前的水平。说明曾暴露于不同浓度高渗盐水混合液的海马神细胞,1~7天后与其初始细胞相比,容积无明显的变化。
, 百拇医药
综上所述,我们认为,如同其他细胞一样,海马神经细胞在暴露于高渗溶液后具有细胞容积调节功能。其临床意义在于,静脉注射7.5%NaCl溶液后直到血浆渗透量浓度恢复正常,海马神经细胞均能在不同渗透高压下保持其细胞容积调节功能。至少在1周内,细胞容积不会发生明显的改变。
参考文献
1,Gunnar WP,Kane J,Barett J.Cer ebral blo od flow following hypertonic saline resu scitation in an experimental model of he morrhagic shock and head injury.Braz J M ed Biol Res,1989,22∶287.
2,Hariri RJ,Firlick AD,Shepard SR,e t al. Traumatic brain injury,hemorrhagic shock ,and fluid resuscitation:effects on intr acranial pressure and brain compliance.J Neurosurg,1993,79∶421.
, 百拇医药
3,Krll W,Plz W,Schimetta W.“Small volu me resuscitation-Eroffnen sich damit ne ue Mglichkeiten in der Behandlung d es hypovolmischen Schocks?Wien Kli n Wochens chr,1994,106∶8.
4,Banker GA,Cowan WM.Fu rther observation on hippo-
campal neurons in dispersed cel l culture.Comp Neur,1989,187∶469.
5,Kletzien RF,Pariza MW,Becker JE,et al. A method using 3-O-Methyl-D-Glucose and phloretin for the determination of intra cellular water space of cells in monolay er culture.Anal Biochem,1975,68∶537.
, 百拇医药
6,Lang F,Vldl H,Hussinger D.General principles in cell volume regu lation.In:Bey enbach KW,eds.Cell volume regulation.Kar ger,Basel,1990.1.
7,Kimelberg HK,Goderie SK,Higman S, et al .Swelling-induced release of glutamate,a spartate,and taurine from astrocyte cult ures.J Neurosci,1990,10∶1583.
8,McManus ML,Srange K.Acute volume regul ation of brain cells in response to hype rtonic challenge.Anesthesiology,1993,78∶ 1132.
, http://www.100md.com
9,Lippmann BJ,Yang R,Barnett DW,et al.Ph armacology of volume regulation followin g hypotonicity-induced cell swelling in clonal N1E115 neuroblastoma cells.Brain Res,1995,686∶29.
10,Pasantes-Morales H,Chacon E,Murr ay J. Properties of osmolyte fluxes activated during regulatory volume decrease in cul tured cerebeller granule neurons.J Neuro sci Res,1994,37∶720.
11,Pasantes-Morales H,Maar TE,Moran J.Ce ll volume regulation in cultured cerebel lar granule neurons.J Neurosci Res,1993, 34∶219.
12,Babila T,Atlan H,Fromer I,et al.Volum e regulation of nerve terminal s.J Neurochem,1990,5∶2058.
(收稿:1999-01-15 修回:1999-06-25), 百拇医药
单位:同济医科大学附属协和医院麻醉学教研室,武汉市(430022)
关键词:海马神经细胞;细胞容积;高渗溶液
临床麻醉学杂志000310
摘要 目的:观察海马神经细胞的容积在不同浓度 高渗NaCl溶液中7天内的变化。方法 :原代培养妊娠大白鼠胚胎的海马神经细胞,用细胞内水分含量的测定方法测量其暴露于高 渗NaCl溶液15分钟后的细胞容积。结果:细胞暴露于不同浓度的NaCl溶液15分 钟,细胞容积与同一实验时间的对照值相比无显著性差异(P>0.05)。60分钟 后, 所有细胞明显肿胀。1天后至第7天,各组细胞容积基本恢复至对照组细胞容积水平(P> 0.05)。结论:海马神经细胞在暴露于高渗溶液后具有细胞容积调节功能。尽管当细 胞重 新置入等渗培养液后肿胀,但1天后直到第7天,细胞容积能够重新恢复至原来的水平。
, http://www.100md.com
Effect of Hypertonic NaCl Saline on Cell Volume of Cultured Hippocampal Neu rons in Vitro
Yuan Shiying,Zeng Bangxiong
(Department of Anesthesiology,Xiehe Hospi tal,Tongji Medical University,Wuhan 430022)
Abstract Objective: Changes of cell volum e in cultured hippocampal neurons in vit ro were observed after being exposed to the different concentrations of hyperton ic NaCl saline.Methods:Hippocampal neuro ns of the rat embryo were cultured primari lly and exposed to cell culture medium w i th 0.05%,0.10% and 0.25% NaCl solution f or 15min.Results:There were no significa nt differences(P>0.05) between cell vo lu me in experimental group and control gro up after exposed to hypertonic NaCl sali ne for 15min.After 60min,all neurons swe lled significantly.1 and 7 days later,al l neurons shrinked again and restored t heir volume to the value in control grou p (P>0.05).Conclusion:Hippocampal neur on s are able to restore their cell volume after exposed to hypertonic saline.
, 百拇医药
Key words Hippocampal neuron Cell volume Hypertoni c saline
对于颅脑损伤伴失血性休克病人的紧急治疗,高渗溶液(如7.5%NaCl)因能够快速恢复循环血容量、改善器官灌注和微循环、降低颅内压以及减轻脑水肿而重新得到重视和更进一步的研究[1~3]。
有关脑细胞在高渗环境中的反应,以及能否保持其容积的稳定,尚未见报道。由于海马组织对缺血、缺氧以及机械性损伤极为敏感,本实验原代培养大白鼠胚胎海马神经细胞,观察其容积在不同浓度高渗NaCl溶液中的变化。
材料与方法
细胞培养 将妊娠18~20天的大白鼠用乙醚处死。在细胞培养工作台下剖腹取出胚胎,将它断头,取出脑组织,分离出海马。海马神经细胞的培养按照Banker等[4]的方法进行。
, http://www.100md.com
不同浓度高渗溶液环境的模拟 用不同量的7.5%NaCl溶液与新鲜细胞培养基混合,使混合液中的NaCl浓度分别为0.05%、0.1%和0.25%。由于细胞培养基为等渗溶液,上述0.25%、0.1%以及0.05%NaCl的混合液的渗透量浓度分别为375、333和310mosm/L,分别与临床及实验研究中静脉注入7.5%NaCl末期、5分钟及15分钟时的血浆渗透量浓度相一致[3]。培养10~12天的海马神经细胞用于实验。吸弃细胞培养液,换入等量的上述各混合液,置入培养箱中。15分钟后吸弃混合液,用Hank′s缓冲液洗涤细胞两次。再换入新鲜细胞培养基,重新置回培养箱。分别在细胞暴露于混合液前及暴露于混合液后15分钟和(已换入新鲜培养基)60分钟、1天和7天测试细胞的容积。
细胞容积的测量 采用细胞内水分含量的测定方法[5],细胞容积用μ1/100μg蛋白质表示。
统计分析 所得结果以与对照组细胞容积(作为100)相比所得的平均相对细胞容积±标准差表示。实验组和对照组细胞容积的比较采用非参数统计方法的两组数据秩和检验法(Mann-Whithey法)。P<0.05表示有显著差异。
, 百拇医药
结果
海马神经细胞容积在1周内的变化如图1~3所示。每组样本例数为4~6培养皿。对照组细胞仅置于等渗培养液中。海马神经细胞置于0.05%、0.1%和0.25%NaCl混合液后15分钟,其细胞容积分别下降22.7%、25.7%和44.1%,但与同一实验时间的对照值相比无显著性差异(P>0.05)。60分钟后,所有细胞明显肿胀,分别比各自同一时间的对照组细胞容积增加27.9%、124.9%和141.3%(P<0.05)。1天后至第7天,各组细胞容积重新下降,基本恢复至对照组细胞容积水平(P>0.05)。

与对照组比较,*P<0.05 n=4~6
图1 海马神经细胞暴露于0.05%NaCl溶液15分钟
, http://www.100md.com 细胞容积的变化

与对照组比较,*P<0.05 n=4~6
图2 海马神经细胞暴露于0.1%NaCl溶液15分钟
细胞容积的变化

与对照组比较,*P<0.05 n=4~6
图3 海马神经细胞暴露于0.25%NaCl溶液15分钟
细胞容积的变化
讨论
, http://www.100md.com
一般来讲,细胞都具有在非等渗环境中调节自身容积的能力。当细胞置于高渗溶液中时,细胞膜内外形成一个内低外高的渗透浓度梯度。胞内水分流出到胞外,细胞容积缩小。随后通过不同的机制,细胞内渗透质浓度增加,胞外水分重新内流,细胞容积增大,基本恢复原来的容积,即“调节性容积增加”(regulatory volume increas e,RVI)。相反,当细胞置于低渗溶液中时,其容积先增加,随后又减少,即“调节性容积减少”(regulatory volume decrease,RVD)[6]。RVI和RVD是通过胞内电解质的累积或丢失所完成。RVI时细胞内电解质的累积借助于离子的容积激活运输系统进行。神经细胞的离子运输系统主要为Na+/K+/2Cl-共运,其他还有Na+/Cl-共运、Na+/H+、K+/H+交换及其有关的Cl-/HCO-3交换系统[7~9]。RVD时,神经细胞电解质(主要是KCl)的丢失主要通过细胞容积敏感性K+通道和Cl-通道[10]。
, 百拇医药
神经细胞是否也具有RVI和RVD功能,尚无最后定论[11~12]。在我们的实验中,暴露于各不同浓度高渗溶液中的海马神经细胞容积在15分钟后比对照组细胞容积减少22.7%~44.1%,与初始容积无统计学差异。由于实验的重点在于观察神经细胞1周内的改变,没有观察细胞容积在15分钟内的变化,我们因此不能断定此时细胞容积的减少是细胞的首先萎缩的结果,还是通过随后的RVI所部分恢复的容积。但至少能够说明,海马神经细胞在置于0.05%、0.10%及0.25%的NaCl和细胞培养液混合液15分钟后,其容积能够基本上恢复到初始细胞容积水平。
当细胞在高渗液15分钟后,其细胞内环境已趋向于细胞外的高渗环境,重新置于等渗培养液时,等渗的培养液相对于细胞为低渗。此时细胞外水分由于随渗透梯度而流向胞内。其细胞容积应该首先增加,随后通过RVD机制减少至初始容积。我们的实验观察到,60分钟时细胞容积分别明显增加27.9%~141.3%。而1天后细胞容积重新减少,基本上恢复至增加前的水平。说明曾暴露于不同浓度高渗盐水混合液的海马神细胞,1~7天后与其初始细胞相比,容积无明显的变化。
, 百拇医药
综上所述,我们认为,如同其他细胞一样,海马神经细胞在暴露于高渗溶液后具有细胞容积调节功能。其临床意义在于,静脉注射7.5%NaCl溶液后直到血浆渗透量浓度恢复正常,海马神经细胞均能在不同渗透高压下保持其细胞容积调节功能。至少在1周内,细胞容积不会发生明显的改变。
参考文献
1,Gunnar WP,Kane J,Barett J.Cer ebral blo od flow following hypertonic saline resu scitation in an experimental model of he morrhagic shock and head injury.Braz J M ed Biol Res,1989,22∶287.
2,Hariri RJ,Firlick AD,Shepard SR,e t al. Traumatic brain injury,hemorrhagic shock ,and fluid resuscitation:effects on intr acranial pressure and brain compliance.J Neurosurg,1993,79∶421.
, 百拇医药
3,Krll W,Plz W,Schimetta W.“Small volu me resuscitation-Eroffnen sich damit ne ue Mglichkeiten in der Behandlung d es hypovolmischen Schocks?Wien Kli n Wochens chr,1994,106∶8.
4,Banker GA,Cowan WM.Fu rther observation on hippo-
campal neurons in dispersed cel l culture.Comp Neur,1989,187∶469.
5,Kletzien RF,Pariza MW,Becker JE,et al. A method using 3-O-Methyl-D-Glucose and phloretin for the determination of intra cellular water space of cells in monolay er culture.Anal Biochem,1975,68∶537.
, 百拇医药
6,Lang F,Vldl H,Hussinger D.General principles in cell volume regu lation.In:Bey enbach KW,eds.Cell volume regulation.Kar ger,Basel,1990.1.
7,Kimelberg HK,Goderie SK,Higman S, et al .Swelling-induced release of glutamate,a spartate,and taurine from astrocyte cult ures.J Neurosci,1990,10∶1583.
8,McManus ML,Srange K.Acute volume regul ation of brain cells in response to hype rtonic challenge.Anesthesiology,1993,78∶ 1132.
, http://www.100md.com
9,Lippmann BJ,Yang R,Barnett DW,et al.Ph armacology of volume regulation followin g hypotonicity-induced cell swelling in clonal N1E115 neuroblastoma cells.Brain Res,1995,686∶29.
10,Pasantes-Morales H,Chacon E,Murr ay J. Properties of osmolyte fluxes activated during regulatory volume decrease in cul tured cerebeller granule neurons.J Neuro sci Res,1994,37∶720.
11,Pasantes-Morales H,Maar TE,Moran J.Ce ll volume regulation in cultured cerebel lar granule neurons.J Neurosci Res,1993, 34∶219.
12,Babila T,Atlan H,Fromer I,et al.Volum e regulation of nerve terminal s.J Neurochem,1990,5∶2058.
(收稿:1999-01-15 修回:1999-06-25), 百拇医药