重组人肿瘤坏死因子致肺癌细胞(LC-6)凋亡的研究
作者:赵云平 陈惠孙 蒋耀光 王如文
单位:赵云平(第三军医大学附属大坪医院野战外科研究所胸心外科,重庆 400042);陈惠孙(第三军医大学附属大坪医院野战外科研究所胸心外科,重庆 400042);蒋耀光(第三军医大学附属大坪医院野战外科研究所胸心外科,重庆 400042);王如文(第三军医大学附属大坪医院野战外科研究所胸心外科,重庆 400042)
关键词:肺癌细胞(LC-6);细胞凋亡;重组人肿瘤坏死因子
第三军医大学学报000113
提要 目的:探讨重组人肿瘤坏死因子(rhTNF)引起肺癌细胞(LC-6)死亡的机制。方法:应用原位细胞毒性分析、DNA降解片段琼脂糖凝胶电泳、形态学和流式细胞学测定的动态分析。结果:rhTNF作用于肺癌细胞(LC-6)数小时后,引起细胞核DNA解成寡聚核苷酸片断,说明肺癌细胞(LC-6)以细胞凋亡的方式死亡,并且细胞凋亡的程度与重组人肿瘤坏死因子作用的时间及浓度呈正相关。单纯应用放线菌素D后则肺癌细胞(LC-6)表现为细胞坏死,rhTNF与放线菌素D伍用后可以明显增强这种作用。结论:rhTNF是通过激发LC-6细胞发生细胞凋亡而发挥其细胞毒性作用。
, http://www.100md.com
中图法分类号 R394.2;R394.3;R734.2 文献标识码 A
文章编号:1000-5404(2000)01-0042-04
Apoptosis of lung cancer cells induced by recombinant human tumor necrosis factor
Zhao Yun-ping,Chen Hui-sun,Jiang Yao-guang,Wang Ru-wen
(Department of Thoracic Surgery,Daping Hospital,Third Military Medical University,Chongqing 400042)
Abstract Objective:To explore the mechanism of apoptosis of lung cancer cells (LC-6) induced by recombinant human tumor necrosis factor (rhTNF).Methods:The in situ cytotoxicity assay,qualitative analysis of DNA fragmentation and flow cytometry were used in this study.Results:Treatment with rhTNF led to fragmentation of DNA into nucleosemal oligomers.This event preceded cell death in several hours and had close correlation with concentration of rhTNF and time of treatment.Treatment with DNA topoisomerase II inhibitor accelerated the rhTNF-mediated DNA fragmentation.Conclusion:rhTNF exerts its cytotoxic effects on the lung cancer cells through activating their apoptosis.
, 百拇医药
Key words lung cancer cell; apoptosis; recombinant human tumor necrosis factor
肿瘤坏死因子(Tumor necrosis factor,TNF)是一种在体内和体外均对肿瘤细胞具有杀伤作用的细胞因子[1],实验证明肿瘤坏死因子对肺癌细胞具有杀伤作用,并已应用于实验和临床治疗肺癌患者[2]。但TNF对肿瘤细胞发挥毒性作用的机制仍不清楚。最近的研究表明:TNF可能通过与敏感靶细胞结合,激活细胞Ca2+~Mg2+依赖的限制性核酸内切酶,导致基因组DNA分子降解为寡聚核苷酸片段,引发细胞凋亡而发挥其毒性作用[3,4]。本研究应用重组人肿瘤坏死因子(Recombinant human tumor necrosis factor,rhTNF)作用于肺癌细胞株(LC-6),观测其原位细胞毒性时相变化,定性分析靶细胞基因组DNA分子的降解模式和流式细胞学测定细胞凋亡的变化,探讨rhTNF对LC-6细胞发挥毒性作用的机制,为肿瘤坏死因子治疗肺癌提供理论依据。
, http://www.100md.com
1 材料和方法
1.1 实验试剂
rhTNF(SIGMA美国);肺癌细胞(LC-6)株LIFE-TECH;ΦX-174-RFDNA/Hae-Ⅲ(Promega美国);放线菌素D(华美公司);新型蛋白酶K(LIFETECH美国)。
1.2 实验方法
1.2.1 细胞培养及分组 LC-6细胞用含10%灭活小牛血清的RPMI 1640培养液,于37°C,5%CO2条件下长期维持培养,实验前需传3代以上,实验分为:培养液对照组;低剂量rhTNF组(100ng/ml);高剂量rhTNF组(200ng/ml);单纯放线菌素D组(10μmol/L);低剂量rhTNF组(100ng/ml)+放线菌素D组。孵育时间分别为6、12、25、36h。
, 百拇医药 1.2.2 原位细胞毒性分析 消化传代的LC-6细胞按1∶2~1∶3的比例(V/V)加入RPMI 1640培养液培养过夜,待细胞铺满细胞培养瓶达80%左右时,更换培养液,培养48~72h后,细胞呈对数生长旺盛期,吸去培养上清液,加入0.25%胰蛋白酶消化细胞约1min后弃去,用培养液将细胞吹打下后制成单细胞悬液,400×g,离心5min,再用培养液将LC-6细胞悬液浓度调至4×105/ml。在96孔微量培养板上,每孔入LC-6细胞悬液100μl,置培养箱过夜,细胞贴壁伸展生长,吸去上清,分别加入培养液、rhTNF(100ng/ml)培养液、放线菌素D(10μmol/L)、rhTNF(100ng/ml)和放线菌素D(10μmol/L)各100μl,与此相同共准备4块培养板,分别培养6、12、24、36h后,吸出上清,各孔入生理盐水200μl洗涤,再加入0.05%结晶紫染色固定液(20%乙醇),染色10min,冲洗培养板,残留并染上色的细胞为LC-6活细胞,在450型酶联免疫标记自动分析仪上选择595nm波长处测定各孔光密度值(Dλ),根据公式:(1-样品孔D595值)/对照孔D595值×100%,计算出原位杀伤细胞的百分率。
, http://www.100md.com
1.2.3 DNA降解片段琼脂糖凝胶电泳[5] 取处理后各时相LC-6细胞约(1.5~2.0)×106个,4℃,250×g,离心5min,弃上液,加入30μl细胞溶解液和15μlRNaseA,轻轻混匀37℃温育6h加入10μl新型蛋白酶K(20mg/ml),50℃温育18h。取1.5g琼脂糖加入到100ml1×TBE电泳缓冲液(pH8.0)中,放至微波炉中强热加温约2min使其溶解,待凝胶冷至50℃时,加入5μl溴化乙锭(EB 10mg/ml)溶液混匀,于水平电泳槽中制胶,以φX-174-RFDNA/Hae-Ⅲ为DNA分子量标记,加入不同样品,55V电压下电泳2~3h,紫外照相系统下观察并照相。
1.2.4 细胞凋亡的流式细胞学检测[6] 取处理后各时相LC-6细胞约1×106个,悬浮于200μlPBS中,以70%冷乙醇快速固定至少2h,250×g离心10min,弃上清液,以1mlPBS重新溶解沉淀细胞,加入PI及RNaseA于37°C孵育30min,细胞经微孔滤膜过滤后,利用流式细胞仪在激发光波长为488nm条件下进行分析。
, http://www.100md.com
1.2.5 形态学观察处理后的LC-6细胞以3%戊二醛液固定,环氧树脂包埋,在电子显微镜下观察并照相。
1.3 统计学分析
所有计量资料以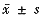 表示,差异的显著性以t检验、方差分析及χ2检验分析。
表示,差异的显著性以t检验、方差分析及χ2检验分析。
2 结果
2.1 原位细胞毒性分析
见表1。单纯rhTNF(100ng/ml,200ng/ml)处理24h后,分别有32.0%、58.4%的细胞死亡,36h后则有52.6%,80.4%的细胞死亡。单纯放线菌素D处理24h后,约有58.7%的细胞死亡,36h后则有96.6%的细胞死亡,低剂量rhTNF(100ng/ml)与放线菌素D伍用6h后,即有22.4%的细胞死亡,12h后则有38.8%的细胞死亡,24h后即有64.4%的细胞死亡。
, http://www.100md.com
表1 不同处理组LC-6细胞细胞毒性和流式细胞学测定(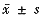 )
)
Tab1 Cytotoxicity and flow cytometry in LC-6 cells treated differently(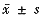 ) Treatment
) Treatment
Times(t/h)
Cyotoxicity(%)
Flow cytometry
rhTNF(100 ng/ml)
6
, http://www.100md.com
5.5±0.2
3.64±0.8
12
15.4±0.6
10.31±1.3
24
32.0±1.4
27.42±2.0
36
52.6±2.4
33.71±3.1
rhTNF(200 ng/ml)
, 百拇医药
6
14.0±0.3
10.78±1.0
12
34.6±0.8
22.07±1.4
24
58.4±1.6
32.64±2.9
36
80.4±2.5
44.36±3.8
, 百拇医药
Dactinmycin(10 μmol/L)
6
4.6±0.2
1.59±0.4
12
18.6±0.8
15.24±0.9
24
58.7±2.0
13.69±1.1
36
96.6±2.8
, 百拇医药
22.87±1.8
rhTNF(10μmol/L)+Dactinmycin(10μmol/L)
6
22.4±0.7
15.73±1.7
12
38.8±0.8
26.55±1.9
24
64.4±2.8
38.71±2.4
36
, http://www.100md.com
86.4±3.0
48.32±3.1
2.2 不同处理组LC-6细胞基因组总DNA分子断裂片段的特征,见图1、2

图1 DNA电泳分析
S:DNA分子量标准对照;A:正常肺癌细胞基因组总DNA分子;B:肺癌细胞经rhTNF(100ng/ml)处理12h;C:肺癌细胞经rhTNF(100ng/ml)处理24h;D:肺癌细胞经rhTNF(l00ng/ml)处理36h
Fig1 Electrophoretic analysis of DNA on 1.5% agarose
, 百拇医药
gel.DNA was extracted from untreated LC-6
cells(lane A)and from intubation with rhTNF
(100 ng/ml)alone for 12h(lane B),24 h(lane
C)and 36 hours(lane D)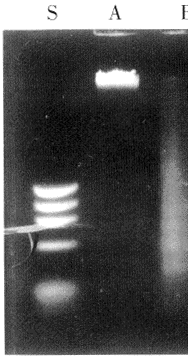
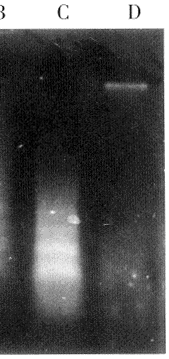
图2 DNA电泳分析
S:DNA分子量标准对照;A:正常肺癌细胞基因组总DNA分子;B:肺癌细胞经rhTNF(100ng/ml)+放线菌素D处理12h;C:肺癌细胞经rhTNF(100ng/ml)+放线菌素D处理24h;D:肺瘤细胞经rhTNF(100ng/ml)+放线菌素D处理36h
, 百拇医药
Fig2 Electrophoretic analysis of DNA on 1.5% agarose
gel.DNA was extracted from untreated LC-6 cells
(lane A)and from intubation with rhTNF(100
ng/ml)+dactinmycin D(10 μmol/L)for 12 h(lane
B),24h(lane C)and 36 hours(lane D)
2.3 流式细胞学检测表明
见表1。高剂量rhTNF组,各时相亚二倍体细胞变化比例分别为10.78%、22.07%、32.64%、44.36%,其变化程度与细胞内DNA分子降解程度相近;低剂量rhTNF组也与此一致。而单纯放线菌素D组,各时相亚二倍体细胞变化程度明显低于细胞内DNA分子降解。
, 百拇医药
2.4 电镜观察
高剂量rhTNF组LC-6细胞表现为细胞体积缩小,胞膜皱缩,细胞核深染,核内染色质呈块状聚集于核膜下以及凋亡小体形成,见图3。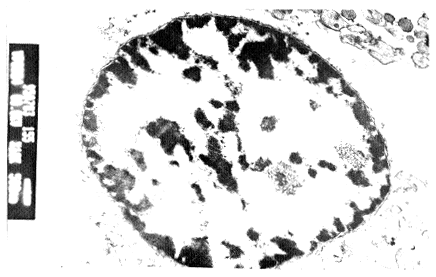
图3 LC-6细胞形态学观察:细胞体积缩小,核膜皱
缩,细胞核深染,核内染色质呈块状聚集于核膜
下(TEM×10000)
Fig3 LC-6 cell death under Transmission electron micro-
graphs death:Condensation of chromatin and con-
, 百拇医药
tract of the nuclear membrane(TEM×10000)
3 讨论
细胞凋亡(Apoptosis)是一种在各种刺激因素作用下细胞的自主死亡方式,其形态学表现为细胞体积缩小、细胞核固缩、染色质边聚、胞膜呈泡状突起[7]。生化特征表现为基因组DNA分子降解呈相差180~200bp的核苷酸片段,在琼脂糖凝胶电泳上呈梯状改变[8]。流式细胞学测定出现亚G1期细胞。肿瘤坏死因子(TNF)是一各具有多种生物学活性的细胞因子,对多种肿瘤细胞均具有杀伤作用[1]。近年文献对其作用机制进行了有益探索,本研究以肺癌细胞(LC-6)为靶细胞,通过原位细胞毒性分析,DNA降解模式及流式细胞学动态分析,说明rhTNF通过激发细胞凋亡的方式对肺癌细胞发挥毒性作用,此结论与最近的结果相似[3]。与此相反,LC-6细胞持续暴露于10μmol/L放线菌素D液中时,细胞内DNA碎片及流式细胞学改变并不随细胞毒性而改变,细胞以坏死为主,说明放线菌素D是通过细胞坏死方式发挥细胞毒性的。有研究说明:将LC-6细胞与放线菌素D作用lh后,洗去培养液,加入新鲜培养液继续培养,细胞仍于2d后死亡,但这与持续暴露引发的细胞死亡方式有些不同:短暂暴露于放线菌素D后第1天可见到细胞内DNA分子降解,这种降解片断的特征与细胞凋亡相似,因此短暂暴露于放线菌素D可以引发细胞凋亡,而持续暴露于放线菌素D也许不仅可以引发细胞凋亡,更可引发细胞坏死的过程。已有文献[9]报道:在特定条件下,细胞坏死的发生远比细胞凋亡发生快,如果这适合于LC-6细胞,就可以解释肺癌细胞持续暴露于放线菌素D液中能引起细胞毒性,却不能检测到DNA分子降解片段的特征性改变。放线菌素D作为Topo-Ⅱ的有效抑制剂,与rhTNF伍用后明显加快肺癌细胞凋亡过程,其可能是抑制Topo-Ⅱ的活性,增强细胞内限制性核酸内切酶活性,通过改变染色体的形状,增加DNA分子对限制性核酸内切酶的敏感性,导致DNA分子降解,具体机制还有待进一步研究。
, 百拇医药
作者简介:赵云平,男(1968.5),云南省宜良市人,硕士,主治医师,主要从事胸心外科学方面的研究,发表论文7篇。电话:(023)68757241
参考文献
[1]Zinetti M,Galli G,Demitri M T,et al.Chlorpromazine inhibits tumour necrosis factor synthesis and cytotoxicity in vitro[J].Immunology,1995,86(3):416-421.
[2]Powell C B,Herzog T J,Scott J H,et al.Evidence for a protein synthesis-dependent and-independent TNF alpha cytolytic mecha-nism[J].Gynecol Oncol,1995,58(3):327-335.
, 百拇医药
[3]Enari M,Hug H,Hayakawa M,et al.Different apoptotic pathways mediated by Fas and the tumor-necrosis-factor receptor.Cytosolic phospholipase A2 is not involved in Fas-mediated apoptosis[J].Eur J Biochem,1996,236(2):533-538.
[4]Deocster E,Vanhaesebroeck B,Vandenabeele P,et al.Gener-ation and biological characterization of membrane-bound,uncleavable murine tumor necrosis factor[J].J Biol Chem,1995,270(31):18473-18478.
[5]Cui S,Reichner J S,Mateo R B,et al.Activated murine macrophages induce apoptosis in tumor cells through nitric oxide-dependent or -independent mechanisms[J].Cancer Res,1994,54(9):2462-2467.
, http://www.100md.com
[6]Darzynkiewicz Z,Bruno S,Del Bino G,et al.Features of apoptostic cell measured by flow cytometry[J].Cytometry,1992,13(6):795-808.
[7]Kerr J F R,Wyllie A H .Apoptosis:a basic biological phe-nomenon with wide-ranging implication in tissue kine-tics[J].Br J Cancer,1972,26(1):239-257.
[8]Borner C,Martinou I,Mattmann C,et al.The protein bcl-2 alpha does not require membrane attachment,but two conserved domains to suppress apoptosis[J].J Cell Biol,1994,126(4):1059-1068.
[9]Chang N S.Hyaluronidase induces murine L929 fibrosarcoma cells resistant to tumor necrosis factor and Fas cytotoxicity in the presence of actinomycin D[J].Cell Biochem Biophys,1995-96,27(2):109-132.
收稿日期:1999-01-23
修回日期:1999-08-28, http://www.100md.com
单位:赵云平(第三军医大学附属大坪医院野战外科研究所胸心外科,重庆 400042);陈惠孙(第三军医大学附属大坪医院野战外科研究所胸心外科,重庆 400042);蒋耀光(第三军医大学附属大坪医院野战外科研究所胸心外科,重庆 400042);王如文(第三军医大学附属大坪医院野战外科研究所胸心外科,重庆 400042)
关键词:肺癌细胞(LC-6);细胞凋亡;重组人肿瘤坏死因子
第三军医大学学报000113
提要 目的:探讨重组人肿瘤坏死因子(rhTNF)引起肺癌细胞(LC-6)死亡的机制。方法:应用原位细胞毒性分析、DNA降解片段琼脂糖凝胶电泳、形态学和流式细胞学测定的动态分析。结果:rhTNF作用于肺癌细胞(LC-6)数小时后,引起细胞核DNA解成寡聚核苷酸片断,说明肺癌细胞(LC-6)以细胞凋亡的方式死亡,并且细胞凋亡的程度与重组人肿瘤坏死因子作用的时间及浓度呈正相关。单纯应用放线菌素D后则肺癌细胞(LC-6)表现为细胞坏死,rhTNF与放线菌素D伍用后可以明显增强这种作用。结论:rhTNF是通过激发LC-6细胞发生细胞凋亡而发挥其细胞毒性作用。
, http://www.100md.com
中图法分类号 R394.2;R394.3;R734.2 文献标识码 A
文章编号:1000-5404(2000)01-0042-04
Apoptosis of lung cancer cells induced by recombinant human tumor necrosis factor
Zhao Yun-ping,Chen Hui-sun,Jiang Yao-guang,Wang Ru-wen
(Department of Thoracic Surgery,Daping Hospital,Third Military Medical University,Chongqing 400042)
Abstract Objective:To explore the mechanism of apoptosis of lung cancer cells (LC-6) induced by recombinant human tumor necrosis factor (rhTNF).Methods:The in situ cytotoxicity assay,qualitative analysis of DNA fragmentation and flow cytometry were used in this study.Results:Treatment with rhTNF led to fragmentation of DNA into nucleosemal oligomers.This event preceded cell death in several hours and had close correlation with concentration of rhTNF and time of treatment.Treatment with DNA topoisomerase II inhibitor accelerated the rhTNF-mediated DNA fragmentation.Conclusion:rhTNF exerts its cytotoxic effects on the lung cancer cells through activating their apoptosis.
, 百拇医药
Key words lung cancer cell; apoptosis; recombinant human tumor necrosis factor
肿瘤坏死因子(Tumor necrosis factor,TNF)是一种在体内和体外均对肿瘤细胞具有杀伤作用的细胞因子[1],实验证明肿瘤坏死因子对肺癌细胞具有杀伤作用,并已应用于实验和临床治疗肺癌患者[2]。但TNF对肿瘤细胞发挥毒性作用的机制仍不清楚。最近的研究表明:TNF可能通过与敏感靶细胞结合,激活细胞Ca2+~Mg2+依赖的限制性核酸内切酶,导致基因组DNA分子降解为寡聚核苷酸片段,引发细胞凋亡而发挥其毒性作用[3,4]。本研究应用重组人肿瘤坏死因子(Recombinant human tumor necrosis factor,rhTNF)作用于肺癌细胞株(LC-6),观测其原位细胞毒性时相变化,定性分析靶细胞基因组DNA分子的降解模式和流式细胞学测定细胞凋亡的变化,探讨rhTNF对LC-6细胞发挥毒性作用的机制,为肿瘤坏死因子治疗肺癌提供理论依据。
, http://www.100md.com
1 材料和方法
1.1 实验试剂
rhTNF(SIGMA美国);肺癌细胞(LC-6)株LIFE-TECH;ΦX-174-RFDNA/Hae-Ⅲ(Promega美国);放线菌素D(华美公司);新型蛋白酶K(LIFETECH美国)。
1.2 实验方法
1.2.1 细胞培养及分组 LC-6细胞用含10%灭活小牛血清的RPMI 1640培养液,于37°C,5%CO2条件下长期维持培养,实验前需传3代以上,实验分为:培养液对照组;低剂量rhTNF组(100ng/ml);高剂量rhTNF组(200ng/ml);单纯放线菌素D组(10μmol/L);低剂量rhTNF组(100ng/ml)+放线菌素D组。孵育时间分别为6、12、25、36h。
, 百拇医药 1.2.2 原位细胞毒性分析 消化传代的LC-6细胞按1∶2~1∶3的比例(V/V)加入RPMI 1640培养液培养过夜,待细胞铺满细胞培养瓶达80%左右时,更换培养液,培养48~72h后,细胞呈对数生长旺盛期,吸去培养上清液,加入0.25%胰蛋白酶消化细胞约1min后弃去,用培养液将细胞吹打下后制成单细胞悬液,400×g,离心5min,再用培养液将LC-6细胞悬液浓度调至4×105/ml。在96孔微量培养板上,每孔入LC-6细胞悬液100μl,置培养箱过夜,细胞贴壁伸展生长,吸去上清,分别加入培养液、rhTNF(100ng/ml)培养液、放线菌素D(10μmol/L)、rhTNF(100ng/ml)和放线菌素D(10μmol/L)各100μl,与此相同共准备4块培养板,分别培养6、12、24、36h后,吸出上清,各孔入生理盐水200μl洗涤,再加入0.05%结晶紫染色固定液(20%乙醇),染色10min,冲洗培养板,残留并染上色的细胞为LC-6活细胞,在450型酶联免疫标记自动分析仪上选择595nm波长处测定各孔光密度值(Dλ),根据公式:(1-样品孔D595值)/对照孔D595值×100%,计算出原位杀伤细胞的百分率。
, http://www.100md.com
1.2.3 DNA降解片段琼脂糖凝胶电泳[5] 取处理后各时相LC-6细胞约(1.5~2.0)×106个,4℃,250×g,离心5min,弃上液,加入30μl细胞溶解液和15μlRNaseA,轻轻混匀37℃温育6h加入10μl新型蛋白酶K(20mg/ml),50℃温育18h。取1.5g琼脂糖加入到100ml1×TBE电泳缓冲液(pH8.0)中,放至微波炉中强热加温约2min使其溶解,待凝胶冷至50℃时,加入5μl溴化乙锭(EB 10mg/ml)溶液混匀,于水平电泳槽中制胶,以φX-174-RFDNA/Hae-Ⅲ为DNA分子量标记,加入不同样品,55V电压下电泳2~3h,紫外照相系统下观察并照相。
1.2.4 细胞凋亡的流式细胞学检测[6] 取处理后各时相LC-6细胞约1×106个,悬浮于200μlPBS中,以70%冷乙醇快速固定至少2h,250×g离心10min,弃上清液,以1mlPBS重新溶解沉淀细胞,加入PI及RNaseA于37°C孵育30min,细胞经微孔滤膜过滤后,利用流式细胞仪在激发光波长为488nm条件下进行分析。
, http://www.100md.com
1.2.5 形态学观察处理后的LC-6细胞以3%戊二醛液固定,环氧树脂包埋,在电子显微镜下观察并照相。
1.3 统计学分析
所有计量资料以
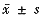 表示,差异的显著性以t检验、方差分析及χ2检验分析。
表示,差异的显著性以t检验、方差分析及χ2检验分析。2 结果
2.1 原位细胞毒性分析
见表1。单纯rhTNF(100ng/ml,200ng/ml)处理24h后,分别有32.0%、58.4%的细胞死亡,36h后则有52.6%,80.4%的细胞死亡。单纯放线菌素D处理24h后,约有58.7%的细胞死亡,36h后则有96.6%的细胞死亡,低剂量rhTNF(100ng/ml)与放线菌素D伍用6h后,即有22.4%的细胞死亡,12h后则有38.8%的细胞死亡,24h后即有64.4%的细胞死亡。
, http://www.100md.com
表1 不同处理组LC-6细胞细胞毒性和流式细胞学测定(
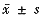 )
)Tab1 Cytotoxicity and flow cytometry in LC-6 cells treated differently(
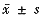 ) Treatment
) TreatmentTimes(t/h)
Cyotoxicity(%)
Flow cytometry
rhTNF(100 ng/ml)
6
, http://www.100md.com
5.5±0.2
3.64±0.8
12
15.4±0.6
10.31±1.3
24
32.0±1.4
27.42±2.0
36
52.6±2.4
33.71±3.1
rhTNF(200 ng/ml)
, 百拇医药
6
14.0±0.3
10.78±1.0
12
34.6±0.8
22.07±1.4
24
58.4±1.6
32.64±2.9
36
80.4±2.5
44.36±3.8
, 百拇医药
Dactinmycin(10 μmol/L)
6
4.6±0.2
1.59±0.4
12
18.6±0.8
15.24±0.9
24
58.7±2.0
13.69±1.1
36
96.6±2.8
, 百拇医药
22.87±1.8
rhTNF(10μmol/L)+Dactinmycin(10μmol/L)
6
22.4±0.7
15.73±1.7
12
38.8±0.8
26.55±1.9
24
64.4±2.8
38.71±2.4
36
, http://www.100md.com
86.4±3.0
48.32±3.1
2.2 不同处理组LC-6细胞基因组总DNA分子断裂片段的特征,见图1、2


图1 DNA电泳分析
S:DNA分子量标准对照;A:正常肺癌细胞基因组总DNA分子;B:肺癌细胞经rhTNF(100ng/ml)处理12h;C:肺癌细胞经rhTNF(100ng/ml)处理24h;D:肺癌细胞经rhTNF(l00ng/ml)处理36h
Fig1 Electrophoretic analysis of DNA on 1.5% agarose
, 百拇医药
gel.DNA was extracted from untreated LC-6
cells(lane A)and from intubation with rhTNF
(100 ng/ml)alone for 12h(lane B),24 h(lane
C)and 36 hours(lane D)


图2 DNA电泳分析
S:DNA分子量标准对照;A:正常肺癌细胞基因组总DNA分子;B:肺癌细胞经rhTNF(100ng/ml)+放线菌素D处理12h;C:肺癌细胞经rhTNF(100ng/ml)+放线菌素D处理24h;D:肺瘤细胞经rhTNF(100ng/ml)+放线菌素D处理36h
, 百拇医药
Fig2 Electrophoretic analysis of DNA on 1.5% agarose
gel.DNA was extracted from untreated LC-6 cells
(lane A)and from intubation with rhTNF(100
ng/ml)+dactinmycin D(10 μmol/L)for 12 h(lane
B),24h(lane C)and 36 hours(lane D)
2.3 流式细胞学检测表明
见表1。高剂量rhTNF组,各时相亚二倍体细胞变化比例分别为10.78%、22.07%、32.64%、44.36%,其变化程度与细胞内DNA分子降解程度相近;低剂量rhTNF组也与此一致。而单纯放线菌素D组,各时相亚二倍体细胞变化程度明显低于细胞内DNA分子降解。
, 百拇医药
2.4 电镜观察
高剂量rhTNF组LC-6细胞表现为细胞体积缩小,胞膜皱缩,细胞核深染,核内染色质呈块状聚集于核膜下以及凋亡小体形成,见图3。

图3 LC-6细胞形态学观察:细胞体积缩小,核膜皱
缩,细胞核深染,核内染色质呈块状聚集于核膜
下(TEM×10000)
Fig3 LC-6 cell death under Transmission electron micro-
graphs death:Condensation of chromatin and con-
, 百拇医药
tract of the nuclear membrane(TEM×10000)
3 讨论
细胞凋亡(Apoptosis)是一种在各种刺激因素作用下细胞的自主死亡方式,其形态学表现为细胞体积缩小、细胞核固缩、染色质边聚、胞膜呈泡状突起[7]。生化特征表现为基因组DNA分子降解呈相差180~200bp的核苷酸片段,在琼脂糖凝胶电泳上呈梯状改变[8]。流式细胞学测定出现亚G1期细胞。肿瘤坏死因子(TNF)是一各具有多种生物学活性的细胞因子,对多种肿瘤细胞均具有杀伤作用[1]。近年文献对其作用机制进行了有益探索,本研究以肺癌细胞(LC-6)为靶细胞,通过原位细胞毒性分析,DNA降解模式及流式细胞学动态分析,说明rhTNF通过激发细胞凋亡的方式对肺癌细胞发挥毒性作用,此结论与最近的结果相似[3]。与此相反,LC-6细胞持续暴露于10μmol/L放线菌素D液中时,细胞内DNA碎片及流式细胞学改变并不随细胞毒性而改变,细胞以坏死为主,说明放线菌素D是通过细胞坏死方式发挥细胞毒性的。有研究说明:将LC-6细胞与放线菌素D作用lh后,洗去培养液,加入新鲜培养液继续培养,细胞仍于2d后死亡,但这与持续暴露引发的细胞死亡方式有些不同:短暂暴露于放线菌素D后第1天可见到细胞内DNA分子降解,这种降解片断的特征与细胞凋亡相似,因此短暂暴露于放线菌素D可以引发细胞凋亡,而持续暴露于放线菌素D也许不仅可以引发细胞凋亡,更可引发细胞坏死的过程。已有文献[9]报道:在特定条件下,细胞坏死的发生远比细胞凋亡发生快,如果这适合于LC-6细胞,就可以解释肺癌细胞持续暴露于放线菌素D液中能引起细胞毒性,却不能检测到DNA分子降解片段的特征性改变。放线菌素D作为Topo-Ⅱ的有效抑制剂,与rhTNF伍用后明显加快肺癌细胞凋亡过程,其可能是抑制Topo-Ⅱ的活性,增强细胞内限制性核酸内切酶活性,通过改变染色体的形状,增加DNA分子对限制性核酸内切酶的敏感性,导致DNA分子降解,具体机制还有待进一步研究。
, 百拇医药
作者简介:赵云平,男(1968.5),云南省宜良市人,硕士,主治医师,主要从事胸心外科学方面的研究,发表论文7篇。电话:(023)68757241
参考文献
[1]Zinetti M,Galli G,Demitri M T,et al.Chlorpromazine inhibits tumour necrosis factor synthesis and cytotoxicity in vitro[J].Immunology,1995,86(3):416-421.
[2]Powell C B,Herzog T J,Scott J H,et al.Evidence for a protein synthesis-dependent and-independent TNF alpha cytolytic mecha-nism[J].Gynecol Oncol,1995,58(3):327-335.
, 百拇医药
[3]Enari M,Hug H,Hayakawa M,et al.Different apoptotic pathways mediated by Fas and the tumor-necrosis-factor receptor.Cytosolic phospholipase A2 is not involved in Fas-mediated apoptosis[J].Eur J Biochem,1996,236(2):533-538.
[4]Deocster E,Vanhaesebroeck B,Vandenabeele P,et al.Gener-ation and biological characterization of membrane-bound,uncleavable murine tumor necrosis factor[J].J Biol Chem,1995,270(31):18473-18478.
[5]Cui S,Reichner J S,Mateo R B,et al.Activated murine macrophages induce apoptosis in tumor cells through nitric oxide-dependent or -independent mechanisms[J].Cancer Res,1994,54(9):2462-2467.
, http://www.100md.com
[6]Darzynkiewicz Z,Bruno S,Del Bino G,et al.Features of apoptostic cell measured by flow cytometry[J].Cytometry,1992,13(6):795-808.
[7]Kerr J F R,Wyllie A H .Apoptosis:a basic biological phe-nomenon with wide-ranging implication in tissue kine-tics[J].Br J Cancer,1972,26(1):239-257.
[8]Borner C,Martinou I,Mattmann C,et al.The protein bcl-2 alpha does not require membrane attachment,but two conserved domains to suppress apoptosis[J].J Cell Biol,1994,126(4):1059-1068.
[9]Chang N S.Hyaluronidase induces murine L929 fibrosarcoma cells resistant to tumor necrosis factor and Fas cytotoxicity in the presence of actinomycin D[J].Cell Biochem Biophys,1995-96,27(2):109-132.
收稿日期:1999-01-23
修回日期:1999-08-28, http://www.100md.com