血小板第4因子(PF4)抗血管新生的机理初探
作者:韩忠朝 杨仁池
单位:韩忠朝(300020 天津市,中国医学科学院中国协和医科大学血液学研究所血液病医院,实验血液学国家重点实验室);杨仁池(300020 天津市,中国医学科学院中国协和医科大学血液学研究所血液病医院,实验血液学国家重点实验室)
关键词:血管新生;血小板第4因子;纤维母细胞生长因子
中国微循环000106
【摘要】 目的 研究血小板第4因子(PF4)抑制血管新生的机制。方法 通过研究PF4与纤维母细胞生长因子-2(FGF2)及其受体间的相互作用来探讨PF4抑制血管新生的机制。结果 FGF2与低亲和力和高亲和力位点的结合受PF4抑制,这种抑制呈浓度依赖性。5~10μg/ml的PF4能最大限度地抑制FGF2与低亲和力或高亲和力位点(FGF受体)结合。0.72μg/ml的PF4能使FGF2与低亲和力位点结合减少50%,0.6μg/ml的PF4能使FGF2与高亲和力位点结合减少50%。2μg/ml的PF4能完全抑制内皮细胞的增殖。在该浓度下,PF4使125I-FGF2的内化下降近3倍。结论:PF4抑制血管新生的机制之一是抑制FGF2与其受体结合。
, http://www.100md.com
Study on the Mechanism of Platelet Factor 4 Inhibiting Angiogenesis
Han Zhongchao,Yang Renchi.
(Institute of Hematology and Blood Diseases Hospital, State Key Laboratory of Experimental Hematology, CAMS and PUMS, Tianjin 300020)
【Abstract】 Objective To explore the mechanism of platelet factor 4 (PF-4) inhibiting angiogenesis. Methods To investigate the mechanism by examining the interaction of PF-4 and the fibroblast growth factor-2(FGF-2)/fibroblast growth factor receptor (FGFR) system. Results FGF-2 binding to low-affinity sites or high-affinity binding sites was inhibited in a concentration-dependent manner by PF-4. Maximum inhibition of FGF-2 binding to low-affinity sites or high-affinity binding sites (FGF receptors) reached at 5~10μg/ml PF4 with half maximum inhibition at 0.72 and 0.6μg/ml, respectively, and proliferation was completely inhibited at 2μg/ml. At this concentration, PF-4 reduced internalization of 125I-FGF-2 by threefold and degradation delayed. Conclusion One mechanism of PF-4 inhibiting angiogenesis is that the binding of FGF-2 to its receptor is inhibited by PF-4.
, 百拇医药
【Key words】 Angiogenesis Platelet factor 4 Fibroblast growth factor 2
恶性肿瘤的侵袭与转移有赖于血管新生。血管新生受一系列刺激和抑制因子调节,这些因子控制着内皮细胞的增殖和迁移。其中主要的血管新生刺激因子有碱性纤维蛋白生长因子(FGF2)和血管内皮生长因子(VEGF),主要的血管新生抑制因子有血管抑素(angiostatin)、内皮抑素(endostatin)、血小板第4因子(PF-4)等[1~3]。FGF2通过与特异性细胞表面受体和硫酸肝素聚糖蛋白(proteoglycans,HGSP)结合而发挥其生物学作用。HGSP通过稳定FGF2/FGF受体、保护FGF2不被降解、或促进FGF2的寡聚而促进FGF2与高亲和力受体结合[2]。有关PF-4抗血管新生的作机理尚未完全阐明,本文拟通过研究PF-4与FGF2及其受体间的相互作用来探讨其作用机理。
, http://www.100md.com 材料与方法
细胞:
将小鼠肺微血管内皮细胞(LEII细胞,美国红十字会 Thomas Maciag 博士惠赠)37℃下置于5%CO2孵箱,培养基为DMEM(GIBCO,Life Technologies),含10%胎牛血清(GIBCO)、1g/L葡萄糖、1%的谷氨酸以及50IU/ml的青霉素/50μg/ml的链霉素。将缺乏硫酸肝素的中国仓鼠卵细胞(CHOm-FGFR-1细胞,745-flg; 以色列Weizmann研究所Avner Yayon博士惠赠)置于含10%胎牛血清(GIBCO)、1g/L葡萄糖、1%的非必需氨基酸的DMEM培养基中,37℃下置于5%CO2孵箱培养。这种细胞HGSP的表达量小于5%。125I-FGF2与低亲和力位点(用20mmol/L的HEPES和2mol/L的NaCl抽提,pH7.4)的结合小于总的特异性结合的3%(125I-FGF2与低亲和力和高亲和力位点的结合的总和)。
, 百拇医药
细胞增殖实验:
按Bikfalvi等[4]的方法进行:将细胞(2×104)接种于3.5CM2的培养瓶中,含10%胎牛血清、1%的谷氨酸和抗生素的DMEM,经过贴壁过夜,用无血清的DMEM和含1%胎牛血清的待测培养基将细胞洗1次。加入相应浓度的FGF2和PF4,在特定的时间用库尔特细胞自动计数仪计数细胞数。
FGF2的结合实验
用125I-Na(Pierce,Rockford,IL)标记FGF2,125I-FGF2的比活性为8~20×104cpm/ng。FGF2与低亲和力和高亲和力位点的结合实验按Moscatelli[5]的方法进行:将2.5×105细胞接种于含完全培养基的3.5CM2的培养瓶中,培养2d。然后将细胞用冰预冷的磷酸缓冲液洗2次,再与相应浓度的125I-FGF2在DMEM中(此培养基含20mmol/L的HEPES,pH7.4,0.15%的gelatin)4℃下孵育2h,有或无1μg/ml未标记的配体(FGF2)。孵育结束时将细胞用冰预冷的磷酸缓冲液洗3次,用冰预冷的20mmol/L的HEPES(pH7.4),2mol/L NaCl将细胞洗20s,共2次,使125I-FGF2与细胞的低亲和力位点解离:用冰预冷20mmol/L的醋酸钠(pH4.0),2mol/L Nacl将细胞洗20s,共2次,使125I-FGF2与细胞的高亲和力位点解离。用Kontron MR250 γ计数仪 (Saint-Quentin-Yvelines,法国)对结合的125I-FGF2定量。用125I-FGF2及超过其含量100的未标记的配体与空白培养瓶孵育以测定非特异性结合。总结合量减去非特异性结合量即为特异性结合量。
, http://www.100md.com
FGF2的内化和降解
125I-FGF2的内化实验按Roghani等[6]的方法进行:LEII细胞与125I-FGF2(10ng/ml)加或不加PF4(2μg/ml),37℃下置于5%CO2孵箱培养。在指定的时间将细胞用冰预冷的PBS洗涤3次,细胞表面结合的物质用抽提的方法去除:用含2mol/L Nacl的20mmol/L的HEPES(pH7.4)将细胞洗20s,共2次;用含2mol/L Nacl的20mmol/L的醋酸钠(pH4.0)将细胞洗20s,共2次。内化的放射活性按以下方法测定:用抽提缓冲液溶解细胞(缓冲液由10%的甘油、2%SDS和含1.6mmol/L EDTA的125mmol/L的Tris-HCl(pH6.8)组成),然后用γ计数仪测定。在其他实验中,用15%的SDS-PAGE凝胶电泳将细胞提取物分开,干燥,放射自显影或用Phosphorlmager分析。溶液部分则与三氯醋酸(终浓度为12%)在4℃下共培养过夜,沉淀后分析溶于三氯醋酸的部分和沉淀部分的放射活性。
, http://www.100md.com
结 果
PF4抑制FGF2诱导的内皮细胞增殖
将小鼠肺毛细血管内皮细胞(LEII细胞)与PF4和FGF2(10ng/ml)共培养,6d后,单独与FGF2培养的LEII细胞数增加了3倍;而与PF4(2μg/ml)和FGF2共培养的LEII细胞数与对照组细胞数相同(见图1)。这说明2μg/ml的PF4完全抑制了FGF2诱导的内皮细胞增殖。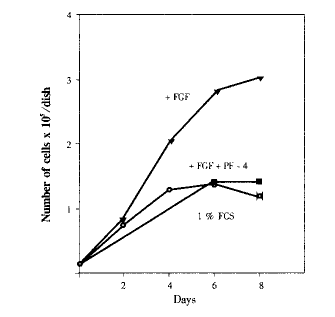
图1 PF4对内皮细胞增殖的作用
PF4抑制FGF2与内皮细胞结合
将LEII细胞与125I-FGF2(10ng/ml)和PF4(1-10000ng/ml)共培养,FGF2与低亲和力和高亲和力位点的结合受PF4抑制,这种抑制呈浓度依赖性(见图2,3)。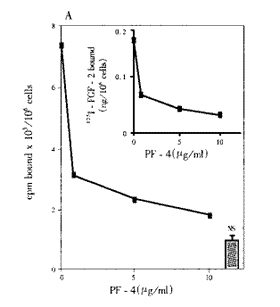
, 百拇医药
图2 PF4对125I-FGF-2与内皮细胞(高亲和力位点)结合的影响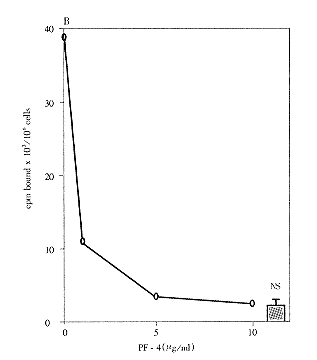
图3 PF4对125I-FGF-2与内皮细胞(低亲和力位点)结合的影响
5~10μg/ml的PF4能最大限度地抑制FGF2与低亲和力或高亲和力位点(FGF受体)结合。0.72μg/ml的PF4能最大限度地抑制FGF2与低亲和力结合,0.6μg/ml的PF4能最大限度地抑制FGF2与高亲和力位点结合。人VEGF165、血小板衍生生长因子BB(PDGF BB)、表皮生长因子(EGF)不与FGF2竞争结合位点。为了解PF4对FGF2结合的抑制效应,在PF4存在的情况下做125I-FGF2与细胞表面受体交联的实验。用SDS-PAGE和同位素自显影的方法检测交联物。在PF4存在的情况下,交联物的强度减低了3倍(为对照组的34%,图4)。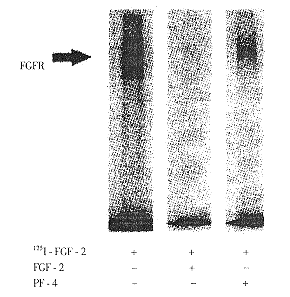
, 百拇医药
图4 PF4对125I-FGF-2与FGFR交联的影响
抑制FGF2的内化、降解和生物活性
在有或无PF4(2μg/ml)存在的情况下,将LEII细胞与125I-FGF2(10ng/ml)在37℃下共培养24h,分析与膜结合及细胞的125I-FGF2的量,如图5所示。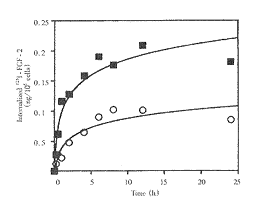
图5 PF4对125I-FGF-2内化的影响
125I-FGF2的长期内化被PF4抑制。无PF4时(■),125I-FGF2内化的最大值为0.209ng/106细胞,加PF4后(○),内化值降为0.102ng/106细胞。加入PF4后1h,内化的起始速率比不加PF4(R1=0.116ng/106细胞/h)下降近3倍(R2=0.037ng/106细胞/h)。将培养基用三氯醋酸沉淀后分析溶于三氯醋酸的部分和沉淀部分的放射活性。我们发现PF4使溶于三氯醋酸部分的放射活性降低。另外,我们检测了细胞提取液125I-FGF2降解成份。可检测到15kD、10kD、6kD三种片段。无PF4时,8h后125I-FGF2被完全降解为15kD、10kD、6kD三种片段。有PF4时,125I-FGF2降解片段的出现时间延迟。12h后才将18kD的FGF2降解为15kD、10kD、6kD三种片段。提示PF4使18kD的FGF2降解为低分子量形式的时间延迟。
, 百拇医药
讨 论
血管新生是近年来新兴的一个研究领域,几乎涉及医学研究的各个领域。占人类死亡原因前两位的恶性肿瘤和心血管系统疾病都与血管新生有关。阐明血管新生的调控机理将有利于改善上述两类疾病的预后。如前所述,FGF2是一种主要的血管新生刺激因子,而PF4是一种主要的血管新生抑制因子[1]。我们的研究结果表明PF4抑制FGF2与其受体的结合、抑制FGF2的内化和降解。FGF2与低亲和力和高亲和力位点的结合受PF4抑制,将125I-FGF2与FGF受体交联后,PF4使交联物的强度明显减弱。Sato等[7]的实验支持我们的结论:他们报道PF4抑制FGF2与3T3纤维母细胞的低亲和力和高亲和力位点的结合;而Brown等[8]则报道PF4仅抑制FGF2与低亲和力位点的结合。这种结论的不一致的原因目前尚不清楚。最近有人对聚糖蛋白的性质进行了研究。Luater等[9]报道PF4能抑制干扰素诱导蛋白10(IP10)与聚糖蛋白结合。这表明PF4和IP10可能有共同的聚糖蛋白结合位点。我们发现当PF4浓度2μg/ml时能完全抑制内皮细胞的增殖。Gupta等[10]的结果与我们的一致,他们用牛视网膜微血管内皮细胞以及源于人主动脉、胎牛心脏和人脐带的内皮细胞进行实验,当PF4 浓度为1~3μg/ml时能使这些内皮细胞的增殖受抑。有趣的是生理状态下,血小板可在体内局部释放这一浓度的PF4(2.5~25μg/ml)[11]。当PF4的浓度达到最大限度地抑制FGF-2增殖时,FGF-2的内化降低了3倍,FGF-2降解片段的出现也延迟。这说明除FGF-2结合受损伤外,FGF-2的内化也被PF4抑制。有几种机理可以解释PF4对FGF-2结合和活性的抑制。其一,PF4可能仅与FGF2竞争硫酸肝素,后者对维持FGF-2的活性非常重要;其二,PF4可能直接与FGF-2的受体结合,从而在受体水平竞争;其三,PF4可能与FGF-2形成复合物并抑制FGF-2二聚体的形成(我们的实验已证实了这一假说,材料另文发表)。
, 百拇医药
本文受国家自然科学基金(3978007)和中国医学科学院项目基金(971016)资助
参考文献
1,Han ZC, Liu Y. Angiogenesis: State of the art. Int J Hematol 1999,70:68
2,Bikfalvi A, Klein S, Pintucci G, et al. Biological roles of fibroblast growth factor-2. Endocr Rev 1997,18:26
3,Maione TE, Gray GS, Petro J, et al. Inhibition of angiogenesis by recombinant human platelet factor-4 and related peptides. Science 1990,247:
, 百拇医药
77
4,Bikfalvi A, Klein S, Pintucci G, et al.Differential modulation of cell phenotype by different molecular weight forms of basic fibroblast growth factor: Possible intracellular signaling by the high molecular weight forms. J Cell Biol 1995,129:233
5,Moscatelli D. High and low affinity binding sites for basic fibroblast growth factor on cultured cells: Absence of a role for low affinity binding in the stimulation of plsaminogen activator production by bovine capillary endothelial cells. J Cell Physiol 1987,131:123
, 百拇医药
6,Roghani M, Moscatelli D. Basic fibroblast growth factor is internalized through both receptormediated and heparan sulfate-mediated mechanisms. J Biol Chem 1992,267:22156
7,Sato Y, Abe M, Takaki R. Platelet factor 4 blocks the binding of basic fibroblast growth factor to the receptor and inhibits the spontaneous migration of vascular endothelial cells. Biochem Biophys Res Commun 1990,172:595
8,Brown KJ, Parish CR. Histidine_rich glycoprotein and platelet factor_4 mask heparan sulfate proteoglyeans recognized by acidic and basic fibroblast growth factor. Biochemistry 1994,33:13918
, http://www.100md.com
9,Luster AD, Greenberg SM, Leder P. The IP_10 chemokine binds to a specific cell surface heparan sulfate site shared with platelet factor 4 and inhibits endothelial cell prollferation. J Exp Med 1997,182:219
10,Gupta SK, Singh JP. Inhibition of endothelial cell proliferation by platelet factor_4 involves a unique action on S phase progression. J Cell Biol 1994,127:1121
11,Files JC, Melpas JW, Yee EK, et al. Studies of human plate alpha-granule release in vivo. Blood 1981,58:607
(收稿1999-11-08), 百拇医药
单位:韩忠朝(300020 天津市,中国医学科学院中国协和医科大学血液学研究所血液病医院,实验血液学国家重点实验室);杨仁池(300020 天津市,中国医学科学院中国协和医科大学血液学研究所血液病医院,实验血液学国家重点实验室)
关键词:血管新生;血小板第4因子;纤维母细胞生长因子
中国微循环000106
【摘要】 目的 研究血小板第4因子(PF4)抑制血管新生的机制。方法 通过研究PF4与纤维母细胞生长因子-2(FGF2)及其受体间的相互作用来探讨PF4抑制血管新生的机制。结果 FGF2与低亲和力和高亲和力位点的结合受PF4抑制,这种抑制呈浓度依赖性。5~10μg/ml的PF4能最大限度地抑制FGF2与低亲和力或高亲和力位点(FGF受体)结合。0.72μg/ml的PF4能使FGF2与低亲和力位点结合减少50%,0.6μg/ml的PF4能使FGF2与高亲和力位点结合减少50%。2μg/ml的PF4能完全抑制内皮细胞的增殖。在该浓度下,PF4使125I-FGF2的内化下降近3倍。结论:PF4抑制血管新生的机制之一是抑制FGF2与其受体结合。
, http://www.100md.com
Study on the Mechanism of Platelet Factor 4 Inhibiting Angiogenesis
Han Zhongchao,Yang Renchi.
(Institute of Hematology and Blood Diseases Hospital, State Key Laboratory of Experimental Hematology, CAMS and PUMS, Tianjin 300020)
【Abstract】 Objective To explore the mechanism of platelet factor 4 (PF-4) inhibiting angiogenesis. Methods To investigate the mechanism by examining the interaction of PF-4 and the fibroblast growth factor-2(FGF-2)/fibroblast growth factor receptor (FGFR) system. Results FGF-2 binding to low-affinity sites or high-affinity binding sites was inhibited in a concentration-dependent manner by PF-4. Maximum inhibition of FGF-2 binding to low-affinity sites or high-affinity binding sites (FGF receptors) reached at 5~10μg/ml PF4 with half maximum inhibition at 0.72 and 0.6μg/ml, respectively, and proliferation was completely inhibited at 2μg/ml. At this concentration, PF-4 reduced internalization of 125I-FGF-2 by threefold and degradation delayed. Conclusion One mechanism of PF-4 inhibiting angiogenesis is that the binding of FGF-2 to its receptor is inhibited by PF-4.
, 百拇医药
【Key words】 Angiogenesis Platelet factor 4 Fibroblast growth factor 2
恶性肿瘤的侵袭与转移有赖于血管新生。血管新生受一系列刺激和抑制因子调节,这些因子控制着内皮细胞的增殖和迁移。其中主要的血管新生刺激因子有碱性纤维蛋白生长因子(FGF2)和血管内皮生长因子(VEGF),主要的血管新生抑制因子有血管抑素(angiostatin)、内皮抑素(endostatin)、血小板第4因子(PF-4)等[1~3]。FGF2通过与特异性细胞表面受体和硫酸肝素聚糖蛋白(proteoglycans,HGSP)结合而发挥其生物学作用。HGSP通过稳定FGF2/FGF受体、保护FGF2不被降解、或促进FGF2的寡聚而促进FGF2与高亲和力受体结合[2]。有关PF-4抗血管新生的作机理尚未完全阐明,本文拟通过研究PF-4与FGF2及其受体间的相互作用来探讨其作用机理。
, http://www.100md.com 材料与方法
细胞:
将小鼠肺微血管内皮细胞(LEII细胞,美国红十字会 Thomas Maciag 博士惠赠)37℃下置于5%CO2孵箱,培养基为DMEM(GIBCO,Life Technologies),含10%胎牛血清(GIBCO)、1g/L葡萄糖、1%的谷氨酸以及50IU/ml的青霉素/50μg/ml的链霉素。将缺乏硫酸肝素的中国仓鼠卵细胞(CHOm-FGFR-1细胞,745-flg; 以色列Weizmann研究所Avner Yayon博士惠赠)置于含10%胎牛血清(GIBCO)、1g/L葡萄糖、1%的非必需氨基酸的DMEM培养基中,37℃下置于5%CO2孵箱培养。这种细胞HGSP的表达量小于5%。125I-FGF2与低亲和力位点(用20mmol/L的HEPES和2mol/L的NaCl抽提,pH7.4)的结合小于总的特异性结合的3%(125I-FGF2与低亲和力和高亲和力位点的结合的总和)。
, 百拇医药
细胞增殖实验:
按Bikfalvi等[4]的方法进行:将细胞(2×104)接种于3.5CM2的培养瓶中,含10%胎牛血清、1%的谷氨酸和抗生素的DMEM,经过贴壁过夜,用无血清的DMEM和含1%胎牛血清的待测培养基将细胞洗1次。加入相应浓度的FGF2和PF4,在特定的时间用库尔特细胞自动计数仪计数细胞数。
FGF2的结合实验
用125I-Na(Pierce,Rockford,IL)标记FGF2,125I-FGF2的比活性为8~20×104cpm/ng。FGF2与低亲和力和高亲和力位点的结合实验按Moscatelli[5]的方法进行:将2.5×105细胞接种于含完全培养基的3.5CM2的培养瓶中,培养2d。然后将细胞用冰预冷的磷酸缓冲液洗2次,再与相应浓度的125I-FGF2在DMEM中(此培养基含20mmol/L的HEPES,pH7.4,0.15%的gelatin)4℃下孵育2h,有或无1μg/ml未标记的配体(FGF2)。孵育结束时将细胞用冰预冷的磷酸缓冲液洗3次,用冰预冷的20mmol/L的HEPES(pH7.4),2mol/L NaCl将细胞洗20s,共2次,使125I-FGF2与细胞的低亲和力位点解离:用冰预冷20mmol/L的醋酸钠(pH4.0),2mol/L Nacl将细胞洗20s,共2次,使125I-FGF2与细胞的高亲和力位点解离。用Kontron MR250 γ计数仪 (Saint-Quentin-Yvelines,法国)对结合的125I-FGF2定量。用125I-FGF2及超过其含量100的未标记的配体与空白培养瓶孵育以测定非特异性结合。总结合量减去非特异性结合量即为特异性结合量。
, http://www.100md.com
FGF2的内化和降解
125I-FGF2的内化实验按Roghani等[6]的方法进行:LEII细胞与125I-FGF2(10ng/ml)加或不加PF4(2μg/ml),37℃下置于5%CO2孵箱培养。在指定的时间将细胞用冰预冷的PBS洗涤3次,细胞表面结合的物质用抽提的方法去除:用含2mol/L Nacl的20mmol/L的HEPES(pH7.4)将细胞洗20s,共2次;用含2mol/L Nacl的20mmol/L的醋酸钠(pH4.0)将细胞洗20s,共2次。内化的放射活性按以下方法测定:用抽提缓冲液溶解细胞(缓冲液由10%的甘油、2%SDS和含1.6mmol/L EDTA的125mmol/L的Tris-HCl(pH6.8)组成),然后用γ计数仪测定。在其他实验中,用15%的SDS-PAGE凝胶电泳将细胞提取物分开,干燥,放射自显影或用Phosphorlmager分析。溶液部分则与三氯醋酸(终浓度为12%)在4℃下共培养过夜,沉淀后分析溶于三氯醋酸的部分和沉淀部分的放射活性。
, http://www.100md.com
结 果
PF4抑制FGF2诱导的内皮细胞增殖
将小鼠肺毛细血管内皮细胞(LEII细胞)与PF4和FGF2(10ng/ml)共培养,6d后,单独与FGF2培养的LEII细胞数增加了3倍;而与PF4(2μg/ml)和FGF2共培养的LEII细胞数与对照组细胞数相同(见图1)。这说明2μg/ml的PF4完全抑制了FGF2诱导的内皮细胞增殖。

图1 PF4对内皮细胞增殖的作用
PF4抑制FGF2与内皮细胞结合
将LEII细胞与125I-FGF2(10ng/ml)和PF4(1-10000ng/ml)共培养,FGF2与低亲和力和高亲和力位点的结合受PF4抑制,这种抑制呈浓度依赖性(见图2,3)。

, 百拇医药
图2 PF4对125I-FGF-2与内皮细胞(高亲和力位点)结合的影响

图3 PF4对125I-FGF-2与内皮细胞(低亲和力位点)结合的影响
5~10μg/ml的PF4能最大限度地抑制FGF2与低亲和力或高亲和力位点(FGF受体)结合。0.72μg/ml的PF4能最大限度地抑制FGF2与低亲和力结合,0.6μg/ml的PF4能最大限度地抑制FGF2与高亲和力位点结合。人VEGF165、血小板衍生生长因子BB(PDGF BB)、表皮生长因子(EGF)不与FGF2竞争结合位点。为了解PF4对FGF2结合的抑制效应,在PF4存在的情况下做125I-FGF2与细胞表面受体交联的实验。用SDS-PAGE和同位素自显影的方法检测交联物。在PF4存在的情况下,交联物的强度减低了3倍(为对照组的34%,图4)。

, 百拇医药
图4 PF4对125I-FGF-2与FGFR交联的影响
抑制FGF2的内化、降解和生物活性
在有或无PF4(2μg/ml)存在的情况下,将LEII细胞与125I-FGF2(10ng/ml)在37℃下共培养24h,分析与膜结合及细胞的125I-FGF2的量,如图5所示。

图5 PF4对125I-FGF-2内化的影响
125I-FGF2的长期内化被PF4抑制。无PF4时(■),125I-FGF2内化的最大值为0.209ng/106细胞,加PF4后(○),内化值降为0.102ng/106细胞。加入PF4后1h,内化的起始速率比不加PF4(R1=0.116ng/106细胞/h)下降近3倍(R2=0.037ng/106细胞/h)。将培养基用三氯醋酸沉淀后分析溶于三氯醋酸的部分和沉淀部分的放射活性。我们发现PF4使溶于三氯醋酸部分的放射活性降低。另外,我们检测了细胞提取液125I-FGF2降解成份。可检测到15kD、10kD、6kD三种片段。无PF4时,8h后125I-FGF2被完全降解为15kD、10kD、6kD三种片段。有PF4时,125I-FGF2降解片段的出现时间延迟。12h后才将18kD的FGF2降解为15kD、10kD、6kD三种片段。提示PF4使18kD的FGF2降解为低分子量形式的时间延迟。
, 百拇医药
讨 论
血管新生是近年来新兴的一个研究领域,几乎涉及医学研究的各个领域。占人类死亡原因前两位的恶性肿瘤和心血管系统疾病都与血管新生有关。阐明血管新生的调控机理将有利于改善上述两类疾病的预后。如前所述,FGF2是一种主要的血管新生刺激因子,而PF4是一种主要的血管新生抑制因子[1]。我们的研究结果表明PF4抑制FGF2与其受体的结合、抑制FGF2的内化和降解。FGF2与低亲和力和高亲和力位点的结合受PF4抑制,将125I-FGF2与FGF受体交联后,PF4使交联物的强度明显减弱。Sato等[7]的实验支持我们的结论:他们报道PF4抑制FGF2与3T3纤维母细胞的低亲和力和高亲和力位点的结合;而Brown等[8]则报道PF4仅抑制FGF2与低亲和力位点的结合。这种结论的不一致的原因目前尚不清楚。最近有人对聚糖蛋白的性质进行了研究。Luater等[9]报道PF4能抑制干扰素诱导蛋白10(IP10)与聚糖蛋白结合。这表明PF4和IP10可能有共同的聚糖蛋白结合位点。我们发现当PF4浓度2μg/ml时能完全抑制内皮细胞的增殖。Gupta等[10]的结果与我们的一致,他们用牛视网膜微血管内皮细胞以及源于人主动脉、胎牛心脏和人脐带的内皮细胞进行实验,当PF4 浓度为1~3μg/ml时能使这些内皮细胞的增殖受抑。有趣的是生理状态下,血小板可在体内局部释放这一浓度的PF4(2.5~25μg/ml)[11]。当PF4的浓度达到最大限度地抑制FGF-2增殖时,FGF-2的内化降低了3倍,FGF-2降解片段的出现也延迟。这说明除FGF-2结合受损伤外,FGF-2的内化也被PF4抑制。有几种机理可以解释PF4对FGF-2结合和活性的抑制。其一,PF4可能仅与FGF2竞争硫酸肝素,后者对维持FGF-2的活性非常重要;其二,PF4可能直接与FGF-2的受体结合,从而在受体水平竞争;其三,PF4可能与FGF-2形成复合物并抑制FGF-2二聚体的形成(我们的实验已证实了这一假说,材料另文发表)。
, 百拇医药
本文受国家自然科学基金(3978007)和中国医学科学院项目基金(971016)资助
参考文献
1,Han ZC, Liu Y. Angiogenesis: State of the art. Int J Hematol 1999,70:68
2,Bikfalvi A, Klein S, Pintucci G, et al. Biological roles of fibroblast growth factor-2. Endocr Rev 1997,18:26
3,Maione TE, Gray GS, Petro J, et al. Inhibition of angiogenesis by recombinant human platelet factor-4 and related peptides. Science 1990,247:
, 百拇医药
77
4,Bikfalvi A, Klein S, Pintucci G, et al.Differential modulation of cell phenotype by different molecular weight forms of basic fibroblast growth factor: Possible intracellular signaling by the high molecular weight forms. J Cell Biol 1995,129:233
5,Moscatelli D. High and low affinity binding sites for basic fibroblast growth factor on cultured cells: Absence of a role for low affinity binding in the stimulation of plsaminogen activator production by bovine capillary endothelial cells. J Cell Physiol 1987,131:123
, 百拇医药
6,Roghani M, Moscatelli D. Basic fibroblast growth factor is internalized through both receptormediated and heparan sulfate-mediated mechanisms. J Biol Chem 1992,267:22156
7,Sato Y, Abe M, Takaki R. Platelet factor 4 blocks the binding of basic fibroblast growth factor to the receptor and inhibits the spontaneous migration of vascular endothelial cells. Biochem Biophys Res Commun 1990,172:595
8,Brown KJ, Parish CR. Histidine_rich glycoprotein and platelet factor_4 mask heparan sulfate proteoglyeans recognized by acidic and basic fibroblast growth factor. Biochemistry 1994,33:13918
, http://www.100md.com
9,Luster AD, Greenberg SM, Leder P. The IP_10 chemokine binds to a specific cell surface heparan sulfate site shared with platelet factor 4 and inhibits endothelial cell prollferation. J Exp Med 1997,182:219
10,Gupta SK, Singh JP. Inhibition of endothelial cell proliferation by platelet factor_4 involves a unique action on S phase progression. J Cell Biol 1994,127:1121
11,Files JC, Melpas JW, Yee EK, et al. Studies of human plate alpha-granule release in vivo. Blood 1981,58:607
(收稿1999-11-08), 百拇医药