TNF-α诱导类风湿关节炎滑膜成纤维细胞MAPKs通路的活化
作者:孙铁铮 吕厚山 药立波 袁燕林 关振鹏 张育军
单位:孙铁铮(北京医科大学人民医院骨关节病诊疗研究中心,北京 100044);吕厚山(北京医科大学人民医院骨关节病诊疗研究中心,北京 100044);药立波(西安第四军医大学生化系,西安 710032);袁燕林(北京医科大学人民医院骨关节病诊疗研究中心,北京 100044)
关键词:关节炎;成纤维细胞;信号转导;TNF-alpha;Mapk
中国免疫学杂志000615 摘 要 目的:研究INF-α在类风湿关节炎(Rheumatoid arthritis,RA)成纤维样滑膜细胞(Fibroblast-like synoviocyte,FLS)信号转导中MAPKs激活情况。方法:原代培养类风湿性关节炎滑膜成纤维细胞;应用Western blot检测TNF-α短时间内引起RA FLS蛋白质酪氨酸磷酸化状态变化,及其对MAPKs家族成员活化的浓度效应和时相特点。结果:INF-α可以瞬时引起RA FLS 蛋白质酪氨酸磷酸化程度增加;并在短时间内激活MAPKs通路(ERK2、JNK2、P38为主),不同浓度梯度TNF-α作用显示:10 U/ml时对ERK2、JNK2即可达到峰值活化,100 U/ml时P38达到最大活化。时间上,ERK2、JNK2、P38的活化分别在TNF-α作用后5 min、15 min、15 min最明显。结论:INF-α在RA FLS 信号转导中,可以瞬时导致蛋白质酪氨酸磷酸化程度增加,并同时激活MAPKs 3条通路,但是MAPKs 3个亚家族成员的活化具有异质性。
, 百拇医药
中国图书分类号 R593.22
Activation of MAPKs in signal transduction of TNF-α in fibroblast-like synoviocytes of rheumatoid arthritis
SUN Tie-Zheng,L Hou-Shan,YAO Li-Bo et al
(Arthritis Clinic and Research Center,People's Hospital,Beijing Medical University,Beijing 100044)
Abstract Objective:To study on MAPKs activation in rheumatoid arthritis fibroblast-like synoviocytes (RA FLS) under the stimulation of TNF-α.Methods:RA FLS were primarily cultured;Western blot was applied to examine transient change of protein tyrosine phosphoralation status and MAPKs activation in RA FLS stimulated with various doses and periods of TNF-α.Results:TNF-α transiently increased protein tyrosine phosphoralation,and activated MAPKs cascades(mainly ERK2,JNK2,P38) in RA FLS.The peak activation of ERK2 and JNK were abstained at 10 U/ml,but that of P38 was at 100 U/ml.The maximal activations of ERK2,JNK2 and P38 took place at 5 min、15 min and 15 min respectively after stimulation with TNF-α.Conclusion:During signal transduction of TNF-α in RA FLS,tyrosine phoshorylation were increased transiently,MAPKs cascades were activated in a few minutes and there was heterogenicity of activation among three subfamily members.
, 百拇医药
Key words Arthritis Fibroblasts Signal transduction TNF-alpha Mapk
类风湿关节炎(Rheumatoid Arthritis,RA)是一种由细胞因子介导的慢性疾病,以滑膜组织炎性增生,关节进行性破坏为特征。在类风湿关节炎的病情进展中,TNF-α在促进成纤维样滑膜细胞功能活化并导致关节炎性破坏过程中发挥重要作用:TNF-α可以诱导IL-1、IL-6的产生,促进胶原酶、MMP、PGE2的合成,增强粘附分子ICAM-1、VCAM-1的表达等[1]。另外,TNF-α的转基因小鼠出现多关节炎性改变[2]。然而,TNF-α在类风湿关节炎中滑膜成纤维细胞中引发上述改变的信号转导机制尚不明了。TNFR不具备任何激酶活性,但是它却可以引起许多细胞靶蛋白分子的快速磷酸化[3]。我们通过应用TNF-α作用于RA FLS观察TNF-α信号转导过程中MAPKs(Mitogen-activated protein kinases)通路的激活情况。
, http://www.100md.com
1 材料与方法
1.1 滑膜细胞的培养 滑膜均取材于北京医科大学人民医院骨关节诊疗研究中心行膝关节置换或滑膜切除术的类风湿关节炎病人,所有病人均符合1987年美国风湿病协会修订的类风湿关节炎诊断标准[4]。术中取出滑膜组织,立即于无菌条件下剪碎,1.0 mg/ml I型胶原酶(Gibco-BRL)37℃消化4 h,离心收集细胞,加入20%FBS-DMEM(Gibco-BRL)培养液,置于37℃、5%CO2孵箱中令其贴壁生长,细胞生长至85%汇满时,胰蛋白酶-EDTA消化进行1:3传代。本实验中采用3~5代滑膜成纤维细胞,型别均一,纯度可达98%(CD3、CD14、CD20、CD11b、Von willibrand factor阳性细胞比例均小于1%)。
1.2 细胞因子作用和蛋白提取与定量 将同一来源的3~5代滑膜成纤维样细胞5×105种于60 mm平皿(Costar)中,生长至85%汇满时,弃去培养液,换用含0.3%BSA或1%小牛血清的DMEM培养液静息24 h,分别加入TNF-α不同浓度梯度(1、10、100 U/ml)作用5 min,10 U/ml TNF-α作用不同时间(1 min、2 min、5 min、15 min),预冷PBS冲洗细胞,立即加入100 μl细胞裂解液[20 mmol/L Tris/Cl (pH 8.0),1%(v/v) NP-40,150 mmol/L NaCl,0.1%(v/w)NaN3,5 μg/ml aprotinin,1 mmol/L PMSF,1 mmol/L EDTA,1 mmol/L Na3VO4,25 μmol/L PNP',1 μmol/L pepstatin A,1 μmol/L leupeptin],刮下细胞,冰上裂解30 min,12 000 r/min离心15 min,取上清,-70℃冻存。电泳前采用Bio-Rad DC Protein Assay进行总蛋白浓度测定,保证每孔上样量的一致性。
, http://www.100md.com
1.3 SDS-PAGE蛋白电泳和Western印迹杂交 取上述30 μg细胞裂解提取物,加入5×上样缓冲液[250 mmol/L Tris/Cl(pH 6.8),500 mmol/L DTT,100 mg/ml SDS,20%甘油,少量溴酚兰],进行10%SDS-PAGE电泳,半干转移至硝酸纤维素膜(Gelman),5%奶粉封闭过夜,分加入抗磷酸化酪氨酸单克隆抗体(4G10)1:2 000 (Promega),抗活化形式ERK抗体1:2 000 (Promega),抗活化形式 JNK抗体1:2 000 (Promega),抗活化形式P38抗体1:2 000 (Promega),室温杂交3 h,PBS-Tweern 20洗膜5 min×3次,HRP标记的相应二抗作用2 h,洗膜后ECL化学发光(Amersham),Kodak X 片曝光,显像。将上述硝酸纤维素膜4℃湿化状态下封闭保存,1 w内将膜上抗体洗脱,50℃作用30 min,重新封闭,分别加入非活化形式ERK、JNK、P38抗体(Promega),之后加入HRP标记相应二抗,ECL化学增强发光,Kodak X片曝光显像。作为衡量蛋白上样量一致性的内参照。
, 百拇医药
2 结果
应用特异性抗酪氨酸磷酸化抗体(4G10)进行Western Blot显示,TNF-α可以在短时间内导致RA FLS蛋白酪氨酸残基磷酸化程度增加,见图1,其中以110、97、80、75、65、54、46、42、38 kD等蛋白条带最为明显。在1~15 min时间内,110、97、80、75、65、54、38 kD蛋白磷酸化逐渐增强,42 kD蛋白于5 min磷酸化程度最高,以后逐渐减弱。因为MAPKs 3个亚家族成员的活化形式均发生Tyr-Xaa-Thr双重位点磷酸化,所以我们推测TNF-α导致P54、P46、P42、P38酪氨酸磷酸化极可能即为MAPKs家族中的JNK2、JNK1、ERK2、P38,为求进一步验证,我们采用抗活化形式MAPKs的抗体进行Western Blot,检测TNF-α刺激下MAPKs家族成员活化的浓度效应及其时相特点。TNF-α可以激活ERK,但是以ERK2、(P42)为主,而对于ERK1(P44)活化作用较弱。其中不同浓度TNF-α(1、10、100 U/ml)作用于RA FLS,10 U/ml时对于ERK2即可以达到最大活化,10 U/ml TNF-α刺激不同时间显示5 min时ERK2活化最明显(见图2)。TNF-α对JNK的激活以JNK2(P54)为主,对JNK2(P46)的活化较弱,而且10 U/ml即达活化峰值,但是时间上1~15 min内JNK的活化逐渐增强(见图3);TNF-α对于P38活化在100 U/ml时达到最大活化,且在1~15 min内逐渐增强(见图4)。以上实验结果重复3次,各图所示为其中一次代表。上述硝酸纤维素膜洗脱后,以非活化形式MAPKs重新杂交显示,各条带密度无明显区别(见图5),从而证实各孔上样量的一致性,并且说明如上结果反映TNF-α作用下RA FLS中MAPKs家族成员活化状态的差异。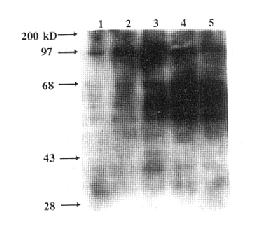
, http://www.100md.com
图1 TNF-α(10 U/ml)对于RA FLS酪氨酸磷酸化状态的瞬时影响抑制作用
Fig.1 Transient effect of TNF-α(10 U/ml) on protein tyrosine phosphorylation in RA FLS
Note:1.T0 min;2.T1 min;3.T5 min;4.T15 min;5.T15 min
图2 不同浓度梯度、时间梯度的TNF-α对于RA FLS ERK活化的影响
Fig.2 ERK activation induced by TNF-α with different concentrations and different time in RA FLS
, http://www.100md.com
Note:a.Different concentrations of TNF-α:1.T0 U/ml, 2.T1 U/ml,3.T10 U/ml,4.T50 U/ml,5.T100 U/ml;b.Different time of TNF-α:1.T15 min,2.T5 min,3.T1 min,4.T0 min
图3 不同浓度梯度、时间梯度的TNF-α对RA FLS JNK活化的影响
Fig.3 JNK activation induced by TNF-α with different concentrations and different time in RA FLS
, http://www.100md.com
Note:a.Different concentrations of TNF-α:1.T0 U/ml,2.T1 U/ml,3.T10 U/ml,4.T100 U/ml;b.Different time of TNF-α:1.T15 min,2.T5 min,3.T1 min,4.T0 min
图4 不同浓度梯度、时间梯度的TNF-α对RA FLS P38活化的影响
Fig.4 P38 activation induced by TNF-α with different concentrations
and different time in RA FLS
, 百拇医药
Note:a.Different concentrations of TNF-α:1.T0 U/ml,2.T1 U/ml,3.T10 U/ml,4.T100 U/ml;
b.Different time of TNF-α:1.T15 min,2.T5 min,3.T1 min,4.T0 min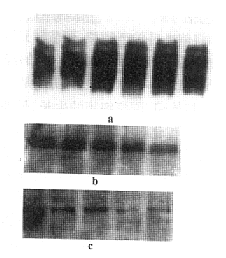
图5 非活化形式MAPKs
Fig.5 Non-active MAPKs
Note:a.non-active ERK;b.non-active JNK;c.non-active p38
, http://www.100md.com
3 讨论
目前,对于类风湿关节炎疾病发生的决定因素尚无定论。但是,作为一种重要的炎性细胞因子,TNF-α在类风湿关节炎的病情进展中发挥着重要作用。以TNF-α为靶向的抗细胞因子的治疗方法,如抗hTNF-α mAb,及其可溶性TNFR融合蛋白在临床Ⅰ、Ⅱ期实验中,对RA的治疗效果显著[2]。然而,对于TNF-α在类风湿关节炎滑膜成维样细胞中的信号转导机制至今尚不明确。
TNFR共有两种亚型:55 kD的TNFRI、75 kD的TNFRII,在绝大多数哺乳动物细胞表面都有表达。虽然表达的水平很低,但与TNF-α和TNF-β都有极高的亲和力。而且,TNFR 55 kD的受体分子介导了TNF-α的绝大多数生物学效应[5,7]。TNFR的两种亚型的胞内区都无任何激酶性[3],然而TNF-α却可以在不同类型的细胞中,诱导许多蛋白分子发生磷酸化。研究表明,TNF-α可以激活PKC、PKA、β-casein激酸等,然而如上激酶的活化并不能完全解释TNF-α所介导的生物学效应[3]。研究表明对于正常人成纤维细胞,IL-1、TNF-α可以引起相同的63种蛋白分子发生磷酸化状态的改变,其中53种磷酸化程度增强,10种磷酸化程度减弱[5,6]。这些改变的一致性表明IL-1、TNF-α可能诱导相同的早期受体后反应,可能共享一个或者相似的信号转导通路。我们在以往的实验研究中证实,IL-1可以同时激活MAPKs 3个亚家族成员[7],在本实验中我们再次证实TNF-α也可以同时激活MAPKs 3条信号通路,这为Graeme的结论提供了另一佐证。然而,TNF-α对于ERK、JNK、P38激活的浓度效应和时间效应与IL-1明显不同。我们另外加用抗IL-1 mAb,可以完全中和IL-1的作用,但对TNF-α无明显影响,类似的抗TNF-α单克隆抗体对IL-1无影响,却可以中和TNF-α的作用,这就说明TNF-α、IL-1诱导类风湿关节炎成纤维样滑膜细胞中MAPKs的激活不是两种因子彼此相互诱导产生所造成,而是两种因子与各自受体特异性结合后,可能通过相同或相似的传导通路从而产生的类似效果。
, 百拇医药
有研究表明,MAPKs可能是多条信号转导通路的交汇点(包括PKC、RPTK、JAK-STAT、离子通道等)。它整和将信息后传至胞核,调节转录因子的活性,调控相应基因的表达[8]。ERK途径的经典通路为RPTK-ras-raf-MEK1/2-ERK1/2,主要功能是介导有丝分裂信号向胞核传递,调控细胞的生长,另外还可能参与细胞分化、转化、细胞周期等生命活动的调节[8]。我们在以前的研究中发现,TNF-α在一定浓度范围内(10 U/ml)可以发挥弱的有丝分裂原作用促进类风湿关节炎滑膜成纤维细胞的生长。结合本实验结果,我们推测TNF-α的有丝分裂原作用极可能通过ERK2途径介导。JNK、P38的激活与细胞应激性改变如紫外辐射、渗透压改变或细胞因子作用有关[9]。ERK、JNK、P38不但由不同的刺激因素激活,形成不同的转导通路,激活各不相同的转录因子,调节相应基因的表达介导生物学效应,而且3条通路在MAPKs上游分子及下游分子都存在“cross talk”,从而导致3条通路间相互协同作用。由此可见,TNF-α在类风湿关节炎滑膜成纤维细胞中激活MAPKS 3条通路(ERK、JNK、P38),3条通路既相互独立,又在不同水平上相互协同,从而可能导致TNF-α在类风湿滑膜成纤维细胞中引起复杂的生物学效应。
, 百拇医药
TNF-α如何激活MAPKs通路,目前尚不清楚。我们应用抗酪氨酸磷酸化特异性单克隆抗体α-PY(4G10)发现,TNF-α可以瞬时激活酪氨酸激酶,从而导致一系列蛋白分子的酪氨酸残基磷酸化,其中包括ERK、JNK、P38。有研究发现,TNF-α作用下的人的成纤维细胞并无PKC的明显活化[4],说明PKC在TNF-α信号转导中并未发挥主要作用。酪氨酸激酶在TNF-α信号转导中的作用研究还相当少。研究发现TNF-α作用正常成纤维细胞可以激活至少1种PP60c-src[10],c-src作为胞浆内的原癌基因,具有PTK活性,参与ERK的激活,而且,TNF-α可以引起胞膜上EGFR Thr669发生磷酸化,极可能通过EGFR的聚合在MAPKs激活中发挥作用[11]。另外,在我们以往的研究中发现,类风湿关节炎滑膜成纤维细胞具有转化细胞的表现,伴有PTK活性的升高。如上因素促使我们推论酪氨酸激酶途径可能参与了TNF-α作用下MAPKs的激活。
, http://www.100md.com
综上所述,TNF-α在类风湿关节炎中同时活化MAPKs 3个亚家族成员;并引起一系列蛋白质酪氨酸残基的瞬时磷酸化,MAPKs 3个亚家族成员分子构成的信号转导通路间既相互独立,又相互协同的作用可能是TNF-α导致类风湿关节炎滑膜成纤维细胞产生复杂生物学效应,并且诱发类风湿关节炎特征性病理表现的一个重要机制所在。
本课题受国家自然科学基金重点项目资助(基金编号:39730430)
作者简介:孙铁铮,男,26岁,博士研究生,主要研究类风湿关节炎
关振鹏(北京医科大学人民医院骨关节病诊疗研究中心,北京 100044)
张育军(北京医科大学人民医院妇科,北京 100044)
参考文献
, 百拇医药 1,Lafyatis R,Remmers E F,Roberts A B et al.Anchorage-independent growth of synoviocytes from arthritic and normal joints.Stimulation by exogenous platelet-derived growth factor and inhibition by transforming growth factor-beta and retinoids.J Clin Invest,1989;83:1267
2,Ferdinand B.New tumor necrosis factor-alpha biologic therapies for rheumatoid arthritis.Eur Cytokine Netw,1998;9:233
3,Guesdon F,Freshney N,Waller R J et al.Interleukin 1 and tumor necrosis factor stimulate two novel protein kinses that phosphorylate the heat shock protein hsp 27 and β-casein.J Biol Chem,1993;268:4236
, 百拇医药
4,Arnet F C,Edworthy S M,Bloch D A et al.The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis.Arthritis Rheum,1988;31:315
5,Vandenabeele P,Declercq W,Beyaert R et al.Two tumur necrosis factor receptors:structure and function.Trends Cell Biol,1995;5:392
6,Guy G R,Chua S P.Interleukin 1 and tumor necrosis factor activate common multiple protein kinases in human fibroblasts.J Biol Chem,1991;266:14343
, 百拇医药
7,孙铁铮,药立波,吕厚山 et al.Activation of MAPKs induced by IL-1β in fibroblast-like sgnoviocytes of rheumatoid archritis.细胞与分子免疫学杂志,2000;16(2):93
8,Seger R,Krebs E G.The MAPK signaling cascade.FASEB J,1995;9:726
9,Kyriakis J M,Banerjee P,Niklokaki E et al.The stress-activated protein kinase subfamily of c-jun kinases.Nature,1994;369:156
10,Guy G R,Philp R,Tan Y H.Activation of protein kinases and the inactivation of protein phosphatase 2A in tumour necrosis factor and interleukin-1 signal-transduction pathway.Eur J Biochem,1995;229:503
11,Bird T A,Saklatvala J.IL-1 and TNF transmodulate epidermal growth factor receptors by a protein kinase C-independent machanism.J Immunol,1989;142:126
1999-09-30, http://www.100md.com
单位:孙铁铮(北京医科大学人民医院骨关节病诊疗研究中心,北京 100044);吕厚山(北京医科大学人民医院骨关节病诊疗研究中心,北京 100044);药立波(西安第四军医大学生化系,西安 710032);袁燕林(北京医科大学人民医院骨关节病诊疗研究中心,北京 100044)
关键词:关节炎;成纤维细胞;信号转导;TNF-alpha;Mapk
中国免疫学杂志000615 摘 要 目的:研究INF-α在类风湿关节炎(Rheumatoid arthritis,RA)成纤维样滑膜细胞(Fibroblast-like synoviocyte,FLS)信号转导中MAPKs激活情况。方法:原代培养类风湿性关节炎滑膜成纤维细胞;应用Western blot检测TNF-α短时间内引起RA FLS蛋白质酪氨酸磷酸化状态变化,及其对MAPKs家族成员活化的浓度效应和时相特点。结果:INF-α可以瞬时引起RA FLS 蛋白质酪氨酸磷酸化程度增加;并在短时间内激活MAPKs通路(ERK2、JNK2、P38为主),不同浓度梯度TNF-α作用显示:10 U/ml时对ERK2、JNK2即可达到峰值活化,100 U/ml时P38达到最大活化。时间上,ERK2、JNK2、P38的活化分别在TNF-α作用后5 min、15 min、15 min最明显。结论:INF-α在RA FLS 信号转导中,可以瞬时导致蛋白质酪氨酸磷酸化程度增加,并同时激活MAPKs 3条通路,但是MAPKs 3个亚家族成员的活化具有异质性。
, 百拇医药
中国图书分类号 R593.22
Activation of MAPKs in signal transduction of TNF-α in fibroblast-like synoviocytes of rheumatoid arthritis
SUN Tie-Zheng,L Hou-Shan,YAO Li-Bo et al
(Arthritis Clinic and Research Center,People's Hospital,Beijing Medical University,Beijing 100044)
Abstract Objective:To study on MAPKs activation in rheumatoid arthritis fibroblast-like synoviocytes (RA FLS) under the stimulation of TNF-α.Methods:RA FLS were primarily cultured;Western blot was applied to examine transient change of protein tyrosine phosphoralation status and MAPKs activation in RA FLS stimulated with various doses and periods of TNF-α.Results:TNF-α transiently increased protein tyrosine phosphoralation,and activated MAPKs cascades(mainly ERK2,JNK2,P38) in RA FLS.The peak activation of ERK2 and JNK were abstained at 10 U/ml,but that of P38 was at 100 U/ml.The maximal activations of ERK2,JNK2 and P38 took place at 5 min、15 min and 15 min respectively after stimulation with TNF-α.Conclusion:During signal transduction of TNF-α in RA FLS,tyrosine phoshorylation were increased transiently,MAPKs cascades were activated in a few minutes and there was heterogenicity of activation among three subfamily members.
, 百拇医药
Key words Arthritis Fibroblasts Signal transduction TNF-alpha Mapk
类风湿关节炎(Rheumatoid Arthritis,RA)是一种由细胞因子介导的慢性疾病,以滑膜组织炎性增生,关节进行性破坏为特征。在类风湿关节炎的病情进展中,TNF-α在促进成纤维样滑膜细胞功能活化并导致关节炎性破坏过程中发挥重要作用:TNF-α可以诱导IL-1、IL-6的产生,促进胶原酶、MMP、PGE2的合成,增强粘附分子ICAM-1、VCAM-1的表达等[1]。另外,TNF-α的转基因小鼠出现多关节炎性改变[2]。然而,TNF-α在类风湿关节炎中滑膜成纤维细胞中引发上述改变的信号转导机制尚不明了。TNFR不具备任何激酶活性,但是它却可以引起许多细胞靶蛋白分子的快速磷酸化[3]。我们通过应用TNF-α作用于RA FLS观察TNF-α信号转导过程中MAPKs(Mitogen-activated protein kinases)通路的激活情况。
, http://www.100md.com
1 材料与方法
1.1 滑膜细胞的培养 滑膜均取材于北京医科大学人民医院骨关节诊疗研究中心行膝关节置换或滑膜切除术的类风湿关节炎病人,所有病人均符合1987年美国风湿病协会修订的类风湿关节炎诊断标准[4]。术中取出滑膜组织,立即于无菌条件下剪碎,1.0 mg/ml I型胶原酶(Gibco-BRL)37℃消化4 h,离心收集细胞,加入20%FBS-DMEM(Gibco-BRL)培养液,置于37℃、5%CO2孵箱中令其贴壁生长,细胞生长至85%汇满时,胰蛋白酶-EDTA消化进行1:3传代。本实验中采用3~5代滑膜成纤维细胞,型别均一,纯度可达98%(CD3、CD14、CD20、CD11b、Von willibrand factor阳性细胞比例均小于1%)。
1.2 细胞因子作用和蛋白提取与定量 将同一来源的3~5代滑膜成纤维样细胞5×105种于60 mm平皿(Costar)中,生长至85%汇满时,弃去培养液,换用含0.3%BSA或1%小牛血清的DMEM培养液静息24 h,分别加入TNF-α不同浓度梯度(1、10、100 U/ml)作用5 min,10 U/ml TNF-α作用不同时间(1 min、2 min、5 min、15 min),预冷PBS冲洗细胞,立即加入100 μl细胞裂解液[20 mmol/L Tris/Cl (pH 8.0),1%(v/v) NP-40,150 mmol/L NaCl,0.1%(v/w)NaN3,5 μg/ml aprotinin,1 mmol/L PMSF,1 mmol/L EDTA,1 mmol/L Na3VO4,25 μmol/L PNP',1 μmol/L pepstatin A,1 μmol/L leupeptin],刮下细胞,冰上裂解30 min,12 000 r/min离心15 min,取上清,-70℃冻存。电泳前采用Bio-Rad DC Protein Assay进行总蛋白浓度测定,保证每孔上样量的一致性。
, http://www.100md.com
1.3 SDS-PAGE蛋白电泳和Western印迹杂交 取上述30 μg细胞裂解提取物,加入5×上样缓冲液[250 mmol/L Tris/Cl(pH 6.8),500 mmol/L DTT,100 mg/ml SDS,20%甘油,少量溴酚兰],进行10%SDS-PAGE电泳,半干转移至硝酸纤维素膜(Gelman),5%奶粉封闭过夜,分加入抗磷酸化酪氨酸单克隆抗体(4G10)1:2 000 (Promega),抗活化形式ERK抗体1:2 000 (Promega),抗活化形式 JNK抗体1:2 000 (Promega),抗活化形式P38抗体1:2 000 (Promega),室温杂交3 h,PBS-Tweern 20洗膜5 min×3次,HRP标记的相应二抗作用2 h,洗膜后ECL化学发光(Amersham),Kodak X 片曝光,显像。将上述硝酸纤维素膜4℃湿化状态下封闭保存,1 w内将膜上抗体洗脱,50℃作用30 min,重新封闭,分别加入非活化形式ERK、JNK、P38抗体(Promega),之后加入HRP标记相应二抗,ECL化学增强发光,Kodak X片曝光显像。作为衡量蛋白上样量一致性的内参照。
, 百拇医药
2 结果
应用特异性抗酪氨酸磷酸化抗体(4G10)进行Western Blot显示,TNF-α可以在短时间内导致RA FLS蛋白酪氨酸残基磷酸化程度增加,见图1,其中以110、97、80、75、65、54、46、42、38 kD等蛋白条带最为明显。在1~15 min时间内,110、97、80、75、65、54、38 kD蛋白磷酸化逐渐增强,42 kD蛋白于5 min磷酸化程度最高,以后逐渐减弱。因为MAPKs 3个亚家族成员的活化形式均发生Tyr-Xaa-Thr双重位点磷酸化,所以我们推测TNF-α导致P54、P46、P42、P38酪氨酸磷酸化极可能即为MAPKs家族中的JNK2、JNK1、ERK2、P38,为求进一步验证,我们采用抗活化形式MAPKs的抗体进行Western Blot,检测TNF-α刺激下MAPKs家族成员活化的浓度效应及其时相特点。TNF-α可以激活ERK,但是以ERK2、(P42)为主,而对于ERK1(P44)活化作用较弱。其中不同浓度TNF-α(1、10、100 U/ml)作用于RA FLS,10 U/ml时对于ERK2即可以达到最大活化,10 U/ml TNF-α刺激不同时间显示5 min时ERK2活化最明显(见图2)。TNF-α对JNK的激活以JNK2(P54)为主,对JNK2(P46)的活化较弱,而且10 U/ml即达活化峰值,但是时间上1~15 min内JNK的活化逐渐增强(见图3);TNF-α对于P38活化在100 U/ml时达到最大活化,且在1~15 min内逐渐增强(见图4)。以上实验结果重复3次,各图所示为其中一次代表。上述硝酸纤维素膜洗脱后,以非活化形式MAPKs重新杂交显示,各条带密度无明显区别(见图5),从而证实各孔上样量的一致性,并且说明如上结果反映TNF-α作用下RA FLS中MAPKs家族成员活化状态的差异。

, http://www.100md.com
图1 TNF-α(10 U/ml)对于RA FLS酪氨酸磷酸化状态的瞬时影响抑制作用
Fig.1 Transient effect of TNF-α(10 U/ml) on protein tyrosine phosphorylation in RA FLS
Note:1.T0 min;2.T1 min;3.T5 min;4.T15 min;5.T15 min

图2 不同浓度梯度、时间梯度的TNF-α对于RA FLS ERK活化的影响
Fig.2 ERK activation induced by TNF-α with different concentrations and different time in RA FLS
, http://www.100md.com
Note:a.Different concentrations of TNF-α:1.T0 U/ml, 2.T1 U/ml,3.T10 U/ml,4.T50 U/ml,5.T100 U/ml;b.Different time of TNF-α:1.T15 min,2.T5 min,3.T1 min,4.T0 min

图3 不同浓度梯度、时间梯度的TNF-α对RA FLS JNK活化的影响
Fig.3 JNK activation induced by TNF-α with different concentrations and different time in RA FLS
, http://www.100md.com
Note:a.Different concentrations of TNF-α:1.T0 U/ml,2.T1 U/ml,3.T10 U/ml,4.T100 U/ml;b.Different time of TNF-α:1.T15 min,2.T5 min,3.T1 min,4.T0 min

图4 不同浓度梯度、时间梯度的TNF-α对RA FLS P38活化的影响
Fig.4 P38 activation induced by TNF-α with different concentrations
and different time in RA FLS
, 百拇医药
Note:a.Different concentrations of TNF-α:1.T0 U/ml,2.T1 U/ml,3.T10 U/ml,4.T100 U/ml;
b.Different time of TNF-α:1.T15 min,2.T5 min,3.T1 min,4.T0 min

图5 非活化形式MAPKs
Fig.5 Non-active MAPKs
Note:a.non-active ERK;b.non-active JNK;c.non-active p38
, http://www.100md.com
3 讨论
目前,对于类风湿关节炎疾病发生的决定因素尚无定论。但是,作为一种重要的炎性细胞因子,TNF-α在类风湿关节炎的病情进展中发挥着重要作用。以TNF-α为靶向的抗细胞因子的治疗方法,如抗hTNF-α mAb,及其可溶性TNFR融合蛋白在临床Ⅰ、Ⅱ期实验中,对RA的治疗效果显著[2]。然而,对于TNF-α在类风湿关节炎滑膜成维样细胞中的信号转导机制至今尚不明确。
TNFR共有两种亚型:55 kD的TNFRI、75 kD的TNFRII,在绝大多数哺乳动物细胞表面都有表达。虽然表达的水平很低,但与TNF-α和TNF-β都有极高的亲和力。而且,TNFR 55 kD的受体分子介导了TNF-α的绝大多数生物学效应[5,7]。TNFR的两种亚型的胞内区都无任何激酶性[3],然而TNF-α却可以在不同类型的细胞中,诱导许多蛋白分子发生磷酸化。研究表明,TNF-α可以激活PKC、PKA、β-casein激酸等,然而如上激酶的活化并不能完全解释TNF-α所介导的生物学效应[3]。研究表明对于正常人成纤维细胞,IL-1、TNF-α可以引起相同的63种蛋白分子发生磷酸化状态的改变,其中53种磷酸化程度增强,10种磷酸化程度减弱[5,6]。这些改变的一致性表明IL-1、TNF-α可能诱导相同的早期受体后反应,可能共享一个或者相似的信号转导通路。我们在以往的实验研究中证实,IL-1可以同时激活MAPKs 3个亚家族成员[7],在本实验中我们再次证实TNF-α也可以同时激活MAPKs 3条信号通路,这为Graeme的结论提供了另一佐证。然而,TNF-α对于ERK、JNK、P38激活的浓度效应和时间效应与IL-1明显不同。我们另外加用抗IL-1 mAb,可以完全中和IL-1的作用,但对TNF-α无明显影响,类似的抗TNF-α单克隆抗体对IL-1无影响,却可以中和TNF-α的作用,这就说明TNF-α、IL-1诱导类风湿关节炎成纤维样滑膜细胞中MAPKs的激活不是两种因子彼此相互诱导产生所造成,而是两种因子与各自受体特异性结合后,可能通过相同或相似的传导通路从而产生的类似效果。
, 百拇医药
有研究表明,MAPKs可能是多条信号转导通路的交汇点(包括PKC、RPTK、JAK-STAT、离子通道等)。它整和将信息后传至胞核,调节转录因子的活性,调控相应基因的表达[8]。ERK途径的经典通路为RPTK-ras-raf-MEK1/2-ERK1/2,主要功能是介导有丝分裂信号向胞核传递,调控细胞的生长,另外还可能参与细胞分化、转化、细胞周期等生命活动的调节[8]。我们在以前的研究中发现,TNF-α在一定浓度范围内(10 U/ml)可以发挥弱的有丝分裂原作用促进类风湿关节炎滑膜成纤维细胞的生长。结合本实验结果,我们推测TNF-α的有丝分裂原作用极可能通过ERK2途径介导。JNK、P38的激活与细胞应激性改变如紫外辐射、渗透压改变或细胞因子作用有关[9]。ERK、JNK、P38不但由不同的刺激因素激活,形成不同的转导通路,激活各不相同的转录因子,调节相应基因的表达介导生物学效应,而且3条通路在MAPKs上游分子及下游分子都存在“cross talk”,从而导致3条通路间相互协同作用。由此可见,TNF-α在类风湿关节炎滑膜成纤维细胞中激活MAPKS 3条通路(ERK、JNK、P38),3条通路既相互独立,又在不同水平上相互协同,从而可能导致TNF-α在类风湿滑膜成纤维细胞中引起复杂的生物学效应。
, 百拇医药
TNF-α如何激活MAPKs通路,目前尚不清楚。我们应用抗酪氨酸磷酸化特异性单克隆抗体α-PY(4G10)发现,TNF-α可以瞬时激活酪氨酸激酶,从而导致一系列蛋白分子的酪氨酸残基磷酸化,其中包括ERK、JNK、P38。有研究发现,TNF-α作用下的人的成纤维细胞并无PKC的明显活化[4],说明PKC在TNF-α信号转导中并未发挥主要作用。酪氨酸激酶在TNF-α信号转导中的作用研究还相当少。研究发现TNF-α作用正常成纤维细胞可以激活至少1种PP60c-src[10],c-src作为胞浆内的原癌基因,具有PTK活性,参与ERK的激活,而且,TNF-α可以引起胞膜上EGFR Thr669发生磷酸化,极可能通过EGFR的聚合在MAPKs激活中发挥作用[11]。另外,在我们以往的研究中发现,类风湿关节炎滑膜成纤维细胞具有转化细胞的表现,伴有PTK活性的升高。如上因素促使我们推论酪氨酸激酶途径可能参与了TNF-α作用下MAPKs的激活。
, http://www.100md.com
综上所述,TNF-α在类风湿关节炎中同时活化MAPKs 3个亚家族成员;并引起一系列蛋白质酪氨酸残基的瞬时磷酸化,MAPKs 3个亚家族成员分子构成的信号转导通路间既相互独立,又相互协同的作用可能是TNF-α导致类风湿关节炎滑膜成纤维细胞产生复杂生物学效应,并且诱发类风湿关节炎特征性病理表现的一个重要机制所在。
本课题受国家自然科学基金重点项目资助(基金编号:39730430)
作者简介:孙铁铮,男,26岁,博士研究生,主要研究类风湿关节炎
关振鹏(北京医科大学人民医院骨关节病诊疗研究中心,北京 100044)
张育军(北京医科大学人民医院妇科,北京 100044)
参考文献
, 百拇医药 1,Lafyatis R,Remmers E F,Roberts A B et al.Anchorage-independent growth of synoviocytes from arthritic and normal joints.Stimulation by exogenous platelet-derived growth factor and inhibition by transforming growth factor-beta and retinoids.J Clin Invest,1989;83:1267
2,Ferdinand B.New tumor necrosis factor-alpha biologic therapies for rheumatoid arthritis.Eur Cytokine Netw,1998;9:233
3,Guesdon F,Freshney N,Waller R J et al.Interleukin 1 and tumor necrosis factor stimulate two novel protein kinses that phosphorylate the heat shock protein hsp 27 and β-casein.J Biol Chem,1993;268:4236
, 百拇医药
4,Arnet F C,Edworthy S M,Bloch D A et al.The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis.Arthritis Rheum,1988;31:315
5,Vandenabeele P,Declercq W,Beyaert R et al.Two tumur necrosis factor receptors:structure and function.Trends Cell Biol,1995;5:392
6,Guy G R,Chua S P.Interleukin 1 and tumor necrosis factor activate common multiple protein kinases in human fibroblasts.J Biol Chem,1991;266:14343
, 百拇医药
7,孙铁铮,药立波,吕厚山 et al.Activation of MAPKs induced by IL-1β in fibroblast-like sgnoviocytes of rheumatoid archritis.细胞与分子免疫学杂志,2000;16(2):93
8,Seger R,Krebs E G.The MAPK signaling cascade.FASEB J,1995;9:726
9,Kyriakis J M,Banerjee P,Niklokaki E et al.The stress-activated protein kinase subfamily of c-jun kinases.Nature,1994;369:156
10,Guy G R,Philp R,Tan Y H.Activation of protein kinases and the inactivation of protein phosphatase 2A in tumour necrosis factor and interleukin-1 signal-transduction pathway.Eur J Biochem,1995;229:503
11,Bird T A,Saklatvala J.IL-1 and TNF transmodulate epidermal growth factor receptors by a protein kinase C-independent machanism.J Immunol,1989;142:126
1999-09-30, http://www.100md.com