Tuftsin的合成及对裸鼠胆管癌模型的作用
作者:雷新 韩本立
单位:雷新(第三军医大学附属西南医院肝胆外科中心,重庆 400038);韩本立(第三军医大学附属西南医院肝胆外科中心,重庆 400038)
关键词:Tuftsin;胆管癌
第三军医大学学报000122
提要 目的:用多肽合成仪固相合成Tuftsin后,研究在体情况下Tuftsin抗胆管癌的作用。方法:用毛细管电泳仪检测合成Tuftsin的纯度。建立胆管癌裸鼠模型后,用Tuftsin治疗4周,观察治疗前后的肿瘤大小与重量和肝、脾及肿瘤组织的病理变化。结果:合成Tuftsin纯度在99.9%以上;Tuftsin治疗组和对照组肿瘤大小及重量差异明显,治疗组肝、脾组织内的单核吞噬细胞增生活跃。结论:多肽合成仪固相法合成Tuftsin方法简单,纯度高,Tuftsin可明显抑制裸鼠胆管癌组织的生长。
, 百拇医药
中图法分类号 R341.6;R735.8 文献标识码 A
文章编号:1000-5404(2000)01-0075-03
Chemical synthesis of Tuftsin and its effects on cholangiocarcinoma in nude mice
LEI Xin,HAN Ben-li
(Department of Hepatobiliary Surgery,Southwest Hospital,Third Military Medical University,Chongqing 400038)
Abstract Objective:To investigate the effects of Tuftsin on cholangiocarcinoma in vivo after it was chemically synthesized.Methods:The purity of Tuftsin was analyzed with capillary electrophoresis.The model of cholangiocarcinoma was set up in nude mice.Two weeks later,the mice were treated with Tuftsin for 2 weeks.Then the size and the weight of cholangiocarcinoma and the pathological changes of liver and spleen were observed in nude mice.Results:The purity of synthesized Tuftsin was more than 99.9% .The size and weight of cholangiocarcinoma in Tuftsin-treated group were significantly different from those in the control.The mononuclear phagocytes of the liver and spleen in the Tuftsin-treated group proliferated actively.Conclusion:It is easy to synthesize Tuftsin with high purity.Meanwhile,Tuftsin can significantly inhibit the growth of cholangiocarcinoma.
, 百拇医药
Key words Tuftsin; cholangiocarcinoma
Tuftsin是一个主要在脾脏产生的4个氨基酸的多肽,具有抗感染、抗癌等广泛的生物学活性。Tuftsin在体情况下抗肿瘤虽已有肝癌、胃癌及黑色素瘤等的报道[1~5],但Tuftsin在体情况下抗胆管癌还未见文献报道。本研究拟在国内首先成功合成Tuftsin的情况下,然后建立裸鼠胆管癌模型,探讨Tuftsin在体情况下抗胆管癌的情况。
1 材料与方法
1.1 Tuftsin的化学合成
Tuftsin的合成是在ABI431A自动肽上进行。采用Fmoc方案,起始采用12.5μmol树脂酸(美国ABI公司),按照Thr-Lys-Pro-Arg的序列使肽链从C端逐个向N端延伸。各种氨基酸的保护基团是:各氨基酸的α-氨基为Fmoc保护,其它侧链保护基团为Thy(TrT),Lys(Boc),Arg(PMC)。每步缩合都加入HoBt/Dcc保护氨基Tuftsin的合成,缩合后用含有20%六氢吡啶的NMR溶液去除Fmoc保护基。肽链合成后,按照ABI公司推荐的步骤,将含树脂的肽链加入处于冰浴条件下的混合反应液中,反应液的成分为结晶苯酚0.75ml,酒石酸乙二胺(EDT)0.25ml,苯硫基甲烷(Thionaisole)0.5ml,去离子水0.5ml,三氟乙酸10ml。在室温条件下持续搅拌,Tuftsin的反应时间为4.5h,使肽链从树脂上裂解下来,同时去除多种保护基。将混合液经受4G的玻璃滤器过滤以滤掉切下的树脂及保护基团,并用三氟乙酸冲洗反应瓶和滤器,将滤液在常温下低压蒸发至1~2ml,加乙醚50ml使多肽沉淀后,经6G玻璃滤器过滤后,冷冻干燥,所得便是多肽成品。
, 百拇医药
1.2 Tuftsin的鉴定
将Tuftsin少量产品用去离子水溶解后,用0.2μm纤维滤膜过滤后,用BioFocus-3000型毛细管电泳仪采用区带电泳法进行分析,毛细管采用孔径25cm,长度46cm,缓冲液采用pH2.8磷酸盐缓冲液,电泳方向从正极向负极移动,恒定电压10kV。
1.3 细胞系及培养
QBC-939胆管癌细胞系(由本院肝胆外科中心王曙光教授在国内首次分离建株)。胆管癌细胞复苏后,用10%FCS加DMEM培养基增殖、传代培养。
1.4 裸鼠胆管癌模型的建立
把胆管癌细胞大量传代培养,用0.5%的胰蛋白酶充分消化掉贴壁的胆管癌经用不含血清的DMEM培养液把癌细胞调成1×107/ml,取15只BALB/C裸鼠,雌雄不拘,体重18~22g,4~6周龄。每只裸鼠腹侧皮下注射0.1ml调配好的癌细胞溶液。1周后,15只裸鼠全部成活,且皮下均长出0.25~0.45cm直径的肿瘤,2周后开始治疗。
, 百拇医药
1.5 Tuftsin的治疗
把15只胆管癌裸鼠随机分成两组,一组为Tuftsin治疗组,共8只裸鼠,经腹腔注射用生理盐水配制的Tuftsin溶液,浓度为50μg/ml,每只裸鼠注射0.5ml(25μg)/次,隔2d1次,共治疗4周;另一组为对照组共7只,每只隔2d注射0.5ml/次生理盐水。治疗期间,每隔2d用游标卡尺测量肿瘤大小,计算方法:肿瘤大小(cm)=(长径±宽径)/2。4周后,肿瘤切下称重(g)。并取肿瘤组织及肝脏、脾脏等组织作病理切片。治疗过程中,Tuftsin组有4例,对照组有2例肿瘤局部出现坏死。
2 结果
2.1 合成Tuftsin的鉴定
合成Tuftsin的毛细管电泳图见图1,经积分运算,主峰面积占所有面积的99.9%以上。因此,Tuftsin的合成效率为99.9%。可以算出它的每次残基平均偶联效率为99.9%。
, 百拇医药
图1 合成Tuftsin的毛细管电泳图
Fig1 Capillary electrophoresis diagram of
synthesized Tuftsin
2.2 Tuftsin治疗后胆管癌肿瘤大小及重量变化
从表1中可见,Tuftsin治疗4周后,Tuftsin治疗组的肿瘤大小、重量明显轻于对照组,效果较明显。
表1 Tuftsin治疗前后胆管癌肿瘤大小及重量的变化(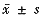 )
)
Tab1 The alteration of the weight and size in cholangiocacinoma after and before Tuftsin therapy(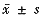 )
)
, 百拇医药
C1
T1
C2
T2
Volume(cm)
0.57±0.12
0.54±0.1*
1.52±0.32#
2.28±0.41
weight(g)
1.38±0.29#
, 百拇医药
2.12±0.39
*:P<0.05 vs C1; #:P<0.05 vs C2;C1: Control group;
T1 :Pre-therapy(Tuftsin)group;T2 :Post-therapy(Tuftsin)group;
C2 :Post-theraoy control group(4 weeks later)
图2说明Tuftsin治疗2周前,两组间肿瘤大小差别不明显,治疗2周后,两组间肿瘤大小开始出现较明显差别,3周、4周后差别加大。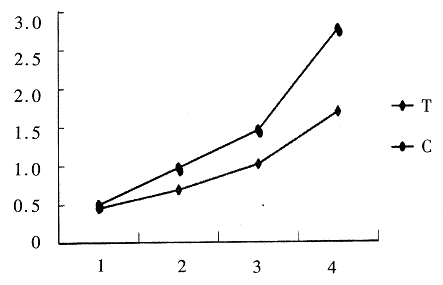
, 百拇医药
图2 治疗后肿瘤大小的动态变化
Fig2 The dynamic change of cholangiocarinoma
after Tuftsin therapy
2.3 Tuftsin治疗后裸鼠胆管癌组织、肝、脾等组织的病理变化
肿瘤组织呈典型的肿瘤细胞增生表现,可见肿瘤结节和片状、灶状坏死区,坏死区周围与肿瘤交界处有炎细胞浸润带。瘤细胞呈柱状或立方状,大小不一,胞浆比较少,部分细胞可见分泌空胞,胞核呈卵圆形,染色较深,可见核分裂象,瘤细胞排列呈巢状、实团状或条巢状。
Tuftsin治疗组肝脏,肝窦内可见内皮细胞和枯否氏细胞增生,少量散在淋巴细胞浸润。
Tuftsin治疗组脾脏,脾小体增多,生发中心生长活跃,脾窦内可见较多的多核巨细胞和巨核细胞。
, 百拇医药
这些病理现象可以粗略说明Tuftsin可以激活并调动机体的吞噬细胞系统和淋巴细胞系统的功能。
3 讨论
Tuftsin的合成方法主要有固相合成法和液相合成法[6~9]。Tuftsin尽管只是一种4个氨基酸的小肽,但是由于这4个氨基酸的侧链游离基团比较多,如苏氨酸、赖氨酸、脯氨酸都有3个功能基因。苏氨酸除有氨基和羧基外,还有1个羟基;赖氨酸除有1个氨基外,还有1个α,ζ-氨基己酸;脯氨酸有1个羧基和1个α位的亚氨基;精氨酸除有1个氨基外,还有1个胍基,这些游离基团的保护相当麻烦,而且精氨酸化学合成的角度来看,也是一个长期困扰人们并且麻烦比较多的氨基酸。如采取液相合成法,由于没有树脂酸等支持剂,其氨基酸的联结比较困难并且纯度不够高,但产量较高。采取固相合成法,虽然有树脂等支持剂,氨基酸联结很方便而且合成Tuftsin可以达到很高的纯度,但成本较高且产量较低。由于购买脯氨酸和精氨酸的基团保护剂来保护它们的侧链基团成本也较高,故本实验采取美国ABI公司保护好侧链基因的苏氨酸、赖氨酸、脯氨酸、精氨酸等氨基酸来合成Tuftsin。
, 百拇医药
本实验的结果表明,合成Tuftsin的纯度高达99.9%,而且由于是在多肽合成仪上进行,方法简便、快捷,但成本较高产量较低,比较适合于需求量较少的实验研究,不适于大量生产。近年来国外合成Tuftsin也多采取固相合成法。
胆管癌是一种较常见的消化道肿瘤,近年来发病率在我国有逐年增高的趋势,目前胆管癌的诊断、治疗及预测预后难度均较大。现在临床上主要采取手术治疗或化疗。但因为胆管癌的早期诊断难度很大,临床一经发现,则手术切除率较低,且切除后复发率较高,5年生存率较低。临床所采用的化疗,因为化疗药物的毒副作用较大,故疗效也不显著。近年来虽说用免疫疗法治疗肿瘤的报道较多,但胆管癌免疫治疗的报道还比较少[10,11]。
1979年Nishioka指出Tuftsin可能可以作为一个免疫治疗剂来治疗肿瘤。自此,大量的动物实验和一部分临床研究表明Tuftsin对肝癌、胃癌、肺癌等多种肿瘤的治疗均有较明显效果。但有关Tuftsin对胆管癌的治疗机制,使用剂量、方法及其效果,文献均未见报道。
, http://www.100md.com
本部分实验结果表明,Tuftsin治疗裸鼠胆管癌模型,每隔2d给药1次,每次2.5μg/只,2周后,开始出现较明显效果,4周后效果明显。本实验还观察到一只Tuftsin治疗组裸鼠肿瘤局部出现坏死后,继续用Tuftsin治疗,7d后肿瘤逐渐消失,但停药1周后,肿瘤又复发。这表明Tuftsin对胆管癌有较明显的治疗效果,但需间隔多次给药后方有效果,这与其它文献报道的规律相一致。
据文献[12]报道,Tuftsin抗肿瘤的机制主要是它既能促进粒细胞和单核巨噬细胞系统的游走、释放和细胞毒功能外,又能增加白细胞的数目并对淋巴细胞有作用。本研究的观察表明,裸鼠胆管癌模型使用Tuftsin后,肿瘤如肝、脾等组织出现明显的吞噬细胞和淋巴细胞浸润,表明Tuftsin可以调动巨噬细胞和淋巴细胞系统来杀伤肿瘤细胞。
作者简介:雷新(1963.8),男,吉林省松源市人,博士,主治医师,讲师,主要从事脾脏外科及脾脏因子Tuftsin抗癌作用方面的研究,发表论文8篇。电话:(023)68757449
, http://www.100md.com
参考文献
[1]Nishioka K,Amoscato A A,Babcock G F,et al.Tuftsin:an immunomodulating peptide hormone and its clinical potential as a natural biological response modifier[J].Cancer Invest,1984,2 (1):39-49.
[2]Nishioka K,Andrew A,Amoscato A A,et al.Tuftsin:a hormone-like tetrapeptide with antimicrolbia and antitumor activities[J].Life Science,1981,28(10):1081-1091.
[3]Fridkin M,and Najjar V A.Tuftsin:its chemistry,biology,and clinical potential[J].Crit Rev Biochem Mol Biol,1989,24(1):1-40.
, 百拇医药
[4]刘政溶,杨永康,李光华,等.脾脏及tuftsin在亚硝酸盐诱发胃癌过程在的作用[J].蚌埠医学院学报,1994,19(1):51-54.
[5]顾琴龙,杨永康,章仁道,等.Tuftsin对荷肝癌小鼠免疫功能的影响[J].蚌埠医学院学报,1992,17(3):199-202.
[6]Nishioka k,Satoh P S,Clnstatopoulos A.The chemical synthesis of the phagocytosis-stimulating tetrapeptide tuftsin(Thr-Lys-Pro-Arg) and its biological properties[J].Bichimica et Biophysica Acta,1973,310(1):230-237.
[7]Clnstatopoulos A,N ajjar V A.Tuftsin deficiency:a new syndrome with defective phagocytosis[J].The Journal of Pediatrics,1972,80:564-572.
, http://www.100md.com
[8]Yajima H,Ogawa H,Watanabe.Studies on peptides.XLVⅢ.Application of the trifouorometlianesulphonic acid procedure to the synthesis of tuftsin[J].Chem Pharm Bull,1975,23(2):371-374.
[9]Fridkin M,Stabinsky Y,Zakuth V.Tuftsin and some analogs:Synthesis and interaction with human polymorphonuclear leukocytes[J].Biochemica et Biophysica Acta,1977,496(1):203-211.
[10]Pichlmayr R,Weimann A,Klempnauer J,et al.Surgical treatment in proximal bile duct cancer.a single-center experience[J].Ann Surg,1996,224(5):628-638.
[11]钱信忠.临床医学[M].上海:上海科学技术出版社,1997.1258-1259.
[12]顾琴龙,杨永康.Tuftsin抗肿瘤作用及其机理研究[J].中华实验外科杂志,1994,11(6):345-346.
收稿日期:1999-02-17
修回日期:1999-11-26, 百拇医药
单位:雷新(第三军医大学附属西南医院肝胆外科中心,重庆 400038);韩本立(第三军医大学附属西南医院肝胆外科中心,重庆 400038)
关键词:Tuftsin;胆管癌
第三军医大学学报000122
提要 目的:用多肽合成仪固相合成Tuftsin后,研究在体情况下Tuftsin抗胆管癌的作用。方法:用毛细管电泳仪检测合成Tuftsin的纯度。建立胆管癌裸鼠模型后,用Tuftsin治疗4周,观察治疗前后的肿瘤大小与重量和肝、脾及肿瘤组织的病理变化。结果:合成Tuftsin纯度在99.9%以上;Tuftsin治疗组和对照组肿瘤大小及重量差异明显,治疗组肝、脾组织内的单核吞噬细胞增生活跃。结论:多肽合成仪固相法合成Tuftsin方法简单,纯度高,Tuftsin可明显抑制裸鼠胆管癌组织的生长。
, 百拇医药
中图法分类号 R341.6;R735.8 文献标识码 A
文章编号:1000-5404(2000)01-0075-03
Chemical synthesis of Tuftsin and its effects on cholangiocarcinoma in nude mice
LEI Xin,HAN Ben-li
(Department of Hepatobiliary Surgery,Southwest Hospital,Third Military Medical University,Chongqing 400038)
Abstract Objective:To investigate the effects of Tuftsin on cholangiocarcinoma in vivo after it was chemically synthesized.Methods:The purity of Tuftsin was analyzed with capillary electrophoresis.The model of cholangiocarcinoma was set up in nude mice.Two weeks later,the mice were treated with Tuftsin for 2 weeks.Then the size and the weight of cholangiocarcinoma and the pathological changes of liver and spleen were observed in nude mice.Results:The purity of synthesized Tuftsin was more than 99.9% .The size and weight of cholangiocarcinoma in Tuftsin-treated group were significantly different from those in the control.The mononuclear phagocytes of the liver and spleen in the Tuftsin-treated group proliferated actively.Conclusion:It is easy to synthesize Tuftsin with high purity.Meanwhile,Tuftsin can significantly inhibit the growth of cholangiocarcinoma.
, 百拇医药
Key words Tuftsin; cholangiocarcinoma
Tuftsin是一个主要在脾脏产生的4个氨基酸的多肽,具有抗感染、抗癌等广泛的生物学活性。Tuftsin在体情况下抗肿瘤虽已有肝癌、胃癌及黑色素瘤等的报道[1~5],但Tuftsin在体情况下抗胆管癌还未见文献报道。本研究拟在国内首先成功合成Tuftsin的情况下,然后建立裸鼠胆管癌模型,探讨Tuftsin在体情况下抗胆管癌的情况。
1 材料与方法
1.1 Tuftsin的化学合成
Tuftsin的合成是在ABI431A自动肽上进行。采用Fmoc方案,起始采用12.5μmol树脂酸(美国ABI公司),按照Thr-Lys-Pro-Arg的序列使肽链从C端逐个向N端延伸。各种氨基酸的保护基团是:各氨基酸的α-氨基为Fmoc保护,其它侧链保护基团为Thy(TrT),Lys(Boc),Arg(PMC)。每步缩合都加入HoBt/Dcc保护氨基Tuftsin的合成,缩合后用含有20%六氢吡啶的NMR溶液去除Fmoc保护基。肽链合成后,按照ABI公司推荐的步骤,将含树脂的肽链加入处于冰浴条件下的混合反应液中,反应液的成分为结晶苯酚0.75ml,酒石酸乙二胺(EDT)0.25ml,苯硫基甲烷(Thionaisole)0.5ml,去离子水0.5ml,三氟乙酸10ml。在室温条件下持续搅拌,Tuftsin的反应时间为4.5h,使肽链从树脂上裂解下来,同时去除多种保护基。将混合液经受4G的玻璃滤器过滤以滤掉切下的树脂及保护基团,并用三氟乙酸冲洗反应瓶和滤器,将滤液在常温下低压蒸发至1~2ml,加乙醚50ml使多肽沉淀后,经6G玻璃滤器过滤后,冷冻干燥,所得便是多肽成品。
, 百拇医药
1.2 Tuftsin的鉴定
将Tuftsin少量产品用去离子水溶解后,用0.2μm纤维滤膜过滤后,用BioFocus-3000型毛细管电泳仪采用区带电泳法进行分析,毛细管采用孔径25cm,长度46cm,缓冲液采用pH2.8磷酸盐缓冲液,电泳方向从正极向负极移动,恒定电压10kV。
1.3 细胞系及培养
QBC-939胆管癌细胞系(由本院肝胆外科中心王曙光教授在国内首次分离建株)。胆管癌细胞复苏后,用10%FCS加DMEM培养基增殖、传代培养。
1.4 裸鼠胆管癌模型的建立
把胆管癌细胞大量传代培养,用0.5%的胰蛋白酶充分消化掉贴壁的胆管癌经用不含血清的DMEM培养液把癌细胞调成1×107/ml,取15只BALB/C裸鼠,雌雄不拘,体重18~22g,4~6周龄。每只裸鼠腹侧皮下注射0.1ml调配好的癌细胞溶液。1周后,15只裸鼠全部成活,且皮下均长出0.25~0.45cm直径的肿瘤,2周后开始治疗。
, 百拇医药
1.5 Tuftsin的治疗
把15只胆管癌裸鼠随机分成两组,一组为Tuftsin治疗组,共8只裸鼠,经腹腔注射用生理盐水配制的Tuftsin溶液,浓度为50μg/ml,每只裸鼠注射0.5ml(25μg)/次,隔2d1次,共治疗4周;另一组为对照组共7只,每只隔2d注射0.5ml/次生理盐水。治疗期间,每隔2d用游标卡尺测量肿瘤大小,计算方法:肿瘤大小(cm)=(长径±宽径)/2。4周后,肿瘤切下称重(g)。并取肿瘤组织及肝脏、脾脏等组织作病理切片。治疗过程中,Tuftsin组有4例,对照组有2例肿瘤局部出现坏死。
2 结果
2.1 合成Tuftsin的鉴定
合成Tuftsin的毛细管电泳图见图1,经积分运算,主峰面积占所有面积的99.9%以上。因此,Tuftsin的合成效率为99.9%。可以算出它的每次残基平均偶联效率为99.9%。

, 百拇医药
图1 合成Tuftsin的毛细管电泳图
Fig1 Capillary electrophoresis diagram of
synthesized Tuftsin
2.2 Tuftsin治疗后胆管癌肿瘤大小及重量变化
从表1中可见,Tuftsin治疗4周后,Tuftsin治疗组的肿瘤大小、重量明显轻于对照组,效果较明显。
表1 Tuftsin治疗前后胆管癌肿瘤大小及重量的变化(
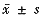 )
)Tab1 The alteration of the weight and size in cholangiocacinoma after and before Tuftsin therapy(
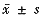 )
), 百拇医药
C1
T1
C2
T2
Volume(cm)
0.57±0.12
0.54±0.1*
1.52±0.32#
2.28±0.41
weight(g)
1.38±0.29#
, 百拇医药
2.12±0.39
*:P<0.05 vs C1; #:P<0.05 vs C2;C1: Control group;
T1 :Pre-therapy(Tuftsin)group;T2 :Post-therapy(Tuftsin)group;
C2 :Post-theraoy control group(4 weeks later)
图2说明Tuftsin治疗2周前,两组间肿瘤大小差别不明显,治疗2周后,两组间肿瘤大小开始出现较明显差别,3周、4周后差别加大。

, 百拇医药
图2 治疗后肿瘤大小的动态变化
Fig2 The dynamic change of cholangiocarinoma
after Tuftsin therapy
2.3 Tuftsin治疗后裸鼠胆管癌组织、肝、脾等组织的病理变化
肿瘤组织呈典型的肿瘤细胞增生表现,可见肿瘤结节和片状、灶状坏死区,坏死区周围与肿瘤交界处有炎细胞浸润带。瘤细胞呈柱状或立方状,大小不一,胞浆比较少,部分细胞可见分泌空胞,胞核呈卵圆形,染色较深,可见核分裂象,瘤细胞排列呈巢状、实团状或条巢状。
Tuftsin治疗组肝脏,肝窦内可见内皮细胞和枯否氏细胞增生,少量散在淋巴细胞浸润。
Tuftsin治疗组脾脏,脾小体增多,生发中心生长活跃,脾窦内可见较多的多核巨细胞和巨核细胞。
, 百拇医药
这些病理现象可以粗略说明Tuftsin可以激活并调动机体的吞噬细胞系统和淋巴细胞系统的功能。
3 讨论
Tuftsin的合成方法主要有固相合成法和液相合成法[6~9]。Tuftsin尽管只是一种4个氨基酸的小肽,但是由于这4个氨基酸的侧链游离基团比较多,如苏氨酸、赖氨酸、脯氨酸都有3个功能基因。苏氨酸除有氨基和羧基外,还有1个羟基;赖氨酸除有1个氨基外,还有1个α,ζ-氨基己酸;脯氨酸有1个羧基和1个α位的亚氨基;精氨酸除有1个氨基外,还有1个胍基,这些游离基团的保护相当麻烦,而且精氨酸化学合成的角度来看,也是一个长期困扰人们并且麻烦比较多的氨基酸。如采取液相合成法,由于没有树脂酸等支持剂,其氨基酸的联结比较困难并且纯度不够高,但产量较高。采取固相合成法,虽然有树脂等支持剂,氨基酸联结很方便而且合成Tuftsin可以达到很高的纯度,但成本较高且产量较低。由于购买脯氨酸和精氨酸的基团保护剂来保护它们的侧链基团成本也较高,故本实验采取美国ABI公司保护好侧链基因的苏氨酸、赖氨酸、脯氨酸、精氨酸等氨基酸来合成Tuftsin。
, 百拇医药
本实验的结果表明,合成Tuftsin的纯度高达99.9%,而且由于是在多肽合成仪上进行,方法简便、快捷,但成本较高产量较低,比较适合于需求量较少的实验研究,不适于大量生产。近年来国外合成Tuftsin也多采取固相合成法。
胆管癌是一种较常见的消化道肿瘤,近年来发病率在我国有逐年增高的趋势,目前胆管癌的诊断、治疗及预测预后难度均较大。现在临床上主要采取手术治疗或化疗。但因为胆管癌的早期诊断难度很大,临床一经发现,则手术切除率较低,且切除后复发率较高,5年生存率较低。临床所采用的化疗,因为化疗药物的毒副作用较大,故疗效也不显著。近年来虽说用免疫疗法治疗肿瘤的报道较多,但胆管癌免疫治疗的报道还比较少[10,11]。
1979年Nishioka指出Tuftsin可能可以作为一个免疫治疗剂来治疗肿瘤。自此,大量的动物实验和一部分临床研究表明Tuftsin对肝癌、胃癌、肺癌等多种肿瘤的治疗均有较明显效果。但有关Tuftsin对胆管癌的治疗机制,使用剂量、方法及其效果,文献均未见报道。
, http://www.100md.com
本部分实验结果表明,Tuftsin治疗裸鼠胆管癌模型,每隔2d给药1次,每次2.5μg/只,2周后,开始出现较明显效果,4周后效果明显。本实验还观察到一只Tuftsin治疗组裸鼠肿瘤局部出现坏死后,继续用Tuftsin治疗,7d后肿瘤逐渐消失,但停药1周后,肿瘤又复发。这表明Tuftsin对胆管癌有较明显的治疗效果,但需间隔多次给药后方有效果,这与其它文献报道的规律相一致。
据文献[12]报道,Tuftsin抗肿瘤的机制主要是它既能促进粒细胞和单核巨噬细胞系统的游走、释放和细胞毒功能外,又能增加白细胞的数目并对淋巴细胞有作用。本研究的观察表明,裸鼠胆管癌模型使用Tuftsin后,肿瘤如肝、脾等组织出现明显的吞噬细胞和淋巴细胞浸润,表明Tuftsin可以调动巨噬细胞和淋巴细胞系统来杀伤肿瘤细胞。
作者简介:雷新(1963.8),男,吉林省松源市人,博士,主治医师,讲师,主要从事脾脏外科及脾脏因子Tuftsin抗癌作用方面的研究,发表论文8篇。电话:(023)68757449
, http://www.100md.com
参考文献
[1]Nishioka K,Amoscato A A,Babcock G F,et al.Tuftsin:an immunomodulating peptide hormone and its clinical potential as a natural biological response modifier[J].Cancer Invest,1984,2 (1):39-49.
[2]Nishioka K,Andrew A,Amoscato A A,et al.Tuftsin:a hormone-like tetrapeptide with antimicrolbia and antitumor activities[J].Life Science,1981,28(10):1081-1091.
[3]Fridkin M,and Najjar V A.Tuftsin:its chemistry,biology,and clinical potential[J].Crit Rev Biochem Mol Biol,1989,24(1):1-40.
, 百拇医药
[4]刘政溶,杨永康,李光华,等.脾脏及tuftsin在亚硝酸盐诱发胃癌过程在的作用[J].蚌埠医学院学报,1994,19(1):51-54.
[5]顾琴龙,杨永康,章仁道,等.Tuftsin对荷肝癌小鼠免疫功能的影响[J].蚌埠医学院学报,1992,17(3):199-202.
[6]Nishioka k,Satoh P S,Clnstatopoulos A.The chemical synthesis of the phagocytosis-stimulating tetrapeptide tuftsin(Thr-Lys-Pro-Arg) and its biological properties[J].Bichimica et Biophysica Acta,1973,310(1):230-237.
[7]Clnstatopoulos A,N ajjar V A.Tuftsin deficiency:a new syndrome with defective phagocytosis[J].The Journal of Pediatrics,1972,80:564-572.
, http://www.100md.com
[8]Yajima H,Ogawa H,Watanabe.Studies on peptides.XLVⅢ.Application of the trifouorometlianesulphonic acid procedure to the synthesis of tuftsin[J].Chem Pharm Bull,1975,23(2):371-374.
[9]Fridkin M,Stabinsky Y,Zakuth V.Tuftsin and some analogs:Synthesis and interaction with human polymorphonuclear leukocytes[J].Biochemica et Biophysica Acta,1977,496(1):203-211.
[10]Pichlmayr R,Weimann A,Klempnauer J,et al.Surgical treatment in proximal bile duct cancer.a single-center experience[J].Ann Surg,1996,224(5):628-638.
[11]钱信忠.临床医学[M].上海:上海科学技术出版社,1997.1258-1259.
[12]顾琴龙,杨永康.Tuftsin抗肿瘤作用及其机理研究[J].中华实验外科杂志,1994,11(6):345-346.
收稿日期:1999-02-17
修回日期:1999-11-26, 百拇医药