一氧化氮在兴奋毒损伤尾核所致记忆损害中的作用
作者:李从德 陈纪君 张世仪
单位:李从德:湖北三峡学院医学院生理学教研室(宜昌 443003);陈纪君 张世仪:中国医学科学院基础医学研究所
关键词:一氧化氮;海人酸;一氧化氮合酶抑制剂
家用医学进修杂志990206
摘 要 为探明NO在兴奋毒性神经元损伤中作用。以海人酸(KA)损伤尾核致学习记忆缺陷的动物模型中观察到兴奋毒损伤后,一氧化氮合酶活性呈现一个时间变化过程,6~8h略有降低;第三天显著升高到47.75%(P<0.05);第五天仍轻度升高,但与对照组无差异。当早期多次应用L-硝基精氨酸甲酯,大鼠被动回避反应,电击后5min和24h,下台潜伏期明显延长;在学习过程中所犯错误明显减少,达标率增高。本实验结果表明过量生成NO介导了KA致尾核神经元的损伤作用并致学习记忆缺陷。早期多次应用NOS抑制剂能改善KA损伤尾核所致学习记忆缺陷。
, 百拇医药
Role of Nitric Oxide in Memory Impairment Induced
by Excitotoxic Injury of Caudate Nucleus
Li Congde Chen Jijun Zhang Shiyi
Hubei Three Gorge University Medical College ,Yichang 443003
Abstract The role of nitric oxide in caudate nucleus lesioned rats by injection of kainic acid is inverstigated.6~8h, after kainic acid injection nitric oxide synthase activity in caudate nucleus,was decreased(P>0.05 compared to controls);3 days was elevated to 47.75% (P<0.05 compared to controls);5 days was slightly elevated(P>0.05 compared to controls) .Chronic administration of L-nitro-argine methyl ester (10mg/(kg.d) ip) markedly improved the learning and memory impairment in the injured caudate nucleus rats.These results suggest that excess nitric oxide mediated kainic acid induced injury of caudate nucleus.
, 百拇医药
Key words nitric oxide ; kainic acid ; nitric oxide synthase inhibitor
一氧化氮(NO)是脑内一种新的信息分子,具有广泛的生理作用,但过量产生可致神经毒性[1]。在体和离体实验证明兴奋性氨基酸可致神经毒性,并可能在人类慢性神经原变性疾病中起重要作用,但其机制至今未明[2]。海人酸是一种兴奋性氨基酸受体的兴奋剂,它可由兴奋性氨基酸受体过度刺激而产生不可逆神经毒性[3]。焦敏等报道[4]海人酸损伤大鼠尾核后致学习记忆缺陷。为探讨NO在兴奋毒性神经原损伤及其所引起的学习记忆缺陷中的作用。我们用(KA)建立尾核损伤的动物模型。观察尾核损伤后,一氧化氮合酶(NOS)活性变化的时程并对其与学习记忆缺陷的关系进行初步探讨。
1 材料和方法
, 百拇医药 1.1 动物手术和术后处理
选用200±10g的雌性成年Wistar大鼠.用三溴乙醇麻醉后,置于江湾1型脑立体定位仪上,依图谱[5]在尾核前内侧注射(AP-2 LP±2.5 V4.5),假手术组(Sham)注入生理盐水0.5uL 实验组注入KA 0.3ug。在尾核注射后6~8 h.3天或5天快速断头分离出尾核和小脑,置于液氮中冻存。另一部分大鼠在尾核注射KA后第2天开始,分别于腹腔注射L-硝基精氨酸甲酯(L-NAME)10mg/kg (KL组)或生理盐水10ml/kg(KA组),连续5天。
1.2 NOS活性测定
参照文献[6.7]的方法进行测定。其原理为L-精氨酸+O2→NO+L-瓜氨酸,NO进一步氧化生成NO2-。取冻存的尾核和小脑按1:5(W/V)加入缓冲液(50Mm Hepes 0.32M Sucrose 1 mM DTT 1mM PMSF 1mM EDTA 0.1mM EGTA 1.5mM 2-ME 1uM Leupetin)匀浆,用Beckman公司产离心机4℃16000转/min离心1h。取上清液50ul与缓冲液50ul构成酶反应体系(50mM Hepes 0.5mM NADPH 1mM L-arginine 1mM CaCl2 0.1mM MgCl2 0.3uM BH4 1ug CaM)37℃ 避光温育80min加入5%磷酸1%对氨基苯磺酸100ul和0.1% N-乙萘基乙二胺100ul 4℃ 20 min用Biotek 产酶标仪测OD计算NO2量,用Pharmaic Biotek 产RNA/DNA calcutor测上清液蛋白浓度,以每毫克蛋白质在酶反应体系中1min 产生的NO2-量表示NOS 活性。
, 百拇医药
1.3 学习记忆行为试验
行为实验装置均为自制。在尾核注射十天后按本组已建立方法[8]进行自发活动及学习记忆行为测定。
被动回避反应(跳台法):电击参数0.25~0.30mA, 10s,记录电击后5min和24h大鼠的下台潜伏期,作为短时和长时记忆水平指标。
主动回避反应:以短声信号5s作为条件信号,然后结合脚掌电击训练动物在短声信号期内跳上平台回避电击。以学习过程中所犯的错误次数及达标动物占该组动物的百分比(PCRA)作为学习能力的指标。
1.4 药品和试剂
L-Arginine(Gibco).NADPH.BH4.Calmodulin.Leupetin.PMSF.KA和L-NAME购自Sigma公司.DTT(Sangon).2-mercaptoethanol((2-Me)Fat Co).Hepes(宝灵曼)。其余为国产分析纯试剂。
, 百拇医药
1.5 数据处理
用t检验和Mann-Whitney U检验
2 结果
2.1 尾核KA损伤后NOS活性变化
NOS活性在大鼠尾核损伤后6~8h略有降低,第三天显著升高到47.75%(P<0.05),第五天仍有轻度升高,但与假手术组相比无显著差异;小脑中NOS活性无明显变化。见表1。
表1 大鼠尾核损伤后NOS活性变化(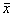 ±s) 组别
±s) 组别
n
尾核
, 百拇医药 小脑
假手术组
6~8h
3天
5天
8
6
7
6
29.51±2.75
28.77±2.75
43.60±4.91
32.30±5.93
, 百拇医药
36.76±0.83
30.77±3.48
33.70±1.33
33.10±2.45
P<0.05同假手术组比
2.2 NOS抑制剂对尾核损伤大鼠学习记忆的影响
2.2.1 自发活动测定: 本实验剂量的 KA注入尾核后对大鼠自发活动无明显影响,NOS合酶抑制剂也不改变大鼠自发活动水平。
2.2.2 被动回避反应测定: 电击后5min和24h KA组下台潜伏期明显短于Sham组(P<0.01 P<0.01);KL组则比KA组明显延长(P<0.01,P<0.01),但与Sham组相比存在显著差别(P<0.05,P<0.05)。
, 百拇医药
表2 NOS抑制剂对尾核损伤大鼠被动回避反应下台潜伏期的影响 组别
n
下 台 潜 伏 期
电击前
电击后5min
电击后24h
假手术组
KA
KL
10
8
10
, http://www.100md.com 1(1~1)
1(1~1)
1(1~1)
56(38~77)
10(7~16)
39(36~42)
57(38~130)
2(1~2.5)
29(20~40)
中位数(四分位间距),Mann-Whitney U-检验,P<0.01同假手术组比,P<0.01同KA组比
2.2.3 主动回避反应测定: 在学习过程中,KA组动物所犯错误明显多于Sham组(P<0.01),KL组所犯错误小于KA组KA组PCRA值明显低于Sham组KL组则显著高于KA组。
, 百拇医药
表3 NOS抑制剂对尾核损伤大鼠主动回避反应学习能力的影响
组别
n
达标时平均次数
学 习 能 力
错误次数(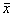 ±s)
±s)
达标动物比(%)
假手术组
KA
KL
10
, 百拇医药
8
10
21.5±1.25
28±1.66▲
8.9±0.60
27.5±1.38
14.7±1.32
100
0
100
P<0.01同假手术组比,P<0.01同KA组比,▲P<0.05同假手术组比
3 讨论
, 百拇医药
Koh等[9]报道培养的皮层NOS神经元比其它神经元易致KA损伤;De-lian等[10]用免疫组化的方法观察到皮层微量(0.5ug)注射KA后,病变中心NADPH-d快速丧失,末梢变性。2~3天内皮细胞和胶质细胞NADPH-d活性增加,5~7天最明显;现在我们用化学测定的方法,也观察到尾核微量注射KA后,NOS活性呈现一个时间变化的 过程。与Schmidt等[11]报道的Quinoliic 20ug/2.0ul单侧纹状体注射所引起的NOS活性变化基本一致。只不过NOS活性变化的峰值呈现时间不同,我们的结果是第三天最高,而他们报道的出现时间是在第五天,这可能与药物和注射部位有关。
KA是兴奋性氨基酸受体的兴奋剂,作用于非NMDA受体,引起神经元持续去极化,干扰神经元调节机制,导致离子.渗透压和电化学改变[12]。离子通道的改变可能致Ca2+通透性增加;也可能[13]通过作用于突触前非NMDA受体,导致谷氨酸释放增加,使突触后Ca2+通透性增加,这两者都可能使细胞内Ca2+浓度增加,导致Ca2+依赖性NOS活性增加。NOS是催化L-精氨酸与氧产生反应,生成NO的关键酶,其活性升高,必然使NO生成增加。后者与O2-形成过氧亚硝酸根离子(ONOO-),后者有较强细胞毒性[14]。NO和ONOO-能损害DNA和抑制线粒体功能。丧失损伤的DNA可激活多聚ADP-核糖合成酶(PARS)。PARS每转移一个ADP-核糖单位到核蛋白需消耗一分子NAD。而再生一分子NAD需消耗4分子ATP,这样将导致NAD和ATP的消耗,能量耗竭和细胞死亡。
, 百拇医药
L-NAME为NOS非选择性抑制剂,小剂量可抑制NO的产生,但其高浓度可抑制基础血管张力而没有神经保护作用[15]。当早期多次小剂量应用NOS抑制剂L-NAME减少NO 产生可减轻KA的兴奋毒性作用使大鼠学习记忆有所恢复。
参考文献
1 Szabo Csaba. Physiological and pathophysiological roles of nitric oxide in the central. Nervous system. Brain Research Bull 1996;41:131
2 Lipton S A, Rosebery P A. Excitatory amino acids as a final common pathways for neurologic disorders.N Engl J Med 1994;330(9):613
, 百拇医药
3 Hori N,French, Fnullen TM, Carpenter P O. Kainic acid binding sites in rat CNS as determing by autoradiography. Brain Res 1985;358(1):380
4 谯敏,张世仪。 7643-3对脑损伤所致认知障碍的改善作用及作用机理。中国医科院学报 1997;19(5):325
5 周衍椒,赵轶千。 生理学方法与技术。第一集,北京:科学出版社 1984:389~436
6 Bredt DS,Snyder SH. Nitro oxide mediates glutamate-linked enhancement of cGMP levels in the cerebrellum. Proc Natl Acad Sci USA 1989,86:9030
, http://www.100md.com
7 王成彬,田亚平,沈文梅,等。 大鼠脑组织中一氧化氮合酶测定。 生物化学与生物物理学进展 1996;23(6):548
8 Zhang shiyi,HeLiming,Fu Jianjun, et al. Beneficial effect of an ACTH-(4-9) analog(Org2766) in the treatment of experimental cortex lesion in rats.Chin Med Sci J 1994;9:12
9 Koh JY, Chao DW. Quantitative vulnerability of cultured cortical neurons to damage by excitotoxin: differential susceptibility of neurons containing NADPH diaphorase, J.neurosci 1988;8:2153
, http://www.100md.com
10 De-Lian Lei,Dong Liang Yang ,et al. Local injection of kaininc acid causes wide spread degeneration of NADPH-d in neuronsand induction of NADPH-d in neurons,endothelial cells and reactive astrocytes.Brain res 1995;730:199
11 Schmidt W,Wolf G,Calka J,et al. Evidence for bidirectional changes in nitric oxide synthase activity in the rat striatum after excitotoxically(quinolinie acid) induced degeneration .Neuroscience 1995;67(2):345
, http://www.100md.com
12 Coyle JT. Neurotoxic action of Kainic acid. J Neurochem 1983;41(1):1
13 Hollmann M,Hartley M , Heinemann S.Ca2+ permeability of KA-AMPA gated glutamate receptor channels deped on subunit composition. Science 1991;;252:851
14 Dawson V.L,Dawson T M. Nitric oxide action in neurochemistry Neurochem Int 1996;29(2):97
15 Carreau A,Daval D,Poignet H, et al Neuroprotective efficacy of Nw-Nitro-L-argine after focal cerebral ischemia in the mouse and inhibiton of cortical nitric oxide synthase .Eur J Pharmacol 1994;256:241
(1998-12-10 收稿), 百拇医药
单位:李从德:湖北三峡学院医学院生理学教研室(宜昌 443003);陈纪君 张世仪:中国医学科学院基础医学研究所
关键词:一氧化氮;海人酸;一氧化氮合酶抑制剂
家用医学进修杂志990206
摘 要 为探明NO在兴奋毒性神经元损伤中作用。以海人酸(KA)损伤尾核致学习记忆缺陷的动物模型中观察到兴奋毒损伤后,一氧化氮合酶活性呈现一个时间变化过程,6~8h略有降低;第三天显著升高到47.75%(P<0.05);第五天仍轻度升高,但与对照组无差异。当早期多次应用L-硝基精氨酸甲酯,大鼠被动回避反应,电击后5min和24h,下台潜伏期明显延长;在学习过程中所犯错误明显减少,达标率增高。本实验结果表明过量生成NO介导了KA致尾核神经元的损伤作用并致学习记忆缺陷。早期多次应用NOS抑制剂能改善KA损伤尾核所致学习记忆缺陷。
, 百拇医药
Role of Nitric Oxide in Memory Impairment Induced
by Excitotoxic Injury of Caudate Nucleus
Li Congde Chen Jijun Zhang Shiyi
Hubei Three Gorge University Medical College ,Yichang 443003
Abstract The role of nitric oxide in caudate nucleus lesioned rats by injection of kainic acid is inverstigated.6~8h, after kainic acid injection nitric oxide synthase activity in caudate nucleus,was decreased(P>0.05 compared to controls);3 days was elevated to 47.75% (P<0.05 compared to controls);5 days was slightly elevated(P>0.05 compared to controls) .Chronic administration of L-nitro-argine methyl ester (10mg/(kg.d) ip) markedly improved the learning and memory impairment in the injured caudate nucleus rats.These results suggest that excess nitric oxide mediated kainic acid induced injury of caudate nucleus.
, 百拇医药
Key words nitric oxide ; kainic acid ; nitric oxide synthase inhibitor
一氧化氮(NO)是脑内一种新的信息分子,具有广泛的生理作用,但过量产生可致神经毒性[1]。在体和离体实验证明兴奋性氨基酸可致神经毒性,并可能在人类慢性神经原变性疾病中起重要作用,但其机制至今未明[2]。海人酸是一种兴奋性氨基酸受体的兴奋剂,它可由兴奋性氨基酸受体过度刺激而产生不可逆神经毒性[3]。焦敏等报道[4]海人酸损伤大鼠尾核后致学习记忆缺陷。为探讨NO在兴奋毒性神经原损伤及其所引起的学习记忆缺陷中的作用。我们用(KA)建立尾核损伤的动物模型。观察尾核损伤后,一氧化氮合酶(NOS)活性变化的时程并对其与学习记忆缺陷的关系进行初步探讨。
1 材料和方法
, 百拇医药 1.1 动物手术和术后处理
选用200±10g的雌性成年Wistar大鼠.用三溴乙醇麻醉后,置于江湾1型脑立体定位仪上,依图谱[5]在尾核前内侧注射(AP-2 LP±2.5 V4.5),假手术组(Sham)注入生理盐水0.5uL 实验组注入KA 0.3ug。在尾核注射后6~8 h.3天或5天快速断头分离出尾核和小脑,置于液氮中冻存。另一部分大鼠在尾核注射KA后第2天开始,分别于腹腔注射L-硝基精氨酸甲酯(L-NAME)10mg/kg (KL组)或生理盐水10ml/kg(KA组),连续5天。
1.2 NOS活性测定
参照文献[6.7]的方法进行测定。其原理为L-精氨酸+O2→NO+L-瓜氨酸,NO进一步氧化生成NO2-。取冻存的尾核和小脑按1:5(W/V)加入缓冲液(50Mm Hepes 0.32M Sucrose 1 mM DTT 1mM PMSF 1mM EDTA 0.1mM EGTA 1.5mM 2-ME 1uM Leupetin)匀浆,用Beckman公司产离心机4℃16000转/min离心1h。取上清液50ul与缓冲液50ul构成酶反应体系(50mM Hepes 0.5mM NADPH 1mM L-arginine 1mM CaCl2 0.1mM MgCl2 0.3uM BH4 1ug CaM)37℃ 避光温育80min加入5%磷酸1%对氨基苯磺酸100ul和0.1% N-乙萘基乙二胺100ul 4℃ 20 min用Biotek 产酶标仪测OD计算NO2量,用Pharmaic Biotek 产RNA/DNA calcutor测上清液蛋白浓度,以每毫克蛋白质在酶反应体系中1min 产生的NO2-量表示NOS 活性。
, 百拇医药
1.3 学习记忆行为试验
行为实验装置均为自制。在尾核注射十天后按本组已建立方法[8]进行自发活动及学习记忆行为测定。
被动回避反应(跳台法):电击参数0.25~0.30mA, 10s,记录电击后5min和24h大鼠的下台潜伏期,作为短时和长时记忆水平指标。
主动回避反应:以短声信号5s作为条件信号,然后结合脚掌电击训练动物在短声信号期内跳上平台回避电击。以学习过程中所犯的错误次数及达标动物占该组动物的百分比(PCRA)作为学习能力的指标。
1.4 药品和试剂
L-Arginine(Gibco).NADPH.BH4.Calmodulin.Leupetin.PMSF.KA和L-NAME购自Sigma公司.DTT(Sangon).2-mercaptoethanol((2-Me)Fat Co).Hepes(宝灵曼)。其余为国产分析纯试剂。
, 百拇医药
1.5 数据处理
用t检验和Mann-Whitney U检验
2 结果
2.1 尾核KA损伤后NOS活性变化
NOS活性在大鼠尾核损伤后6~8h略有降低,第三天显著升高到47.75%(P<0.05),第五天仍有轻度升高,但与假手术组相比无显著差异;小脑中NOS活性无明显变化。见表1。
表1 大鼠尾核损伤后NOS活性变化(
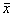 ±s) 组别
±s) 组别n
尾核
, 百拇医药 小脑
假手术组
6~8h
3天
5天
8
6
7
6
29.51±2.75
28.77±2.75
43.60±4.91
32.30±5.93
, 百拇医药
36.76±0.83
30.77±3.48
33.70±1.33
33.10±2.45
P<0.05同假手术组比
2.2 NOS抑制剂对尾核损伤大鼠学习记忆的影响
2.2.1 自发活动测定: 本实验剂量的 KA注入尾核后对大鼠自发活动无明显影响,NOS合酶抑制剂也不改变大鼠自发活动水平。
2.2.2 被动回避反应测定: 电击后5min和24h KA组下台潜伏期明显短于Sham组(P<0.01 P<0.01);KL组则比KA组明显延长(P<0.01,P<0.01),但与Sham组相比存在显著差别(P<0.05,P<0.05)。
, 百拇医药
表2 NOS抑制剂对尾核损伤大鼠被动回避反应下台潜伏期的影响 组别
n
下 台 潜 伏 期
电击前
电击后5min
电击后24h
假手术组
KA
KL
10
8
10
, http://www.100md.com 1(1~1)
1(1~1)
1(1~1)
56(38~77)
10(7~16)
39(36~42)
57(38~130)
2(1~2.5)
29(20~40)
中位数(四分位间距),Mann-Whitney U-检验,P<0.01同假手术组比,P<0.01同KA组比
2.2.3 主动回避反应测定: 在学习过程中,KA组动物所犯错误明显多于Sham组(P<0.01),KL组所犯错误小于KA组KA组PCRA值明显低于Sham组KL组则显著高于KA组。
, 百拇医药
表3 NOS抑制剂对尾核损伤大鼠主动回避反应学习能力的影响
组别
n
达标时平均次数
学 习 能 力
错误次数(
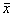 ±s)
±s)达标动物比(%)
假手术组
KA
KL
10
, 百拇医药
8
10
21.5±1.25
28±1.66▲
8.9±0.60
27.5±1.38
14.7±1.32
100
0
100
P<0.01同假手术组比,P<0.01同KA组比,▲P<0.05同假手术组比
3 讨论
, 百拇医药
Koh等[9]报道培养的皮层NOS神经元比其它神经元易致KA损伤;De-lian等[10]用免疫组化的方法观察到皮层微量(0.5ug)注射KA后,病变中心NADPH-d快速丧失,末梢变性。2~3天内皮细胞和胶质细胞NADPH-d活性增加,5~7天最明显;现在我们用化学测定的方法,也观察到尾核微量注射KA后,NOS活性呈现一个时间变化的 过程。与Schmidt等[11]报道的Quinoliic 20ug/2.0ul单侧纹状体注射所引起的NOS活性变化基本一致。只不过NOS活性变化的峰值呈现时间不同,我们的结果是第三天最高,而他们报道的出现时间是在第五天,这可能与药物和注射部位有关。
KA是兴奋性氨基酸受体的兴奋剂,作用于非NMDA受体,引起神经元持续去极化,干扰神经元调节机制,导致离子.渗透压和电化学改变[12]。离子通道的改变可能致Ca2+通透性增加;也可能[13]通过作用于突触前非NMDA受体,导致谷氨酸释放增加,使突触后Ca2+通透性增加,这两者都可能使细胞内Ca2+浓度增加,导致Ca2+依赖性NOS活性增加。NOS是催化L-精氨酸与氧产生反应,生成NO的关键酶,其活性升高,必然使NO生成增加。后者与O2-形成过氧亚硝酸根离子(ONOO-),后者有较强细胞毒性[14]。NO和ONOO-能损害DNA和抑制线粒体功能。丧失损伤的DNA可激活多聚ADP-核糖合成酶(PARS)。PARS每转移一个ADP-核糖单位到核蛋白需消耗一分子NAD。而再生一分子NAD需消耗4分子ATP,这样将导致NAD和ATP的消耗,能量耗竭和细胞死亡。
, 百拇医药
L-NAME为NOS非选择性抑制剂,小剂量可抑制NO的产生,但其高浓度可抑制基础血管张力而没有神经保护作用[15]。当早期多次小剂量应用NOS抑制剂L-NAME减少NO 产生可减轻KA的兴奋毒性作用使大鼠学习记忆有所恢复。
参考文献
1 Szabo Csaba. Physiological and pathophysiological roles of nitric oxide in the central. Nervous system. Brain Research Bull 1996;41:131
2 Lipton S A, Rosebery P A. Excitatory amino acids as a final common pathways for neurologic disorders.N Engl J Med 1994;330(9):613
, 百拇医药
3 Hori N,French, Fnullen TM, Carpenter P O. Kainic acid binding sites in rat CNS as determing by autoradiography. Brain Res 1985;358(1):380
4 谯敏,张世仪。 7643-3对脑损伤所致认知障碍的改善作用及作用机理。中国医科院学报 1997;19(5):325
5 周衍椒,赵轶千。 生理学方法与技术。第一集,北京:科学出版社 1984:389~436
6 Bredt DS,Snyder SH. Nitro oxide mediates glutamate-linked enhancement of cGMP levels in the cerebrellum. Proc Natl Acad Sci USA 1989,86:9030
, http://www.100md.com
7 王成彬,田亚平,沈文梅,等。 大鼠脑组织中一氧化氮合酶测定。 生物化学与生物物理学进展 1996;23(6):548
8 Zhang shiyi,HeLiming,Fu Jianjun, et al. Beneficial effect of an ACTH-(4-9) analog(Org2766) in the treatment of experimental cortex lesion in rats.Chin Med Sci J 1994;9:12
9 Koh JY, Chao DW. Quantitative vulnerability of cultured cortical neurons to damage by excitotoxin: differential susceptibility of neurons containing NADPH diaphorase, J.neurosci 1988;8:2153
, http://www.100md.com
10 De-Lian Lei,Dong Liang Yang ,et al. Local injection of kaininc acid causes wide spread degeneration of NADPH-d in neuronsand induction of NADPH-d in neurons,endothelial cells and reactive astrocytes.Brain res 1995;730:199
11 Schmidt W,Wolf G,Calka J,et al. Evidence for bidirectional changes in nitric oxide synthase activity in the rat striatum after excitotoxically(quinolinie acid) induced degeneration .Neuroscience 1995;67(2):345
, http://www.100md.com
12 Coyle JT. Neurotoxic action of Kainic acid. J Neurochem 1983;41(1):1
13 Hollmann M,Hartley M , Heinemann S.Ca2+ permeability of KA-AMPA gated glutamate receptor channels deped on subunit composition. Science 1991;;252:851
14 Dawson V.L,Dawson T M. Nitric oxide action in neurochemistry Neurochem Int 1996;29(2):97
15 Carreau A,Daval D,Poignet H, et al Neuroprotective efficacy of Nw-Nitro-L-argine after focal cerebral ischemia in the mouse and inhibiton of cortical nitric oxide synthase .Eur J Pharmacol 1994;256:241
(1998-12-10 收稿), 百拇医药