重组葡激酶突变体(r-SAKΔN)的纯化
作者:叶立文 任 军 宋后燕
单位:上海医科大学分子遗传研究室,上海 200032
关键词:葡激酶突变体;包涵体;复性;纯化
摘 要 重组葡激酶突变体基因在大肠杆菌中高效表达
摘 要 重组葡激酶突变体基因在大肠杆菌中高效表达,产物以包涵体的形式存在于胞浆中。通过发酵,扩增工程菌,机械破菌,离心分离粗制包涵体,后者经纯化后用盐酸胍溶解,r-SAKΔN分子复性后用离子交换层析和分子筛脱盐,纯度达97%,比活性5×104HU/mg,Mr14000,等电点为pH6.8。
Purificaion of Recombinant Staphylokinase Mutant(r-SAKΔN)
, 百拇医药
Ye Liwen, Ren Jun, Song Houyan
(Department of Molecular Genetics, Shanghai Medical University, Shanghai 200032)
Abstract Recombinant staphylokinase mutant (r-SAKΔN) was efficientl y ex pressed in E. coli in the form of inclusion body. By the methods of fermen tation, inclusion body extraction, refolding of r-SAKΔN molecular, Q-seph aros e FF ion-exchange chromatography and gel filtration of Sephadex G-25. The pur ity of r-SAKΔN was reached 97% and with specific activity 5×104 HU/mg. The Mr and isoelectro point were 14000 and pH6.8 respectively.
, 百拇医药
Key Words r-Staphylokinase mutant (r-SAKΔN), Inclusion body, Purification
葡激酶(Staphylokinase)是由某些感染溶原性噬菌体的金黄色葡萄球菌产生的外分泌蛋白,由136个氨基酸组成,Mr15500。葡激酶与纤溶酶原结合后转化为葡激酶纤溶酶复合物,具有激活纤溶酶原的能力。在体内有纤维蛋白存在时,葡激酶对人纤溶酶原的激活作用具有纤维蛋白特异性,因此葡激酶可望开发成新一代高效特异溶栓药物[1]。葡激酶分子量较小,是较为理想的研究蛋白质结构与功能的材料。按照结构与功能的关系设计突变体分子,通过蛋白质工程,开发出新的溶栓药物。Collen等对葡激酶分子中多个带电荷的相邻氨基酸突变为丙氨酸,并对各突变体与野生型葡激酶性能进行了比较,表明分子中部分氨基酸突变能改变葡激酶的性能。我们利用PCR技术以本研究室克隆的野生型葡激酶基因为模板[2]扩增N-末端缺失18个氨基酸的葡激酶突变体基因,在大肠杆菌中得到了高效表达,表达产物形成了包涵体[3]。本文报告了该突变体基因表达产物(r-SAKΔN)的提取、复性、纯化方法,以及该突变体的部分特性。
, 百拇医药
1 材料及设备
1.1 重组葡激酶缺失突变体(r-SAKΔN)高效表达菌株
为本室构建,含突变体基因,PR,PL启动子,Clts857阻抑蛋白基因,5sRNAt1t2终止信号调控。r-SAKΔN表达水平占菌体总蛋白的32%以上。
1.2 试剂
酪蛋白水解产物,等电聚焦标准pH蛋白,均购自Sigma公司。葡萄糖,无机盐,氨水,氨苄青霉素,盐酸硫胺素等均为符合药用标准的国产试剂。纤溶酶原和兔抗SAK抗体,由本室制备。辣根过氧化物酶标记的羊抗兔抗体和二氨基联苯胺购自华美公司。载体两性电解质(pH3.5~10)为上海丽珠东风生物技术有限公司产品。
, http://www.100md.com 1.3 仪器
发酵罐,美国NBS公司出品,BiofloⅢ 5L。Semi-dry transfer cell,蛋白纯化Econo系 统,购自美国Bio-Rad公司。
Image Master 及色谱填料Sephadex G25, Q-Sepharose FF为Pharmacia Biotech产品。
2 方 法
2.1 SDS-PAGE电泳
按Sambrook方法[4],分离胶浓度15%,考马氏亮蓝染色。
2.2 蛋白定量测定
按Lowry酚试剂法。
, 百拇医药
2.3 发酵
种子菌用LB培养基在摇瓶中进行二级放大培养,培养温度为30℃。二级放大后将种子菌液加入改良的M9培养基中,在发酵罐中培养。在发酵培养过程中,各种参数由微机自动控制,pH控制在6.8,由氨水调整;溶氧控制于60%,30℃培养5h,细菌密度达3~5OD后升温至42℃,温度诱导培养3h后5000r/min10min离心收菌。在培养过程中,补充酪蛋白水解物和葡萄糖。
2.4 包涵体制备及纯化
将离心所收菌用PBS洗涤1次,离心,5000r/min10min,4℃,再将菌悬浮于4℃PBS中,用高压匀浆泵破菌,35MPa。5000r/min10min4℃离心收集沉淀,同样缓冲液洗涤沉淀,收集洗涤后的包涵体,-70℃备用。用SDS-PAGE电泳,考马氏亮蓝染色后ImageMaster扫描检测洗涤前后包涵体中r-SAKΔN的纯度。
, http://www.100md.com
2.5 r-SAKΔN包涵体溶解、复性与纯化
纯化后的包涵体用6mol/L盐酸胍以1∶20溶解,室温放置1h,离心10000r/min30min,将上清置透析袋中,以0.05mol/LpH7.4PB分步透析,共48h,4℃。离心10000r/min3min,将上清稀释50倍,4℃过夜,复性后的样品以4ml/min速度上Q-Sepharose FF柱,柱体积2cm×20cm,用上述PB缓冲液洗柱后用0~1mol/LNaCl梯度洗脱,收集含r-SAKΔN活性部分,经浓缩后用SephadexG-25分子筛进一步纯化并脱盐。柱体积2.5cm×80cm,流速2ml/min。
收集含r-SAKΔN部分,并用SDS-PAGE,Image Master扫描分析,鉴定纯度。
2.6 活性测定,分子量测定,免疫反应性鉴定,等电点测定
, http://www.100md.com 活性测定采用酪蛋白板溶圈法,葡激酶标准品从中国生物制品鉴定所购买。
分子量及免疫反应性鉴定:样品经SDS-PAGE后切为两半,分别以考马氏亮蓝染色和转移到PVDF膜,按Sambrook法[5],进行Western blot。第一抗体为兔抗SAK,第二抗体为辣根过氧化物酶标记的羊抗兔抗体,显色底物为二氨基联苯胺。
等电聚焦电泳:按方法[6]。
3 结 果
3.1 发酵
5L发酵罐发酵细菌生长曲线见图(1),每隔0.5h取样品一次,进行SDS-PAGE和lmage Master扫描,检测r-SAKΔN占菌体总蛋白的百分比,确定r-SAKΔN表达曲线见图(2)。发酵结束后离心收湿菌90g。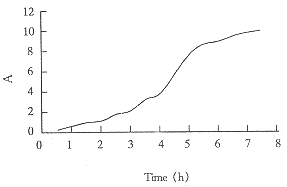
, http://www.100md.com
Fig 1 Fermentation process of E. coli harboring pEMN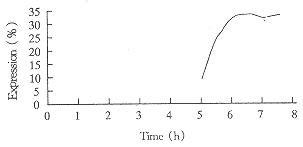
Fig 2 Expression of r-SAKΔN in fermentation process
3.2 破菌及包涵体纯化
用低渗PB悬浮表达菌,高压匀浆泵匀浆后,经光学显微镜检查破菌率大于95%。离心收集沉淀,即为粗制湿包涵体约10g。包涵体经洗涤纯化,得纯化的包涵体约为8g。包涵体洗涤前后SDS-PAGE结果见图(3),Image Master分析r-SAKΔN纯度由68%增加到81%。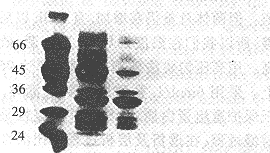

, 百拇医药
A Marker (×103)
B Inclusion body before washing
C Inclusion body after washing
D r-SAKΔNafter renaturation
E r-SAKΔNafter Q-Sepharose FF chromatography
F r-SAKΔNafter Sephadex G-25 chromatography
Fig 3 SDS-PAGE analysis r-SAKΔN in process of purification
, http://www.100md.com
3.3 r-SAKΔN复性,纯化及其特性检测
大肠杆菌表达的r-SAKΔN以无活性的包涵体存在,经溶解和复性处理后才表现活性。见表1。
Tab 1 Purification of r-SAK-ΔN
Weight
(gram)
Protein
(mg)
Total
activity
Specific
, http://www.100md.com activity
Purity
(%)
Bacteria
90
11000
-
-
32
Inclusion body
10
3310
-
, 百拇医药
-
68
Purified inclusion body
8
2100
-
-
81
Refolded protein
1000
4×107
4×104
, 百拇医药
88
After Q-sepharose
320
1.47×107
4.6×104
96
After gel filtration
288
1.44×107
5×104
97
, http://www.100md.com
Purity: ratio of r-SAK-ΔN to total bacteria protein
纯化过程各步产物的SDS-PAGE电泳图见图(3.4.5)。纯度分别为88%,96%和97%;比活性分别为4.0×104,4.6×104和5×104HU/mg。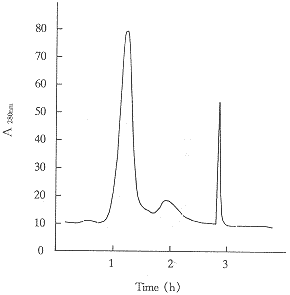
Fig 4 Q-Sepharose FF chromatography of r-SAKΔN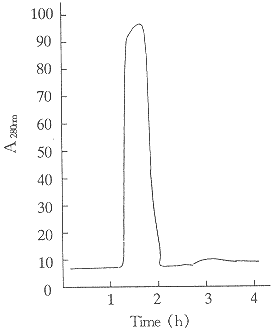
, http://www.100md.com
A Marker;B r-SAKΔN;C Westen Blot
Fig 5 Gel filtration of r-SAKΔN on Sephadex G-25
Western bolt:r-SAKΔN与r-SAK有相同的免疫性,见图(6),凝胶等电聚焦结果见图(7),r-SAKΔN的等电点为pH6.8。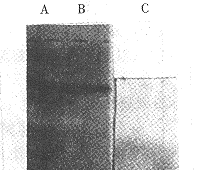
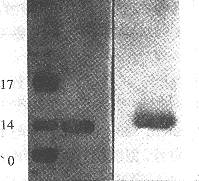
Fig 6 Western blot identify the purified r-SAKΔN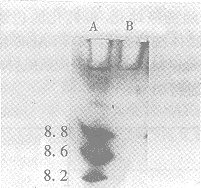
, 百拇医药
Fig 7 Isoelectrophoresis of purified r-SAKΔN
4 讨 论
1995年本研究室成功地完成了野生型rSAK的克隆和在大肠杆菌中的高效表达以及产物的分离和纯化[7~9]。野生型r-SAK在大肠杆菌中的表达呈可溶、活性状态,存在于胞浆中。为了研究SAK的结构与功能的关系,我们克隆了N-端缺失18个氨基酸的突变体基因,并用同样的载体PLY-4构建了表达质粒,与野生型基因的表达不同,其表达产物形成包涵体,r-SAKΔN必须复性后才能研究它的特性,需要创建一套不同于野生型r-SAK的新的纯化方法。重组葡激酶缺失突变体基因。在PL,PR启动子CIts857经调控和温度诱导能在大肠杆菌中高效表达r-SAKΔN,表达水平为32~38%。依图(1)和图(2)可知温度诱导1.5h后表达量已接近最高值。但菌体总量仍在增加,直至3h以后才减慢,所以我们在温度诱导3h后收菌,效率最高。用高压匀浆法破菌,破菌效率达95%以上。采用6mol/L盐酸胍溶解包涵体,有利于保护重组蛋白质。r-SAKN的复性是一个缓慢过程,在透析及层析过程中比活性均有上升,表明变性的蛋白质逐渐恢复正常折叠。通过复性,r-SAKΔN的纯度又得到了进一步的提高。通过一次离子交换纯度可达96%。本研究显示SAK的N-端18个氨基酸与表达过程中蛋白质的折叠有关,缺失的氨基酸中含有多个赖氨酸序列影响r-SAKΔN在菌体中折叠为活性构象。经过盐酸胍溶解,复性及离子交换和凝胶过滤,纯化的r-SAKΔN比活性为5×104IU/mg,Mr为14000,等电点pH6.8。我们建立的纯化方法操作简单,上样多,纯度高,为以后SAK蛋白质工程研究及其它突变体的纯化打好了基础。由于分子量低,若能设法降低突变体分子的免疫原性,则可能制成r-SAKΔN口服制剂,用于防治心肌梗塞和脑梗塞等。
, 百拇医药
参考文献
1 Vanderschueren S, Barrios L, Kerdsinchat P, et al. A randomized trial of recombinant staphylokinase versus alteplase for coronary artery patency in acute myocardial infarction. Circulation, 1995,92∶2044
2 叶立文,汤其群,宋后燕.葡激酶突变体基因的克隆与表达.药物生物技术,1999,6(1)∶9
3 Sambrook J, Fritsch EF, Maniatis T. Molecular cloning. 2nd. Cold spring ha rbor laboratory press 1989,18
, http://www.100md.com
4 Ding H, Zhu YS, Song HY, et al. Acta Academiae Medicinae. Shanghai. 19 92;19(Suppl)∶38
5 汤其群,张小璇,于敏,等.重组葡激酶(r-SAK)的分离纯化和结晶.药物生物 技术,1997,4(1)∶1
6 于敏,任军,宋后燕,等.注射用重组葡激酶的中试研究.高技术通讯 ,1998,8(1)∶45
7 宋后燕.一种重组葡激酶的制备方法.ZL94 1 12105.4
收稿日期:1998-05-22, 百拇医药
单位:上海医科大学分子遗传研究室,上海 200032
关键词:葡激酶突变体;包涵体;复性;纯化
摘 要 重组葡激酶突变体基因在大肠杆菌中高效表达
摘 要 重组葡激酶突变体基因在大肠杆菌中高效表达,产物以包涵体的形式存在于胞浆中。通过发酵,扩增工程菌,机械破菌,离心分离粗制包涵体,后者经纯化后用盐酸胍溶解,r-SAKΔN分子复性后用离子交换层析和分子筛脱盐,纯度达97%,比活性5×104HU/mg,Mr14000,等电点为pH6.8。
Purificaion of Recombinant Staphylokinase Mutant(r-SAKΔN)
, 百拇医药
Ye Liwen, Ren Jun, Song Houyan
(Department of Molecular Genetics, Shanghai Medical University, Shanghai 200032)
Abstract Recombinant staphylokinase mutant (r-SAKΔN) was efficientl y ex pressed in E. coli in the form of inclusion body. By the methods of fermen tation, inclusion body extraction, refolding of r-SAKΔN molecular, Q-seph aros e FF ion-exchange chromatography and gel filtration of Sephadex G-25. The pur ity of r-SAKΔN was reached 97% and with specific activity 5×104 HU/mg. The Mr and isoelectro point were 14000 and pH6.8 respectively.
, 百拇医药
Key Words r-Staphylokinase mutant (r-SAKΔN), Inclusion body, Purification
葡激酶(Staphylokinase)是由某些感染溶原性噬菌体的金黄色葡萄球菌产生的外分泌蛋白,由136个氨基酸组成,Mr15500。葡激酶与纤溶酶原结合后转化为葡激酶纤溶酶复合物,具有激活纤溶酶原的能力。在体内有纤维蛋白存在时,葡激酶对人纤溶酶原的激活作用具有纤维蛋白特异性,因此葡激酶可望开发成新一代高效特异溶栓药物[1]。葡激酶分子量较小,是较为理想的研究蛋白质结构与功能的材料。按照结构与功能的关系设计突变体分子,通过蛋白质工程,开发出新的溶栓药物。Collen等对葡激酶分子中多个带电荷的相邻氨基酸突变为丙氨酸,并对各突变体与野生型葡激酶性能进行了比较,表明分子中部分氨基酸突变能改变葡激酶的性能。我们利用PCR技术以本研究室克隆的野生型葡激酶基因为模板[2]扩增N-末端缺失18个氨基酸的葡激酶突变体基因,在大肠杆菌中得到了高效表达,表达产物形成了包涵体[3]。本文报告了该突变体基因表达产物(r-SAKΔN)的提取、复性、纯化方法,以及该突变体的部分特性。
, 百拇医药
1 材料及设备
1.1 重组葡激酶缺失突变体(r-SAKΔN)高效表达菌株
为本室构建,含突变体基因,PR,PL启动子,Clts857阻抑蛋白基因,5sRNAt1t2终止信号调控。r-SAKΔN表达水平占菌体总蛋白的32%以上。
1.2 试剂
酪蛋白水解产物,等电聚焦标准pH蛋白,均购自Sigma公司。葡萄糖,无机盐,氨水,氨苄青霉素,盐酸硫胺素等均为符合药用标准的国产试剂。纤溶酶原和兔抗SAK抗体,由本室制备。辣根过氧化物酶标记的羊抗兔抗体和二氨基联苯胺购自华美公司。载体两性电解质(pH3.5~10)为上海丽珠东风生物技术有限公司产品。
, http://www.100md.com 1.3 仪器
发酵罐,美国NBS公司出品,BiofloⅢ 5L。Semi-dry transfer cell,蛋白纯化Econo系 统,购自美国Bio-Rad公司。
Image Master 及色谱填料Sephadex G25, Q-Sepharose FF为Pharmacia Biotech产品。
2 方 法
2.1 SDS-PAGE电泳
按Sambrook方法[4],分离胶浓度15%,考马氏亮蓝染色。
2.2 蛋白定量测定
按Lowry酚试剂法。
, 百拇医药
2.3 发酵
种子菌用LB培养基在摇瓶中进行二级放大培养,培养温度为30℃。二级放大后将种子菌液加入改良的M9培养基中,在发酵罐中培养。在发酵培养过程中,各种参数由微机自动控制,pH控制在6.8,由氨水调整;溶氧控制于60%,30℃培养5h,细菌密度达3~5OD后升温至42℃,温度诱导培养3h后5000r/min10min离心收菌。在培养过程中,补充酪蛋白水解物和葡萄糖。
2.4 包涵体制备及纯化
将离心所收菌用PBS洗涤1次,离心,5000r/min10min,4℃,再将菌悬浮于4℃PBS中,用高压匀浆泵破菌,35MPa。5000r/min10min4℃离心收集沉淀,同样缓冲液洗涤沉淀,收集洗涤后的包涵体,-70℃备用。用SDS-PAGE电泳,考马氏亮蓝染色后ImageMaster扫描检测洗涤前后包涵体中r-SAKΔN的纯度。
, http://www.100md.com
2.5 r-SAKΔN包涵体溶解、复性与纯化
纯化后的包涵体用6mol/L盐酸胍以1∶20溶解,室温放置1h,离心10000r/min30min,将上清置透析袋中,以0.05mol/LpH7.4PB分步透析,共48h,4℃。离心10000r/min3min,将上清稀释50倍,4℃过夜,复性后的样品以4ml/min速度上Q-Sepharose FF柱,柱体积2cm×20cm,用上述PB缓冲液洗柱后用0~1mol/LNaCl梯度洗脱,收集含r-SAKΔN活性部分,经浓缩后用SephadexG-25分子筛进一步纯化并脱盐。柱体积2.5cm×80cm,流速2ml/min。
收集含r-SAKΔN部分,并用SDS-PAGE,Image Master扫描分析,鉴定纯度。
2.6 活性测定,分子量测定,免疫反应性鉴定,等电点测定
, http://www.100md.com 活性测定采用酪蛋白板溶圈法,葡激酶标准品从中国生物制品鉴定所购买。
分子量及免疫反应性鉴定:样品经SDS-PAGE后切为两半,分别以考马氏亮蓝染色和转移到PVDF膜,按Sambrook法[5],进行Western blot。第一抗体为兔抗SAK,第二抗体为辣根过氧化物酶标记的羊抗兔抗体,显色底物为二氨基联苯胺。
等电聚焦电泳:按方法[6]。
3 结 果
3.1 发酵
5L发酵罐发酵细菌生长曲线见图(1),每隔0.5h取样品一次,进行SDS-PAGE和lmage Master扫描,检测r-SAKΔN占菌体总蛋白的百分比,确定r-SAKΔN表达曲线见图(2)。发酵结束后离心收湿菌90g。

, http://www.100md.com
Fig 1 Fermentation process of E. coli harboring pEMN

Fig 2 Expression of r-SAKΔN in fermentation process
3.2 破菌及包涵体纯化
用低渗PB悬浮表达菌,高压匀浆泵匀浆后,经光学显微镜检查破菌率大于95%。离心收集沉淀,即为粗制湿包涵体约10g。包涵体经洗涤纯化,得纯化的包涵体约为8g。包涵体洗涤前后SDS-PAGE结果见图(3),Image Master分析r-SAKΔN纯度由68%增加到81%。


, 百拇医药
A Marker (×103)
B Inclusion body before washing
C Inclusion body after washing
D r-SAKΔNafter renaturation
E r-SAKΔNafter Q-Sepharose FF chromatography
F r-SAKΔNafter Sephadex G-25 chromatography
Fig 3 SDS-PAGE analysis r-SAKΔN in process of purification
, http://www.100md.com
3.3 r-SAKΔN复性,纯化及其特性检测
大肠杆菌表达的r-SAKΔN以无活性的包涵体存在,经溶解和复性处理后才表现活性。见表1。
Tab 1 Purification of r-SAK-ΔN
Weight
(gram)
Protein
(mg)
Total
activity
Specific
, http://www.100md.com activity
Purity
(%)
Bacteria
90
11000
-
-
32
Inclusion body
10
3310
-
, 百拇医药
-
68
Purified inclusion body
8
2100
-
-
81
Refolded protein
1000
4×107
4×104
, 百拇医药
88
After Q-sepharose
320
1.47×107
4.6×104
96
After gel filtration
288
1.44×107
5×104
97
, http://www.100md.com
Purity: ratio of r-SAK-ΔN to total bacteria protein
纯化过程各步产物的SDS-PAGE电泳图见图(3.4.5)。纯度分别为88%,96%和97%;比活性分别为4.0×104,4.6×104和5×104HU/mg。

Fig 4 Q-Sepharose FF chromatography of r-SAKΔN

, http://www.100md.com
A Marker;B r-SAKΔN;C Westen Blot
Fig 5 Gel filtration of r-SAKΔN on Sephadex G-25
Western bolt:r-SAKΔN与r-SAK有相同的免疫性,见图(6),凝胶等电聚焦结果见图(7),r-SAKΔN的等电点为pH6.8。


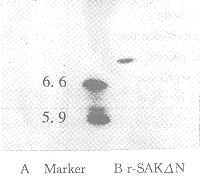
Fig 6 Western blot identify the purified r-SAKΔN


, 百拇医药
Fig 7 Isoelectrophoresis of purified r-SAKΔN
4 讨 论
1995年本研究室成功地完成了野生型rSAK的克隆和在大肠杆菌中的高效表达以及产物的分离和纯化[7~9]。野生型r-SAK在大肠杆菌中的表达呈可溶、活性状态,存在于胞浆中。为了研究SAK的结构与功能的关系,我们克隆了N-端缺失18个氨基酸的突变体基因,并用同样的载体PLY-4构建了表达质粒,与野生型基因的表达不同,其表达产物形成包涵体,r-SAKΔN必须复性后才能研究它的特性,需要创建一套不同于野生型r-SAK的新的纯化方法。重组葡激酶缺失突变体基因。在PL,PR启动子CIts857经调控和温度诱导能在大肠杆菌中高效表达r-SAKΔN,表达水平为32~38%。依图(1)和图(2)可知温度诱导1.5h后表达量已接近最高值。但菌体总量仍在增加,直至3h以后才减慢,所以我们在温度诱导3h后收菌,效率最高。用高压匀浆法破菌,破菌效率达95%以上。采用6mol/L盐酸胍溶解包涵体,有利于保护重组蛋白质。r-SAKN的复性是一个缓慢过程,在透析及层析过程中比活性均有上升,表明变性的蛋白质逐渐恢复正常折叠。通过复性,r-SAKΔN的纯度又得到了进一步的提高。通过一次离子交换纯度可达96%。本研究显示SAK的N-端18个氨基酸与表达过程中蛋白质的折叠有关,缺失的氨基酸中含有多个赖氨酸序列影响r-SAKΔN在菌体中折叠为活性构象。经过盐酸胍溶解,复性及离子交换和凝胶过滤,纯化的r-SAKΔN比活性为5×104IU/mg,Mr为14000,等电点pH6.8。我们建立的纯化方法操作简单,上样多,纯度高,为以后SAK蛋白质工程研究及其它突变体的纯化打好了基础。由于分子量低,若能设法降低突变体分子的免疫原性,则可能制成r-SAKΔN口服制剂,用于防治心肌梗塞和脑梗塞等。
, 百拇医药
参考文献
1 Vanderschueren S, Barrios L, Kerdsinchat P, et al. A randomized trial of recombinant staphylokinase versus alteplase for coronary artery patency in acute myocardial infarction. Circulation, 1995,92∶2044
2 叶立文,汤其群,宋后燕.葡激酶突变体基因的克隆与表达.药物生物技术,1999,6(1)∶9
3 Sambrook J, Fritsch EF, Maniatis T. Molecular cloning. 2nd. Cold spring ha rbor laboratory press 1989,18
, http://www.100md.com
4 Ding H, Zhu YS, Song HY, et al. Acta Academiae Medicinae. Shanghai. 19 92;19(Suppl)∶38
5 汤其群,张小璇,于敏,等.重组葡激酶(r-SAK)的分离纯化和结晶.药物生物 技术,1997,4(1)∶1
6 于敏,任军,宋后燕,等.注射用重组葡激酶的中试研究.高技术通讯 ,1998,8(1)∶45
7 宋后燕.一种重组葡激酶的制备方法.ZL94 1 12105.4
收稿日期:1998-05-22, 百拇医药