mIL-12基因转染促进小鼠树突状细胞混合淋巴细胞反应
作者:徐彤 杨靖清 殷慧君 唐佩弦
单位:徐彤 殷慧君(北京医科大学人民医院儿科,北京 100044);唐佩弦 杨靖清(军事医学科学院基础医学研究所,北京 100850)
关键词:树突状细胞;白细胞介素12;转染;淋巴细胞转化;小鼠
安徽医科大学学报000204 摘要 目的 观察mIL-12基因转染的小鼠树突状细胞(DC)功能的改变。方法 分离小鼠骨髓单个核细胞与rmGM-CSF和rmIL-4培养1周,对培养的细胞进行形态学观察,FACS检测细胞表面DEC205、CD86表达。以mIL-12重组腺病毒转染培养的DC, ELISA测定培养上清中mIL-12的水平,混合淋巴细胞反应检测转染细胞的功能。结果 培养1周后,得到具有典型DC形态的细胞,以mIL-12重组腺病毒为载体转染DC, 培养上清中可以检测到较高水平的mIL-12;与对照组相比转染细胞能明显地刺激混合林巴细胞反应。结论 小鼠骨髓单个核细胞经GM-CSF和IL-4培养1周,生成大量DC, mIL-12重组腺病毒感染培养的DC对T细胞刺激显著增强。
, http://www.100md.com
中图分类号 R329.24
文献标识码 A 文章编号 1000-1492(2000)02-0094-04
mIL-12 gene transferred murine dendritic cells stimulate mixed lymphocyte reaction
Xu Tong, Yang Jingqing, Yin Huijun et al
(Dept of Pediatrics, Peoples Hospital, Beijing Medical University,Beijing 100044)
Abstract Objective To observe the function of dendritic cells(DC) transfected with mIL-12 (murine IL-12) gene. Methods Monocytes isolated from murine bone marrow were cultured with rmGM-CSF and rm-IL4 for 7 days. Characteristics of the cultured cells were observed and the expression of DEC205 and CD86 was detected by FACS. DC derived from culture were transfected with recombinant adenovirus containing mIL-12 gene. mIL-12 in the supernatant was detected by ELISA. MLR was studied with different types of DC. Results After 7 days of culture, a large number of cells with typical characteristics of DC were observed. The mIL-12 level in the supernatant of transfected DC was high. More noticeable MLR was found with DC transfected mIL-12 gene in comparison with the control. Conclusion Generatin of large number of DC from murine bone marrow monocyte cultures supplemented with GM-CSF and IL-4 for 1 week. The function of DC transfected with AdCMIVIL-12 enhanced in mixed lymphocyte reaction.
, 百拇医药
MeSH dendritic cells; interleukin-12; transfection; lymphocyte transformation; mice
树突状细胞(dendritic cells,DC)迄今被认为是最重要的抗原递呈细胞, 能摄取、加工抗原并向Ⅰ类抗原限制的CTL及Ⅱ类抗原限制的CD4+ T细胞递呈,DC可在体内外直接激活原初(naive) T细胞〔1,2〕。鉴于其在免疫系统中的特殊作用,DC治疗作为肿瘤治疗方案之一近来受到普遍关注。本研究从小鼠骨髓分离出单个核细胞, 加入 1×106 U.L-1 rmGM-CSF和8×105 U.L-1的rmIL-4,培养7天,获得大量具有典型DC形态的细胞。扫描电镜下观察细胞表面特征,流式细胞仪检测细胞表面分子的表达及吞噬功能。为了进一步提高DC对T细胞的作用,我们用重组腺病毒为载体介导mIL-12基因转染经GM-CSF和IL-4诱生的DC细胞,发现mIL-12转染的DC细胞较对照组更明显地激发混合淋巴细胞反应。
, 百拇医药
1 材料与方法
1.1 实验动物及主要试剂 C57 BL/6小鼠及Balb/c小鼠:6~8周龄,♀,购自军事医学科学院动物中心(实验动物准字号:D01-031及 D01-028)。293细胞:为人胚肾细胞株,是复制缺陷型重组腺病毒载体包装细胞,由军事医学科学院吴祖泽院士惠赠。rmGM-CSF和rmIL-4及rmTNF-α:购自Peprotech公司。大鼠抗小鼠DEC205、CD86单克隆抗体及PE标记羊抗大鼠IgG:购自Serotech。PBA:含5 ml.L-1 BSA, 200 mg.L-1 NaN3(质量浓度,下同)的PBS。RPMI 1640及DMEM(Gibco)完全培养液含1×105 U.L-1青霉素、1×105 U.L-1链霉素,100 ml.L-1胎牛血清 (天津市川页生化制品研究所);新生牛血清购自北京军区兽医站;重组腺病毒AdCMVIL-12、AdCMVLacZ粗提液(西班牙Navarra大学Dr Cheng Qian 惠赠);3H-TdR(中国科学院原子能研究所,放射性比度0.74 GBq.mol-1活性);氯化铯(Boehringer mannheim);6孔板和U形底96孔板 (Nunc);mIL-12的ELISA 试剂盒购自Endogen公司;FITC-Dextran(Promega,相对分子量77 000)。Tris-NH4Cl缓冲液:4.12 g Tris溶于160 ml蒸馏水,盐酸调pH至7.65,为A液。称取NH4Cl 8.3 g溶于1 L蒸馏水,为B液。使用前B与A 9∶1体积混合,盐酸调pH至7.2。
, 百拇医药
1.2 DC体外培养 C57BL/6小鼠断颈处死,分离股骨,剪开股骨两头,用注射器自其一侧冲洗出骨髓细胞,离心收集细胞,加入Tris-NH4Cl缓冲液破坏红细胞(3 ml液体可加入约108个红细胞),5 min后加入PBS洗涤3次,用RPMI 1640悬浮细胞并调整细胞浓度为2.5×109.L-1,置于6孔板内,37℃,5% CO2饱和湿度下贴壁2 h,吸弃上清。用预热37℃的RPMI 1640培养基轻轻洗去非贴壁细胞,得到贴壁单核细胞。每孔加入2 ml内含rmGM-CSF1×106 U.L-1, rmIL-4 8×105 U.L-1的完全RPMI 1640培养液。 2天换液1次,补充新鲜培养基和细胞因子,于培养的第7日收集悬浮细胞。
, http://www.100md.com
1.3 电镜观察 收集的悬浮细胞用PBS洗2次,2.5%戊二醛固定,PBS洗2次,制成悬液,1%锇酸固定,4℃,30 min,梯度乙醇脱水,乙酸异戊酯置换。CO2临界点干燥,扫描电镜观察。由军事医学科学院仪器中心协助完成。
1.4 细胞表面分子测定及吞噬功能 收集细胞,用FACS标记液PBA洗2遍, 加入PBA 10倍稀释的单抗DEC205及CD86各0.1 ml,单抗标记浓度为10 mg.L-1,置4℃标记30 min后,PBA洗2遍,加入PE标记的羊抗大鼠 IgG二抗4℃暗处标记30 min,二抗标记浓度为2 mg.L-1,PBA洗2遍,通过流式细胞仪检测细胞表面分子。记数约106,经或未经10 μg.L-1 rmTNF-α诱导24 h的DC,用含0.5 g.L-1 FITC-Dextran的RPMI 1640完全培养基重悬,37℃孵育细胞30 min;对照组DC置于0℃,30 min后用含PBA洗3次,流式细胞仪检测。
, http://www.100md.com
1.5 mIL-12重组腺病毒感染培养的DC
1.5.1 腺病毒的扩增、收集、纯化及滴度测定 293细胞用完全DMEM培养液培养。待细胞长满至培养瓶底的70%~80%时培养基更换为含2.5 ml.L-1新生牛血清的DMEM,加入重组腺病毒粗提液,继续培养观察48~72 h,收集呈病态反应(cytopathic effect, CPE)的293细胞,反复冻融5次,冻融液1 500 r.min-1,离心20 min,弃细胞碎片,上清经氯化铯密度梯度2次离心浓缩腺病毒颗粒,离心产物经Hank液透析后,加入200 ml.L-1甘油,分装后于-70℃冻存备用。病毒滴度采用噬斑分析法结合细胞病变测定法〔3〕。
, 百拇医药 1.5.2 mIL-12重组腺病毒感染DC DC培养的第7天,吸出悬浮细胞,以RPMI 1640洗2次,FACS分选DEC205阳性细胞,分别以纯化的腺病毒AdCMVIL-12和AdCMVLacZ(MOI为500)感染,37℃共同孵育4 h, RPMI 1640洗涤3次去除游离病毒, 再用含rmGM-CSF和rmIL-4的完全1640重悬细胞,继续培养48 h。
1.5.3 mIL-12重组腺病毒感染DC培养上清中mIL-12含量的测定 AdCMVIL-12和AdCMVLacZ重组腺病毒感染培养7天的DC, 继续培养48 h后,收集上清,按ELISA试剂盒步骤进行操作,酶标仪测定结果在标准曲线上找出对应IL-12的含量。
1.6 混合淋巴细胞反应 取Balb/c小鼠脾脏铜网研磨,用Tris-NH4Cl缓冲液破坏红细胞,5 min后加入PBS洗涤细胞2次,以RPMI 1640重悬,37℃贴壁2 h,收集上清未贴壁细胞,用含200 ml.L-1小牛血清的RPMI 1640重悬,浓度为1010.L-1,加至预先已用含200 ml.L-1小牛血清的RPMI 1640浸湿的尼龙毛柱上37℃,吸附1 h后,冲洗尼龙毛柱,冲出的非吸附细胞主要是T淋巴细胞,加入96孔板,每孔104个细胞。转染和未转染的DC用RPMI 1640完全培养基悬浮,浓度为5×109.L-1,与丝裂霉素C 30 mg.L-1 37℃孵育30 min后,在96孔板内分别加入103个、104个和5×104个DC细胞/孔,每孔终体积200 μl,各组设3个复孔,37℃ 5% CO2培养96 h,于培养结束前18 h每孔加入3H-TdR 37 kBq。多头细胞收集器收集细胞,液闪计数仪检测cpm值,结果以3孔均值表示。
, http://www.100md.com
2 结果
2.1 体外培养DC生成及形态 从小鼠骨髓分离的单个核细胞,贴壁培养2 h,加入含rmGM-CSF 1×106 U.L-1, rmIL-4 8×105 U.L-1的完全培养基培养。加入细胞因子的第2天起,轻轻转动培养皿,小心吸去悬浮细胞。第2天即可见明显的细胞团形成;至第4~5天,细胞团体积已相当大,可见少量的悬浮细胞;培养至第6~7天,细胞团解体,大部分细胞为悬浮细胞,光镜下观察可见细胞形态不规则,有大量的突起,具典型的DC形态。培养7天的DC细胞进行扫描电镜观察,细胞表面具有大量的皱折和不规则突起(图1)。
图1 扫描电镜观察DC形态
, 百拇医药
2.2 培养的DC表面分子表达及吞噬功能 FACS检测培养7天DC表面DEC205、CD86表达,发现小鼠骨髓分离的单个核细胞经rmGM-CSF和rmIL-4诱导后,DEC205阳性率在50%以上,CD86的表达在60%以上。FITC标记的葡聚糖被细胞摄取后通过流式仪检测荧光强度,可反映细胞的吞噬能力,图2中未经TNF-α诱导的细胞中吞噬葡聚糖的阳性率为47.84%,经10 μg.L-1 rmTNF-α诱导24 h后的细胞吞噬葡聚糖的阳性率为10.61%,说明体外培养7天的未成熟DC有较强的吞噬外源性抗原能力,但是经诱导成熟的DC对抗原的摄取能力降低。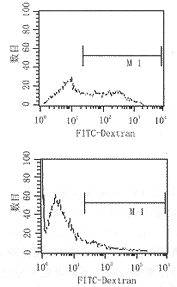
图2 TNF-α诱导对DC吞噬能力的影响
2.3 重组腺病毒感染的DC细胞培养上清中mIL-12含量 经氯化铯密度梯度离心后AdCMVLacZ和AdCMVIL-12的滴度分别为2.1×1013 pfu.L-1及4.5×1012 pfu.L-1。AdCMVLacZ以MOI值50、100、500、1 000、5 000去感染DC, 发现随MOI值的增加,腺病毒的感染率也增高,但到达500以后,感染率增加得不明显。rmGM-CSF和rmIL-4培养DC至第9天,ELISA测定上清中的mIL-12含量为12.5 ng.L-1; AdCMVLacZ、AdCMVIL-12均以MOI 500感染DC,AdCMVLacZ感染DC 48 h后培养上清中mIL-12含量为15 ng.L-1, AdCMVIL-12感染DC 48 h后培养上清mIL-12含量达到(516.7±57.4) mg.L-1,表明重组腺病毒成功介导了mIL-12的转染。
, http://www.100md.com
2.4 混合淋巴细胞培养结果 混合淋巴细胞培养中,AdCMVIL-12感染的DC在浓度为每孔5×103和104时,3H-TdR的掺入值均比AdCMVLacZ感染的DC高,提示IL-12基因转染的DC具有更强的刺激T细胞增殖的能力,结果见图3。
3 讨论
DC由Steinmen和Cohn〔4〕于1973年首先发现,随着对其分化发育 、表面分型等方面研究的不断深入和开展,DC日趋成为人们关注的焦点。DC来源于骨髓的CD34+细胞,分布于除脑之外的所有器官、组织。虽然分布广泛但含量极少,比如在外周血中,DC的含量仅占白细胞的1/1 000〔5〕,所以体外扩增DC成为临床应用的第一个关键。近年来用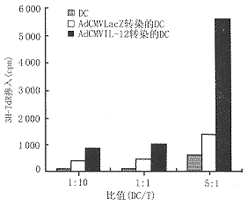
, 百拇医药
图3 重组腺病毒感染的DC混合淋巴细胞培养
细胞因子体外诱生DC获得成功,为DC的临床运用开辟了道路。研究者用GM-CSF、IL-4和TNF-α采取不同配伍,分别从外周血CD34+细胞、脐带血CD34+造血祖细胞及外周血单个核细胞诱导出具有DC形态和功能的细胞。Inaba等〔6〕将小鼠骨髓细胞用多种单抗以及补体去除淋巴细胞、粒细胞、巨噬细胞后,剩下的细胞加入GM-CSF培养1周,培养过程中反复去除粒细胞得到DC。我们在本实验中简化了这一操作过程,将分离出的小鼠骨髓单个核细胞,与rmGM-CSF和rmIL-4共同培养1周后,获得了大量带有典型形态的细胞,光镜及电镜观察都表明,这些细胞具有DC的特征,FACS检测DEC205阳性细胞可达50%以上,CD86的表达在60%以上。GM-CSF可以促进DC的增殖,而IL-4可以抑制巨噬细胞和粒细胞的生成。DC是以形态而得名,缺少B细胞、T细胞和NK细胞的标记,目前CD83多用于人成熟DC 的标记,DEC205被认为是小鼠DC的标记。
, 百拇医药
DC参与T细胞功能的多个方面,不仅参与混合淋巴细胞反应,促进细胞毒T细胞的形成,也参与T细胞对丝裂原的增殖反应〔7〕。DC能够促进naive CD4+ T细胞向Th1细胞分化, Kanangat和Kang〔8,9〕在人郎罕细胞和小鼠脾细胞的DC检测到IL-12 mRNA;Heufler等〔13〕用RIA法分别检测了小鼠脾脏和骨髓来源的DC,发现在未受刺激的情况下,来源于脾的DC培养上清中可检测到(8.4±4.8) ng.L-1的IL-12(P70),骨髓来源的DC培养上清中测到(6.4±4.3) ng.L-1水平的IL-12,经葡萄球菌(Staphyloccocus)刺激后,IL-12的分泌增加,可以上升到30 ng.L-1左右。为了提高DC对T细胞的刺激作用,我们尝试用 IL-12腺病毒载体转染自小鼠骨髓诱生的DC,培养上清中通过ELISA可以检测到高水平的IL-12, 同时转染细胞对混合淋巴细胞反应的刺激增强,提示IL-12转染的DC可能具有更强的激活T细胞的功能。虽然上述体外实验的结果表明IL-12的转染提高了DC的功能,但我们尚未取得体内实验的证据,有待于今后进一步探索。
, 百拇医药
作者简介:徐 彤,女,30岁,博士
参考文献
1,Shurin MR. Dendritic cells presenting tumor antigen.Cancer Immunol Immunother,1996;43(3):158~164
2,Gilboa E,Nair SK , Lyerly HK. Immunotherapy of cancer with dendritic cell based vaccines. Cancer Immunol Immunother, 1998;46(2):82~87
3,耿雨红,吴昊泉,应蓓蓓等. 带HSV-tk的重组腺病毒杀伤离体肺癌细胞的研究.复旦学报(自然科学版),1996;35(2):121~126
, 百拇医药
4,Steinman RM, Cohn ZA. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. J Exp Med,1973;137(5):1 142~1 162
5,Siena S ,Nicola MD,Boegni M et al. Massive ex vivo generation of functional dendritic cells from mobilized CD34+ blood progenitors for anticancer therapy. Exp Hematol, 1995;23(14):1 463~1 471
6,Inaba K, Inaba M,Romani N et al. Generation of large number of dendritic cells from mouse bone marrow cultures supplemented with GM-CSF. J Exp Med, 1992;176(6):1 693~1 702
, 百拇医药
7,Ni K, O'Neill HC. The role of dendritic cells in T cell activation. Immunol Cell Biol,1997;75(3):223~230
8,Kanangat S,Nair S, Babu JS et al. Expression of cytokine mRNA in murine splenic dendritic cells and better induction of T cell-derived cytokines by dendritic cells than by macrophages during in vitro costimulation assay using specific antigens. J Leukoc Biol,1995;57(2):310~316
9,Kang K,Kubin M, Cooper KD et al. IL-12 synthesis by human Langerhans cells. J Immunol, 1996;156(4):1 402~1 407
1999-05-01收稿
2000-01-05修回, 百拇医药
单位:徐彤 殷慧君(北京医科大学人民医院儿科,北京 100044);唐佩弦 杨靖清(军事医学科学院基础医学研究所,北京 100850)
关键词:树突状细胞;白细胞介素12;转染;淋巴细胞转化;小鼠
安徽医科大学学报000204 摘要 目的 观察mIL-12基因转染的小鼠树突状细胞(DC)功能的改变。方法 分离小鼠骨髓单个核细胞与rmGM-CSF和rmIL-4培养1周,对培养的细胞进行形态学观察,FACS检测细胞表面DEC205、CD86表达。以mIL-12重组腺病毒转染培养的DC, ELISA测定培养上清中mIL-12的水平,混合淋巴细胞反应检测转染细胞的功能。结果 培养1周后,得到具有典型DC形态的细胞,以mIL-12重组腺病毒为载体转染DC, 培养上清中可以检测到较高水平的mIL-12;与对照组相比转染细胞能明显地刺激混合林巴细胞反应。结论 小鼠骨髓单个核细胞经GM-CSF和IL-4培养1周,生成大量DC, mIL-12重组腺病毒感染培养的DC对T细胞刺激显著增强。
, http://www.100md.com
中图分类号 R329.24
文献标识码 A 文章编号 1000-1492(2000)02-0094-04
mIL-12 gene transferred murine dendritic cells stimulate mixed lymphocyte reaction
Xu Tong, Yang Jingqing, Yin Huijun et al
(Dept of Pediatrics, Peoples Hospital, Beijing Medical University,Beijing 100044)
Abstract Objective To observe the function of dendritic cells(DC) transfected with mIL-12 (murine IL-12) gene. Methods Monocytes isolated from murine bone marrow were cultured with rmGM-CSF and rm-IL4 for 7 days. Characteristics of the cultured cells were observed and the expression of DEC205 and CD86 was detected by FACS. DC derived from culture were transfected with recombinant adenovirus containing mIL-12 gene. mIL-12 in the supernatant was detected by ELISA. MLR was studied with different types of DC. Results After 7 days of culture, a large number of cells with typical characteristics of DC were observed. The mIL-12 level in the supernatant of transfected DC was high. More noticeable MLR was found with DC transfected mIL-12 gene in comparison with the control. Conclusion Generatin of large number of DC from murine bone marrow monocyte cultures supplemented with GM-CSF and IL-4 for 1 week. The function of DC transfected with AdCMIVIL-12 enhanced in mixed lymphocyte reaction.
, 百拇医药
MeSH dendritic cells; interleukin-12; transfection; lymphocyte transformation; mice
树突状细胞(dendritic cells,DC)迄今被认为是最重要的抗原递呈细胞, 能摄取、加工抗原并向Ⅰ类抗原限制的CTL及Ⅱ类抗原限制的CD4+ T细胞递呈,DC可在体内外直接激活原初(naive) T细胞〔1,2〕。鉴于其在免疫系统中的特殊作用,DC治疗作为肿瘤治疗方案之一近来受到普遍关注。本研究从小鼠骨髓分离出单个核细胞, 加入 1×106 U.L-1 rmGM-CSF和8×105 U.L-1的rmIL-4,培养7天,获得大量具有典型DC形态的细胞。扫描电镜下观察细胞表面特征,流式细胞仪检测细胞表面分子的表达及吞噬功能。为了进一步提高DC对T细胞的作用,我们用重组腺病毒为载体介导mIL-12基因转染经GM-CSF和IL-4诱生的DC细胞,发现mIL-12转染的DC细胞较对照组更明显地激发混合淋巴细胞反应。
, 百拇医药
1 材料与方法
1.1 实验动物及主要试剂 C57 BL/6小鼠及Balb/c小鼠:6~8周龄,♀,购自军事医学科学院动物中心(实验动物准字号:D01-031及 D01-028)。293细胞:为人胚肾细胞株,是复制缺陷型重组腺病毒载体包装细胞,由军事医学科学院吴祖泽院士惠赠。rmGM-CSF和rmIL-4及rmTNF-α:购自Peprotech公司。大鼠抗小鼠DEC205、CD86单克隆抗体及PE标记羊抗大鼠IgG:购自Serotech。PBA:含5 ml.L-1 BSA, 200 mg.L-1 NaN3(质量浓度,下同)的PBS。RPMI 1640及DMEM(Gibco)完全培养液含1×105 U.L-1青霉素、1×105 U.L-1链霉素,100 ml.L-1胎牛血清 (天津市川页生化制品研究所);新生牛血清购自北京军区兽医站;重组腺病毒AdCMVIL-12、AdCMVLacZ粗提液(西班牙Navarra大学Dr Cheng Qian 惠赠);3H-TdR(中国科学院原子能研究所,放射性比度0.74 GBq.mol-1活性);氯化铯(Boehringer mannheim);6孔板和U形底96孔板 (Nunc);mIL-12的ELISA 试剂盒购自Endogen公司;FITC-Dextran(Promega,相对分子量77 000)。Tris-NH4Cl缓冲液:4.12 g Tris溶于160 ml蒸馏水,盐酸调pH至7.65,为A液。称取NH4Cl 8.3 g溶于1 L蒸馏水,为B液。使用前B与A 9∶1体积混合,盐酸调pH至7.2。
, 百拇医药
1.2 DC体外培养 C57BL/6小鼠断颈处死,分离股骨,剪开股骨两头,用注射器自其一侧冲洗出骨髓细胞,离心收集细胞,加入Tris-NH4Cl缓冲液破坏红细胞(3 ml液体可加入约108个红细胞),5 min后加入PBS洗涤3次,用RPMI 1640悬浮细胞并调整细胞浓度为2.5×109.L-1,置于6孔板内,37℃,5% CO2饱和湿度下贴壁2 h,吸弃上清。用预热37℃的RPMI 1640培养基轻轻洗去非贴壁细胞,得到贴壁单核细胞。每孔加入2 ml内含rmGM-CSF1×106 U.L-1, rmIL-4 8×105 U.L-1的完全RPMI 1640培养液。 2天换液1次,补充新鲜培养基和细胞因子,于培养的第7日收集悬浮细胞。
, http://www.100md.com
1.3 电镜观察 收集的悬浮细胞用PBS洗2次,2.5%戊二醛固定,PBS洗2次,制成悬液,1%锇酸固定,4℃,30 min,梯度乙醇脱水,乙酸异戊酯置换。CO2临界点干燥,扫描电镜观察。由军事医学科学院仪器中心协助完成。
1.4 细胞表面分子测定及吞噬功能 收集细胞,用FACS标记液PBA洗2遍, 加入PBA 10倍稀释的单抗DEC205及CD86各0.1 ml,单抗标记浓度为10 mg.L-1,置4℃标记30 min后,PBA洗2遍,加入PE标记的羊抗大鼠 IgG二抗4℃暗处标记30 min,二抗标记浓度为2 mg.L-1,PBA洗2遍,通过流式细胞仪检测细胞表面分子。记数约106,经或未经10 μg.L-1 rmTNF-α诱导24 h的DC,用含0.5 g.L-1 FITC-Dextran的RPMI 1640完全培养基重悬,37℃孵育细胞30 min;对照组DC置于0℃,30 min后用含PBA洗3次,流式细胞仪检测。
, http://www.100md.com
1.5 mIL-12重组腺病毒感染培养的DC
1.5.1 腺病毒的扩增、收集、纯化及滴度测定 293细胞用完全DMEM培养液培养。待细胞长满至培养瓶底的70%~80%时培养基更换为含2.5 ml.L-1新生牛血清的DMEM,加入重组腺病毒粗提液,继续培养观察48~72 h,收集呈病态反应(cytopathic effect, CPE)的293细胞,反复冻融5次,冻融液1 500 r.min-1,离心20 min,弃细胞碎片,上清经氯化铯密度梯度2次离心浓缩腺病毒颗粒,离心产物经Hank液透析后,加入200 ml.L-1甘油,分装后于-70℃冻存备用。病毒滴度采用噬斑分析法结合细胞病变测定法〔3〕。
, 百拇医药 1.5.2 mIL-12重组腺病毒感染DC DC培养的第7天,吸出悬浮细胞,以RPMI 1640洗2次,FACS分选DEC205阳性细胞,分别以纯化的腺病毒AdCMVIL-12和AdCMVLacZ(MOI为500)感染,37℃共同孵育4 h, RPMI 1640洗涤3次去除游离病毒, 再用含rmGM-CSF和rmIL-4的完全1640重悬细胞,继续培养48 h。
1.5.3 mIL-12重组腺病毒感染DC培养上清中mIL-12含量的测定 AdCMVIL-12和AdCMVLacZ重组腺病毒感染培养7天的DC, 继续培养48 h后,收集上清,按ELISA试剂盒步骤进行操作,酶标仪测定结果在标准曲线上找出对应IL-12的含量。
1.6 混合淋巴细胞反应 取Balb/c小鼠脾脏铜网研磨,用Tris-NH4Cl缓冲液破坏红细胞,5 min后加入PBS洗涤细胞2次,以RPMI 1640重悬,37℃贴壁2 h,收集上清未贴壁细胞,用含200 ml.L-1小牛血清的RPMI 1640重悬,浓度为1010.L-1,加至预先已用含200 ml.L-1小牛血清的RPMI 1640浸湿的尼龙毛柱上37℃,吸附1 h后,冲洗尼龙毛柱,冲出的非吸附细胞主要是T淋巴细胞,加入96孔板,每孔104个细胞。转染和未转染的DC用RPMI 1640完全培养基悬浮,浓度为5×109.L-1,与丝裂霉素C 30 mg.L-1 37℃孵育30 min后,在96孔板内分别加入103个、104个和5×104个DC细胞/孔,每孔终体积200 μl,各组设3个复孔,37℃ 5% CO2培养96 h,于培养结束前18 h每孔加入3H-TdR 37 kBq。多头细胞收集器收集细胞,液闪计数仪检测cpm值,结果以3孔均值表示。
, http://www.100md.com
2 结果
2.1 体外培养DC生成及形态 从小鼠骨髓分离的单个核细胞,贴壁培养2 h,加入含rmGM-CSF 1×106 U.L-1, rmIL-4 8×105 U.L-1的完全培养基培养。加入细胞因子的第2天起,轻轻转动培养皿,小心吸去悬浮细胞。第2天即可见明显的细胞团形成;至第4~5天,细胞团体积已相当大,可见少量的悬浮细胞;培养至第6~7天,细胞团解体,大部分细胞为悬浮细胞,光镜下观察可见细胞形态不规则,有大量的突起,具典型的DC形态。培养7天的DC细胞进行扫描电镜观察,细胞表面具有大量的皱折和不规则突起(图1)。

图1 扫描电镜观察DC形态
, 百拇医药
2.2 培养的DC表面分子表达及吞噬功能 FACS检测培养7天DC表面DEC205、CD86表达,发现小鼠骨髓分离的单个核细胞经rmGM-CSF和rmIL-4诱导后,DEC205阳性率在50%以上,CD86的表达在60%以上。FITC标记的葡聚糖被细胞摄取后通过流式仪检测荧光强度,可反映细胞的吞噬能力,图2中未经TNF-α诱导的细胞中吞噬葡聚糖的阳性率为47.84%,经10 μg.L-1 rmTNF-α诱导24 h后的细胞吞噬葡聚糖的阳性率为10.61%,说明体外培养7天的未成熟DC有较强的吞噬外源性抗原能力,但是经诱导成熟的DC对抗原的摄取能力降低。

图2 TNF-α诱导对DC吞噬能力的影响
2.3 重组腺病毒感染的DC细胞培养上清中mIL-12含量 经氯化铯密度梯度离心后AdCMVLacZ和AdCMVIL-12的滴度分别为2.1×1013 pfu.L-1及4.5×1012 pfu.L-1。AdCMVLacZ以MOI值50、100、500、1 000、5 000去感染DC, 发现随MOI值的增加,腺病毒的感染率也增高,但到达500以后,感染率增加得不明显。rmGM-CSF和rmIL-4培养DC至第9天,ELISA测定上清中的mIL-12含量为12.5 ng.L-1; AdCMVLacZ、AdCMVIL-12均以MOI 500感染DC,AdCMVLacZ感染DC 48 h后培养上清中mIL-12含量为15 ng.L-1, AdCMVIL-12感染DC 48 h后培养上清mIL-12含量达到(516.7±57.4) mg.L-1,表明重组腺病毒成功介导了mIL-12的转染。
, http://www.100md.com
2.4 混合淋巴细胞培养结果 混合淋巴细胞培养中,AdCMVIL-12感染的DC在浓度为每孔5×103和104时,3H-TdR的掺入值均比AdCMVLacZ感染的DC高,提示IL-12基因转染的DC具有更强的刺激T细胞增殖的能力,结果见图3。
3 讨论
DC由Steinmen和Cohn〔4〕于1973年首先发现,随着对其分化发育 、表面分型等方面研究的不断深入和开展,DC日趋成为人们关注的焦点。DC来源于骨髓的CD34+细胞,分布于除脑之外的所有器官、组织。虽然分布广泛但含量极少,比如在外周血中,DC的含量仅占白细胞的1/1 000〔5〕,所以体外扩增DC成为临床应用的第一个关键。近年来用

, 百拇医药
图3 重组腺病毒感染的DC混合淋巴细胞培养
细胞因子体外诱生DC获得成功,为DC的临床运用开辟了道路。研究者用GM-CSF、IL-4和TNF-α采取不同配伍,分别从外周血CD34+细胞、脐带血CD34+造血祖细胞及外周血单个核细胞诱导出具有DC形态和功能的细胞。Inaba等〔6〕将小鼠骨髓细胞用多种单抗以及补体去除淋巴细胞、粒细胞、巨噬细胞后,剩下的细胞加入GM-CSF培养1周,培养过程中反复去除粒细胞得到DC。我们在本实验中简化了这一操作过程,将分离出的小鼠骨髓单个核细胞,与rmGM-CSF和rmIL-4共同培养1周后,获得了大量带有典型形态的细胞,光镜及电镜观察都表明,这些细胞具有DC的特征,FACS检测DEC205阳性细胞可达50%以上,CD86的表达在60%以上。GM-CSF可以促进DC的增殖,而IL-4可以抑制巨噬细胞和粒细胞的生成。DC是以形态而得名,缺少B细胞、T细胞和NK细胞的标记,目前CD83多用于人成熟DC 的标记,DEC205被认为是小鼠DC的标记。
, 百拇医药
DC参与T细胞功能的多个方面,不仅参与混合淋巴细胞反应,促进细胞毒T细胞的形成,也参与T细胞对丝裂原的增殖反应〔7〕。DC能够促进naive CD4+ T细胞向Th1细胞分化, Kanangat和Kang〔8,9〕在人郎罕细胞和小鼠脾细胞的DC检测到IL-12 mRNA;Heufler等〔13〕用RIA法分别检测了小鼠脾脏和骨髓来源的DC,发现在未受刺激的情况下,来源于脾的DC培养上清中可检测到(8.4±4.8) ng.L-1的IL-12(P70),骨髓来源的DC培养上清中测到(6.4±4.3) ng.L-1水平的IL-12,经葡萄球菌(Staphyloccocus)刺激后,IL-12的分泌增加,可以上升到30 ng.L-1左右。为了提高DC对T细胞的刺激作用,我们尝试用 IL-12腺病毒载体转染自小鼠骨髓诱生的DC,培养上清中通过ELISA可以检测到高水平的IL-12, 同时转染细胞对混合淋巴细胞反应的刺激增强,提示IL-12转染的DC可能具有更强的激活T细胞的功能。虽然上述体外实验的结果表明IL-12的转染提高了DC的功能,但我们尚未取得体内实验的证据,有待于今后进一步探索。
, 百拇医药
作者简介:徐 彤,女,30岁,博士
参考文献
1,Shurin MR. Dendritic cells presenting tumor antigen.Cancer Immunol Immunother,1996;43(3):158~164
2,Gilboa E,Nair SK , Lyerly HK. Immunotherapy of cancer with dendritic cell based vaccines. Cancer Immunol Immunother, 1998;46(2):82~87
3,耿雨红,吴昊泉,应蓓蓓等. 带HSV-tk的重组腺病毒杀伤离体肺癌细胞的研究.复旦学报(自然科学版),1996;35(2):121~126
, 百拇医药
4,Steinman RM, Cohn ZA. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. J Exp Med,1973;137(5):1 142~1 162
5,Siena S ,Nicola MD,Boegni M et al. Massive ex vivo generation of functional dendritic cells from mobilized CD34+ blood progenitors for anticancer therapy. Exp Hematol, 1995;23(14):1 463~1 471
6,Inaba K, Inaba M,Romani N et al. Generation of large number of dendritic cells from mouse bone marrow cultures supplemented with GM-CSF. J Exp Med, 1992;176(6):1 693~1 702
, 百拇医药
7,Ni K, O'Neill HC. The role of dendritic cells in T cell activation. Immunol Cell Biol,1997;75(3):223~230
8,Kanangat S,Nair S, Babu JS et al. Expression of cytokine mRNA in murine splenic dendritic cells and better induction of T cell-derived cytokines by dendritic cells than by macrophages during in vitro costimulation assay using specific antigens. J Leukoc Biol,1995;57(2):310~316
9,Kang K,Kubin M, Cooper KD et al. IL-12 synthesis by human Langerhans cells. J Immunol, 1996;156(4):1 402~1 407
1999-05-01收稿
2000-01-05修回, 百拇医药