表没食子儿茶素没食子酸酯诱导大肠癌LoVo细胞凋亡和凋亡相关基因表达的改变
作者:谭晓华 周殿元 张亚历 姜泊
单位:510515 广州,第一军医大学南方医院消化内科研究所
关键词:
中华医学杂志/990430 表没食子儿茶素没食子酸酯[(-)-epigallocatechin gallate,EGCG]是儿茶素(catechins)中的一种主要单体,具有许多生物学效应,如抗肿瘤形成、清除自由基和抗氧化等作用[1]。我们用EGCG直接作用于体外培养的大肠癌LoVo细胞,发现有诱导该癌细胞凋亡的作用,其机制可能与bel-2基因和Bax基因表达改变有关。
一、材料与方法
1.主要试剂:EGCG(美国Sigma公司产品)用无血清的RPMI-1640培养液配制成质量浓度为1 mg/ml的储存液,0.22 μm的滤器过滤除菌,避光-20℃保存,用时根据需要稀释成不同浓度;MTT(Sigma)用磷酸盐缓冲液(PBS)配成5 mg/ml,过滤除菌后4 ℃避光保存;免疫组化试剂盒和bcl-2、Bax和增殖细胞核抗原(PCNA)单抗从北京中山公司购买。
, http://www.100md.com
2.细胞系:LoVo细胞体外用RPMI-1640(美国Gibco公司) 培养液(内含质量分数为15%小牛血清,100 U/ml的青、链霉素),置体积分数为5% CO2孵箱中培养。
3.MTT检测:取EGCG质量浓度梯度为1.0、5.0、10.0、20.0、40.0、60.0、80.0、100、200和400 μg/ml,参照文献[2]介绍的方法进行MTT检测。用酶标仪(METER TECH Σ960 Japan)测定各孔波长在570 nm的A值,根据公式(1-实验组A值/对照组A值)×100%计算抑制率。
4.TUNEL染色:按文献[3]介绍的方法进行。
5.琼脂糖凝胶电泳:EGCG(终质量浓度为100~300 μg/ml)处理对数生长期的LoVo细胞24小时,收集细胞,阴性对照为在培养瓶中加等体积无血清的RPMI-1640培养液。阳性对照为取2只4周龄的昆明小鼠在无菌下取胸腺制成细胞悬液,RPMI-1640培养液中加地塞米松(终浓度为10-5mol/L)培养6小时后收集细胞。DNA的提取和琼脂糖凝胶电泳按文献[4]介绍的方法进行。
, 百拇医药
6.流式细胞仪分析:分别用10、50和100 μg/ml的EGCG处理对数生长期的LoVo细胞24小时,用100 μg/ml的浓度处理LoVo细胞12和24小时后收集,参照文献[4]介绍的方法进行PI染色,在我校中心实验室流式细胞仪(Epics Elite,美国Coulter Corporation产品)检测亚二倍体峰和凋亡的定量分析。
7.免疫组织化学染色:用细胞爬片或细胞涂片进行免疫组化染色,按试剂盒提供的方法进行。各种单抗用PBS按1∶50比例稀释,二抗和链霉抗生物素蛋白标记的辣根过氧化酶用PBS按1∶150比例稀释。
8.统计学处理:半抑制率(IC50)通过第四军医大学SPLM2.3统计软件通过曲线拟合方法求得。
二、结果
1.MTT结果:结果如表1所示,EGCG对LoVo细胞抑制作用具有明显的剂量效应关系,其IC50值为111.71 μg/ml(第四军医大学SPLM2.3统计软件通过曲线拟合方法求得)。
, 百拇医药
表1 EGCG处理LoVo细胞24小时的抑制率*(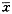 ±s) EGCG(μg/ml)
±s) EGCG(μg/ml)
抑制率(%)
1.0
2.0±0.4
5.0
2.9±0.3
10.0
4.4±0.5
20.0
6.6±0.7
, 百拇医药
40.0
19.2±1.8
60.0
38.4±1.0
80.0
42.8±1.5
100.0
51.1±2.8
200.0
86.8±1.7
400.0
90.9±0.9
, 百拇医药
* 3次独立实验结果
2.EGCG诱导LoVo细胞凋亡:EGCG(150 μg/ml)处理LoVo细胞24小时,TUNEL染色显示LoVo细胞发生典型的凋亡形态学改变:细胞核固缩、边集和碎裂以及凋亡小体的形成(图1)。此时提取其DNA行琼脂糖凝胶电泳可呈现凋亡细胞特征性的“梯状” 带(图2)。PI染色,流式细胞仪分析,结果显示:EGCG诱导LoVo细胞凋亡具有明显的时间和剂量效应关系,LoVo细胞的自发凋亡率为3.2%,用10、50和100 μg/ml的EGCG处理LoVo细胞24小时,凋亡率分别为5.9%、24.2%和34.3%,用100 μg/ml的EGCG处理LoVo细胞12小时,其凋亡率只有7.5%。
图1 EGCG(150 μg/ml)处理LoVo细胞后24小时,TUNEL染色示凋亡细胞显棕褐色着染,染色体边集(a),蓝色着染的是非凋亡细胞(b) ×200
, 百拇医药
图2 琼脂糖凝胶电泳:A.阳性对照组:小鼠胸腺细胞经地塞米松10-5mol/L处理后
6小时示“梯形”带;
B.非处理细胞基因组带;
C、D.EGCG(浓度分别300和100 μg/ml)处理LoVo细胞后24小时示“梯形”带
3.凋亡相关基因表达的改变:免疫组织化学染色显示,LoVo细胞在EGCG处理前,bcl-2基因和PCNA显阳性表达,而Bax基因则无表达或呈弱阳性;在EGCG(150 μg/ml)处理12小时后,Bax基因表达增强;24小时bcl-2基因和PCNA表达减弱(图3,4)。
图3 EGCG处理前,bcl-2基因在LoVo细胞胞浆中显阳性表达细胞爬片 ×400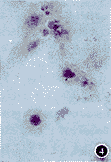
, 百拇医药
图4 EGCG(150 μg/ml)处理LoVo细胞24小时,bcl-2基因表达减弱细胞爬片 ×400
三、讨论
已经证实,EGCG能直接杀灭体内外生长的肿瘤细胞,其机制与其诱导肿瘤细胞凋亡有关[5]。我们用EGCG处理体外培养的大肠癌LoVo细胞,证实其具有诱导该细胞凋亡的作用,这在一定程度上可以解释流行病学研究中多饮茶的人群其大肠癌发生率较低的现象。EGCG诱导LoVo细胞凋亡的机制尚不明了,可能与EGCG引起凋亡相关基因表达改变有关。免疫组织化学结果显示,增殖细胞核抗原(PCNA)在用EGCG处理后其表达明显减弱,说明对LoVo细胞的增殖受到抑制;癌基因bel-2和其家族成员Bax基因表达发生相反的改变,EGCG处理后LoVo细胞中bel-2表达减弱而其Bax基因表达增强。bel-2基因家族是重要的凋亡相关基因,参与许多因素诱导细胞凋亡的调控机制。其家族成员中,bel-2是凋亡抑制基因,过量表达能抑制细胞凋亡;而Bax则是凋亡促进基因,过量表达能促进细胞的凋亡。两者常结合成异二聚体共同对细胞凋亡起调控作用[6]。bel-2与Bax的比率决定着细胞的命运,其比率增高,细胞不易发生凋亡,而比率降低则导致细胞凋亡。本实验研究表明,引起bel-2基因表达下降而Bax基因表达增强可能是EGCG诱导LoVo细胞凋亡的机制之一。
, 百拇医药
本课题为军队“九五”攻关课题基金资助项目(962028)
参考文献
[1] Yang CS, Wang ZY. Tea and cancer. J Natl Cancer Inst,1993,85:1038-1049.
[2] 马瑾瑜, 顾映红, 余竹元. 用快速比色计量法测量细胞生长. 上海医科大学学报, 1993,20:309-311.
[3] 谭晓华, 周殿元, 姜泊, 等. 两种原位DNA断链标记技术检测组织切片和培养细胞中的凋亡细胞. 中华医学检验杂志, 1998,21:278-282.
[4] 张亚历, 姜泊, 周殿元. 程序化细胞死亡常用研究方法. 见: 姜泊等,主编. 分子生物学用实验方法.北京:人民军医出版社,1996; 170.
, http://www.100md.com
[5] Hibasami H, Achiwa Y, Fujikawa T, et al. Induction of programmed cell death (apoptosis) in human lymphoid leukemia cells by catechin compounds. Anticancer Res,1996,16:1943-1946.
[6] Oltvai ZN, Milliman CL. and Korsmeyer SJ. Bcl-2 heterodimerizes in vivo with a conserved homolog, Bax, that accelerates programmed cell death. Cell,1993,74:609-619.
(收稿:1998-02-6 修回:1999-01-04), http://www.100md.com
单位:510515 广州,第一军医大学南方医院消化内科研究所
关键词:
中华医学杂志/990430 表没食子儿茶素没食子酸酯[(-)-epigallocatechin gallate,EGCG]是儿茶素(catechins)中的一种主要单体,具有许多生物学效应,如抗肿瘤形成、清除自由基和抗氧化等作用[1]。我们用EGCG直接作用于体外培养的大肠癌LoVo细胞,发现有诱导该癌细胞凋亡的作用,其机制可能与bel-2基因和Bax基因表达改变有关。
一、材料与方法
1.主要试剂:EGCG(美国Sigma公司产品)用无血清的RPMI-1640培养液配制成质量浓度为1 mg/ml的储存液,0.22 μm的滤器过滤除菌,避光-20℃保存,用时根据需要稀释成不同浓度;MTT(Sigma)用磷酸盐缓冲液(PBS)配成5 mg/ml,过滤除菌后4 ℃避光保存;免疫组化试剂盒和bcl-2、Bax和增殖细胞核抗原(PCNA)单抗从北京中山公司购买。
, http://www.100md.com
2.细胞系:LoVo细胞体外用RPMI-1640(美国Gibco公司) 培养液(内含质量分数为15%小牛血清,100 U/ml的青、链霉素),置体积分数为5% CO2孵箱中培养。
3.MTT检测:取EGCG质量浓度梯度为1.0、5.0、10.0、20.0、40.0、60.0、80.0、100、200和400 μg/ml,参照文献[2]介绍的方法进行MTT检测。用酶标仪(METER TECH Σ960 Japan)测定各孔波长在570 nm的A值,根据公式(1-实验组A值/对照组A值)×100%计算抑制率。
4.TUNEL染色:按文献[3]介绍的方法进行。
5.琼脂糖凝胶电泳:EGCG(终质量浓度为100~300 μg/ml)处理对数生长期的LoVo细胞24小时,收集细胞,阴性对照为在培养瓶中加等体积无血清的RPMI-1640培养液。阳性对照为取2只4周龄的昆明小鼠在无菌下取胸腺制成细胞悬液,RPMI-1640培养液中加地塞米松(终浓度为10-5mol/L)培养6小时后收集细胞。DNA的提取和琼脂糖凝胶电泳按文献[4]介绍的方法进行。
, 百拇医药
6.流式细胞仪分析:分别用10、50和100 μg/ml的EGCG处理对数生长期的LoVo细胞24小时,用100 μg/ml的浓度处理LoVo细胞12和24小时后收集,参照文献[4]介绍的方法进行PI染色,在我校中心实验室流式细胞仪(Epics Elite,美国Coulter Corporation产品)检测亚二倍体峰和凋亡的定量分析。
7.免疫组织化学染色:用细胞爬片或细胞涂片进行免疫组化染色,按试剂盒提供的方法进行。各种单抗用PBS按1∶50比例稀释,二抗和链霉抗生物素蛋白标记的辣根过氧化酶用PBS按1∶150比例稀释。
8.统计学处理:半抑制率(IC50)通过第四军医大学SPLM2.3统计软件通过曲线拟合方法求得。
二、结果
1.MTT结果:结果如表1所示,EGCG对LoVo细胞抑制作用具有明显的剂量效应关系,其IC50值为111.71 μg/ml(第四军医大学SPLM2.3统计软件通过曲线拟合方法求得)。
, 百拇医药
表1 EGCG处理LoVo细胞24小时的抑制率*(
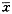 ±s) EGCG(μg/ml)
±s) EGCG(μg/ml)抑制率(%)
1.0
2.0±0.4
5.0
2.9±0.3
10.0
4.4±0.5
20.0
6.6±0.7
, 百拇医药
40.0
19.2±1.8
60.0
38.4±1.0
80.0
42.8±1.5
100.0
51.1±2.8
200.0
86.8±1.7
400.0
90.9±0.9
, 百拇医药
* 3次独立实验结果
2.EGCG诱导LoVo细胞凋亡:EGCG(150 μg/ml)处理LoVo细胞24小时,TUNEL染色显示LoVo细胞发生典型的凋亡形态学改变:细胞核固缩、边集和碎裂以及凋亡小体的形成(图1)。此时提取其DNA行琼脂糖凝胶电泳可呈现凋亡细胞特征性的“梯状” 带(图2)。PI染色,流式细胞仪分析,结果显示:EGCG诱导LoVo细胞凋亡具有明显的时间和剂量效应关系,LoVo细胞的自发凋亡率为3.2%,用10、50和100 μg/ml的EGCG处理LoVo细胞24小时,凋亡率分别为5.9%、24.2%和34.3%,用100 μg/ml的EGCG处理LoVo细胞12小时,其凋亡率只有7.5%。

图1 EGCG(150 μg/ml)处理LoVo细胞后24小时,TUNEL染色示凋亡细胞显棕褐色着染,染色体边集(a),蓝色着染的是非凋亡细胞(b) ×200

, 百拇医药
图2 琼脂糖凝胶电泳:A.阳性对照组:小鼠胸腺细胞经地塞米松10-5mol/L处理后
6小时示“梯形”带;
B.非处理细胞基因组带;
C、D.EGCG(浓度分别300和100 μg/ml)处理LoVo细胞后24小时示“梯形”带
3.凋亡相关基因表达的改变:免疫组织化学染色显示,LoVo细胞在EGCG处理前,bcl-2基因和PCNA显阳性表达,而Bax基因则无表达或呈弱阳性;在EGCG(150 μg/ml)处理12小时后,Bax基因表达增强;24小时bcl-2基因和PCNA表达减弱(图3,4)。

图3 EGCG处理前,bcl-2基因在LoVo细胞胞浆中显阳性表达细胞爬片 ×400

, 百拇医药
图4 EGCG(150 μg/ml)处理LoVo细胞24小时,bcl-2基因表达减弱细胞爬片 ×400
三、讨论
已经证实,EGCG能直接杀灭体内外生长的肿瘤细胞,其机制与其诱导肿瘤细胞凋亡有关[5]。我们用EGCG处理体外培养的大肠癌LoVo细胞,证实其具有诱导该细胞凋亡的作用,这在一定程度上可以解释流行病学研究中多饮茶的人群其大肠癌发生率较低的现象。EGCG诱导LoVo细胞凋亡的机制尚不明了,可能与EGCG引起凋亡相关基因表达改变有关。免疫组织化学结果显示,增殖细胞核抗原(PCNA)在用EGCG处理后其表达明显减弱,说明对LoVo细胞的增殖受到抑制;癌基因bel-2和其家族成员Bax基因表达发生相反的改变,EGCG处理后LoVo细胞中bel-2表达减弱而其Bax基因表达增强。bel-2基因家族是重要的凋亡相关基因,参与许多因素诱导细胞凋亡的调控机制。其家族成员中,bel-2是凋亡抑制基因,过量表达能抑制细胞凋亡;而Bax则是凋亡促进基因,过量表达能促进细胞的凋亡。两者常结合成异二聚体共同对细胞凋亡起调控作用[6]。bel-2与Bax的比率决定着细胞的命运,其比率增高,细胞不易发生凋亡,而比率降低则导致细胞凋亡。本实验研究表明,引起bel-2基因表达下降而Bax基因表达增强可能是EGCG诱导LoVo细胞凋亡的机制之一。
, 百拇医药
本课题为军队“九五”攻关课题基金资助项目(962028)
参考文献
[1] Yang CS, Wang ZY. Tea and cancer. J Natl Cancer Inst,1993,85:1038-1049.
[2] 马瑾瑜, 顾映红, 余竹元. 用快速比色计量法测量细胞生长. 上海医科大学学报, 1993,20:309-311.
[3] 谭晓华, 周殿元, 姜泊, 等. 两种原位DNA断链标记技术检测组织切片和培养细胞中的凋亡细胞. 中华医学检验杂志, 1998,21:278-282.
[4] 张亚历, 姜泊, 周殿元. 程序化细胞死亡常用研究方法. 见: 姜泊等,主编. 分子生物学用实验方法.北京:人民军医出版社,1996; 170.
, http://www.100md.com
[5] Hibasami H, Achiwa Y, Fujikawa T, et al. Induction of programmed cell death (apoptosis) in human lymphoid leukemia cells by catechin compounds. Anticancer Res,1996,16:1943-1946.
[6] Oltvai ZN, Milliman CL. and Korsmeyer SJ. Bcl-2 heterodimerizes in vivo with a conserved homolog, Bax, that accelerates programmed cell death. Cell,1993,74:609-619.
(收稿:1998-02-6 修回:1999-01-04), http://www.100md.com