采用流式细胞术检测血小板微粒及其临床应用的初探
作者:马文新 崔巍 侯百东 林其燧
单位:马文新(中国医学科学院 中国协和医科大学 北京协和医院检验科) ;崔巍(中国医学科学院 中国协和医科大学 北京协和医院检验科);侯百东(加强医疗病房,北京100730);林其燧(中国医学科学院 中国协和医科大学 北京协和医院检验科)
关键词:血小板微粒;活化血小板;流式细胞术
基础医学与临床000531
摘要 :本研究应用流式细胞仪(FCM),以3mm和0.8mm的标准微球作内参对照,建立了血小板微粒(PMPs)的定量检测方法,并对其临床应用进行了初步研究。结果表明 :30例健康人静止血小板释放的PMPs为1.2×105±5.7×104 /mL,活化血小板释放的PMPs为1.6×106±9.1×105/mL;18例冠心病(CAD)、12例急性脑梗塞(ACI)和23例慢性肾功衰竭(CRF)患者血浆中PMPs较对照组明显增高(P<0.001),分别为6.1×105±2.5×105 /mL、6.8×105±3.4×105/mL和5.9×105±3.1×105/mL,而25例急性白血病(AL)化疗后伴严重血小板减少者的PMPs 增高不明显,为1.3×105±6.1×104/mL。提示 :PMPs是监测血小板活化、预测和诊断血栓性疾病的一个重要指标,采用FCM内参定位法可以准确而快速地定量分析PMPs,有利于实验结果的室间比较和检测方法的标准化。
, http://www.100md.com
中图分类号 :R331.1+42 文献标识码 :A
文章编号:1001-6325(2000)05-0090-04
Detection of platelet-derived microparticles using flow cytometry
and its clinical significance.
MA Wen-xin, CUI Wei, HOU Bai-dong,et al
( Dept. of Clinical Laboratory, Peking Union Hospital, CAMS and PUMC,Beijing 100730,China)
Abstract : The purpose of this study is to establish a flow cytometric internal standard method for counting platelet-derived microparticles (PMPs) and to study its clinical significance. PMP suspensions (platelet free plasma, PFP) were extracted by means of sequential centrifugation. Based on PMP size, 3mm and 0.8mm latex beads were used as internal standards for its quantition. PMPs were counted after adjusting flow cytometric discrimination and voltage of forward scatter and side scatter. In 30 healthy donors, the resting PMPs were 1.2×105±5.7×104 /mL and actived PMPs were 1.6×106±9.1×105/mL. Compared with that in healthy donors, PMPs mean number significantly rose (P<0.001) in 18 patients with coronary artery disease, 12 patients with acute cerebral infraction and 23 patients with chronic renal failure.The numbers were 6.1×105±2.5×105 /mL, 6.8×105±3.4×105/mL and 5.9×105±3.1×105/mL respectively .No change was observed in 25 patients with acute leukemias or with severe thrombocytopenia during the aplastic phase following chemotherapy.The PMP number was 1.3×105±6.1×104/mL . We conclude that PMPs is a useful parameter for monitoring platelet activation, which might play an important role in thrombotic disease and that by internal standard method flow cytometer counts PMPs rapidly and accurately, which may be helpful in interlaboratory comparative studies.
, 百拇医药
Key words : platelet microparticles;platelet activation;flow cytometry
血小板微粒(PMPs)是血小板被激活后从质膜上脱落进入外周循环的细小微粒。由于PMPs可表达血小板特异性膜糖蛋白并富含凝血因子膜受体,可为凝血酶原反应提供催化表面,所以在止血和血栓形成中发挥重要作用[1]。大量研究证明[2~4],PMPs是监测血栓性疾病的重要指标。目前,对于PMPs在血小板活化中的作用的研究越来越受到重视。但是,由于PMPs极小(直径大约为0.03-1mm)[5],常规方法的灵敏度和分辨率不够,使得PMPs的检测受到限制。本研究首次采用流式细胞术(FCM)内参定位法结合免疫荧光技术,建立了PMPs的定量检测方法,并对其临床应用进行了初步研究。
1 材料和方法
, http://www.100md.com 1.1 研究对象
78例患者来自北京协和医院和北京市其它医院住院和门诊病人,其中急性脑梗塞(ACI)12例,冠心病(CAD)18例(心绞痛8例,急性心肌梗塞10例),慢性肾功能衰竭(CRF)23例,急性白血病(AL)化疗后伴严重血小板减少者25例,年龄5~76岁,均未用过抗凝治疗。30例健康对照均为本院健康献血员,年龄为20~45岁。
1.2 仪器和材料
Coulter EPICS 流式细胞仪为美国Beckman Coulter公司产品,MEK-6108K型血球分析仪为日本光电公司产品,标准微球(直径为3mm和0.8mm)为Sigma公司产品,异硫氰荧光素(FITC)标记的抗血小板膜糖蛋白GPa(FITC-CD61)和枸橼酸钠抗凝的采血管为Beckon Dickinson公司产品,凝血酶和胶原等由本院药剂科提供。
1.3. 标本制备
, 百拇医药
1.3.1富含血小板血浆(PRP):抽取清晨空腹静息状态下静脉血2.7mL,以枸橼酸钠抗凝,轻轻混匀后迅速低速离心(70g)5 min,分离PRP。
1.3.2固定静止血小板悬液:以终浓度为1%的多聚甲醛(PFA)固定PRP,室温孵育5 min。
1.3.3 无血小板血浆(PFP,血小板微粒悬液):固定后的PRP在1 500g离心15 min,取上清液,再经3 500g离心15 min,分离上清液,此悬液通过血细胞分析仪计数,确认血小板数为零。
1.3.4阳性对照(体外诱导血小板释放PMPs):用磷酸盐缓冲液(PBS)调整未经固定的PRP中血小板浓度达300×109/L,加入凝血酶,胶原和氯化钙(终浓度分别为0.1NIH U/mL,10mg/L和2mmol/L),37℃孵育10 min,然后进行第2步和第3步。
, http://www.100md.com 1.4 PMPs免疫荧光标记
取30mL PFP加入20mL FITC-CD61(阴性对照加入等量的同型鼠IgG),4℃避光孵育30min,加入1.5mL PBS待测。上机前加入直径为3mm 和0.8mm的标准微球各1×105。
1.5 定位对照
每次测定前取一个仅含1.5mL PBS的试管,加入直径为3mm 和0.8mm的标准微球各1×105作为定位对照。
以上各步骤所用的PBS和PFA均经0.22mm的滤器过滤,所用试管和移液管头均为高压灭菌的塑料管。
1.6 FCM测定
1.6.1采用DNA-CHECK校准仪器光路,使之处于最佳状态(变异系数<2%)。
, http://www.100md.com
1.6.2 建立前向角光散射对侧向角光散射双对数散点图(FSC LOG-SSC LOG):根据定位对照调整仪器的检测阈值,SSC的阈值被调至200, FSC的增益和电压分别被调至100和1000,在此条件下收集和分析的信号均由PMPs和标准微球产生,并在同一条件下测定一管仅含去离子水的空白对照,以此验证仪器噪音信号的干扰程度。
1.6.3 收集3mm 标准微球2×104,通过FITC荧光直方图计算位于0.8mm标准微球区域内PMPs的表达绝对量,以C来表示。(见图1)
图 1 采用流式细胞术对血小板微粒PMPs 定量分析的测定图
Fig 1 Flow cytometric quantitation of PMPs
a.PMPs determination on FSC LOG and SSC LOG dot plot.FSC LOG:logarithmic forward scatter,SSC LOG:logarithmic side-
, http://www.100md.com
scatter,G:gate.Gate A was deigned by 0.8 m m latex beads.Gate B was defined by 3 m m beads.b.Fluorescence LOG and SSC LOG
dot plot of resting platelet-derived PMPs quantitation.c.Fluorescence LOG and SSC LOG dot plot of actived platelet-derived
PMPs quantitation.
1.7 计算公式
根据以下公式计算每mL血浆中含有的PMPs的绝对量,以N来表示。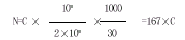
, 百拇医药
2 结果
2.1仪器噪音对PMPs测定的影响
通过SSC阈值的设定和FCS增益和电压的调整,定位对照中3mm和0.8mm的微球清楚而完全地分布在FSC LOG-SSC LOG散点图中,在此条件下,所测定的空白对照标本中的粒子数<5个/s,而PFP标本的粒子数为600~800个/s,因此噪音干扰可忽略。
2.2 静息血小板释放的PMPs量
30例健康对照和78例患者静息血小板释放的PMPs量见表1。
2.3 活化血小板释放的PMPs量
从健康人静止血小板和诱导剂激活血小板释放PMPs的荧光散点图(如图1b-c)可见:静止血小板释放的PMPs较低,而活化血小板释放的PMPs显著增高。本研究将体外诱导血小板活化释放PMPs作为阳性对照。30例健康人静息血小板释放的PMPs为1.2×105±5.7×104/mL血浆 ,而活化血小板释放的PMPs为1.6×106±9.1×105/mL血浆。
, http://www.100md.com
表1 静息血小板释放的PMPs 量
Table 1 Resting platelet-derived PMPs quantitation (particles /mL plasma) PMPs(particles/mLplasma)
Control(n=30)
CAD(n=18)
ACI(n=12)
CRF(n=23)
AL(n=25)
1.2×105+5.7×104
6.1×105+2.5×105*
, 百拇医药
6.8×105+3.4×105*
5.9×105+3.1×105*
1.3×105+6.1×104
3 讨论
PMPs是活化血小板释放的极小微粒,它携带多种血小板膜糖蛋白,如GPIb、GPIIb和GPa,并可以促进血小板聚集和加速凝血过程,有重要的促凝活性。实验证明[1],PMPs与血小板活化后磷脂酰丝氨酸暴露于质膜表面,导致血小板膜磷脂不对称性消失密切相关,这为研究止血和血栓形成等多种生理病理过程提供了重要指标。
例如,处于高凝状态的心肺搭桥患者,其血液中PMPs明显增高,这与凝血酶诱导的体内血小板活化和血流通过人工装置发生的体外血小板活化密切相关[2]。特发性血小板减少性紫癜(ITP)患者血液中PMPs较正常人高,无出血症状时高于有出血症状时,有神经系统并发症者(如阵发性脑缺血发作、四肢麻木等)PMPs增高更明显。血栓性血小板减少性紫癜(TTP)、溶血性尿毒症综合症(HUS)、肝素诱导的血小板减少症(HIT)和播散性血管内凝血(DIC)均存在着血管内血小板活化,极易形成血栓,因此与ITP一样表现有外周血小板减少和PMPs增高[4]。
, http://www.100md.com
虽然PMPs对研究出血和血栓性疾病有着重要作用,但目前为止,国内尚无人报道PMPs的检测方法。这主要是由于PMPs体积过小,除FCM外目前还没有更好的方法能直接对PMPs进行定量分析。
既往,FCM检测PMPs常采用PRP或全血法[4],这些方法均以相对单位表示PMPs的表达量,不利于实验结果的室间比较。而且,由于PMPs携带与血小板相同的膜糖蛋白,无法排除血小板对PMPs的干扰。本研究采用渐进性离心法制备标本,检测PFP中的 PMPs。首先,以70g低速离心制备PRP,随后对其固定,以防止在后续的标本处理过程中引起血小板活化,人为造成PMPs增多;然后1500g离心制备贫血小板血浆(PPP);最后用3500g高速离心,去除残存血小板和其它细胞碎片得到PFP,从而排除血小板对PMPs的干扰。
由于PMPs极小,即使是高分辨的FCM,如果仪器调整和设置不当,也难以排除仪器噪音的干扰。为解决这一问题,我们采用直径为3mm和0.8mm两种微球作为内参对照。0.8mm微球用于PMPs的定位;3mm微球有两个作用,一是帮助PMPs的定位,二是通过定量收集3mm微球(2×104),可对PMPs进行定量分析。
, http://www.100md.com
我们应用以上方法进行PMPs的检测,以凝血酶和胶原作为诱导剂激活血小板,活化血小板释放的PMPs量显著高于静止血小板,证明了PMPs可作为监测血小板活化的一项重要指标。对多种临床病例的检测结果发现,CAD和ACI患者血液中PMPs较对照组明显增高,CRF次之,AL伴有血小板明显减少者增高不明显。这是因为CAD和ACI均为明确的血栓性疾病,它们与血小板活化所致的血小板粘附性和聚集性增高密切相关;CRF患者血小板功能较差,常伴有包括肾小动脉在内的全身小动脉硬化,加之有毒物质所致的血液高凝状态,极易发生血管内血栓形成,所以CRF患者血液中PMPs增高可预示血栓形成倾向;而AL化疗后血小板减少虽然非常明显,易发生出血,但无一例伴有血栓形成,因此PMPs与正常相比增高不明显。
综上所述,PMPs是监测血小板活化、预测和诊断血栓性疾病的一个重要指标。采用FCM内参定位法可以准确而快速地定量分析PMPs,克服了以往相对单位表示法的缺点,有利于实验结果的室间比较和检测方法的标准化。
, 百拇医药
参考文献:
[1] Horstman LL, Ahn YS.Platelet microparticles: a wide-angle perspective[J].Crit Rev Oncol Hematol, 1999, 30: 111-142.
[2] Nieuwland R, Berckmans RJ, Rotteveel-Eijkman RC, et al. Cell-derived microparticles generated in patiets during cardiopulmonary bypass are highly procoagulant[J]. Circulation, 1997, 96: 3534-3541.
[3] 韩锐. 流式细胞仪在血栓与出血性疾病诊断中的意义[J].国外医学 :输血及血液学分册, 1998, 22: 284-287.
, 百拇医药
[4] Galli M, Grassi A, Barbui T. Platelet-derived microvesicles in thrombotic thrombocytopenic purpura and hemolytic uremic Syndrome[j].Thrombo and Haemost,1996,75: 427-431.
[5] Combes V, Simon AC, Grau GE, et al. In vitro generation of endothelial microparticles and possible prothrombotic activity in patients with lupus anticoagulant[J].J Clin Invest, 1999, 104 : 93-102.
2000-03-23
2000-04-06, 百拇医药
单位:马文新(中国医学科学院 中国协和医科大学 北京协和医院检验科) ;崔巍(中国医学科学院 中国协和医科大学 北京协和医院检验科);侯百东(加强医疗病房,北京100730);林其燧(中国医学科学院 中国协和医科大学 北京协和医院检验科)
关键词:血小板微粒;活化血小板;流式细胞术
基础医学与临床000531
摘要 :本研究应用流式细胞仪(FCM),以3mm和0.8mm的标准微球作内参对照,建立了血小板微粒(PMPs)的定量检测方法,并对其临床应用进行了初步研究。结果表明 :30例健康人静止血小板释放的PMPs为1.2×105±5.7×104 /mL,活化血小板释放的PMPs为1.6×106±9.1×105/mL;18例冠心病(CAD)、12例急性脑梗塞(ACI)和23例慢性肾功衰竭(CRF)患者血浆中PMPs较对照组明显增高(P<0.001),分别为6.1×105±2.5×105 /mL、6.8×105±3.4×105/mL和5.9×105±3.1×105/mL,而25例急性白血病(AL)化疗后伴严重血小板减少者的PMPs 增高不明显,为1.3×105±6.1×104/mL。提示 :PMPs是监测血小板活化、预测和诊断血栓性疾病的一个重要指标,采用FCM内参定位法可以准确而快速地定量分析PMPs,有利于实验结果的室间比较和检测方法的标准化。
, http://www.100md.com
中图分类号 :R331.1+42 文献标识码 :A
文章编号:1001-6325(2000)05-0090-04
Detection of platelet-derived microparticles using flow cytometry
and its clinical significance.
MA Wen-xin, CUI Wei, HOU Bai-dong,et al
( Dept. of Clinical Laboratory, Peking Union Hospital, CAMS and PUMC,Beijing 100730,China)
Abstract : The purpose of this study is to establish a flow cytometric internal standard method for counting platelet-derived microparticles (PMPs) and to study its clinical significance. PMP suspensions (platelet free plasma, PFP) were extracted by means of sequential centrifugation. Based on PMP size, 3mm and 0.8mm latex beads were used as internal standards for its quantition. PMPs were counted after adjusting flow cytometric discrimination and voltage of forward scatter and side scatter. In 30 healthy donors, the resting PMPs were 1.2×105±5.7×104 /mL and actived PMPs were 1.6×106±9.1×105/mL. Compared with that in healthy donors, PMPs mean number significantly rose (P<0.001) in 18 patients with coronary artery disease, 12 patients with acute cerebral infraction and 23 patients with chronic renal failure.The numbers were 6.1×105±2.5×105 /mL, 6.8×105±3.4×105/mL and 5.9×105±3.1×105/mL respectively .No change was observed in 25 patients with acute leukemias or with severe thrombocytopenia during the aplastic phase following chemotherapy.The PMP number was 1.3×105±6.1×104/mL . We conclude that PMPs is a useful parameter for monitoring platelet activation, which might play an important role in thrombotic disease and that by internal standard method flow cytometer counts PMPs rapidly and accurately, which may be helpful in interlaboratory comparative studies.
, 百拇医药
Key words : platelet microparticles;platelet activation;flow cytometry
血小板微粒(PMPs)是血小板被激活后从质膜上脱落进入外周循环的细小微粒。由于PMPs可表达血小板特异性膜糖蛋白并富含凝血因子膜受体,可为凝血酶原反应提供催化表面,所以在止血和血栓形成中发挥重要作用[1]。大量研究证明[2~4],PMPs是监测血栓性疾病的重要指标。目前,对于PMPs在血小板活化中的作用的研究越来越受到重视。但是,由于PMPs极小(直径大约为0.03-1mm)[5],常规方法的灵敏度和分辨率不够,使得PMPs的检测受到限制。本研究首次采用流式细胞术(FCM)内参定位法结合免疫荧光技术,建立了PMPs的定量检测方法,并对其临床应用进行了初步研究。
1 材料和方法
, http://www.100md.com 1.1 研究对象
78例患者来自北京协和医院和北京市其它医院住院和门诊病人,其中急性脑梗塞(ACI)12例,冠心病(CAD)18例(心绞痛8例,急性心肌梗塞10例),慢性肾功能衰竭(CRF)23例,急性白血病(AL)化疗后伴严重血小板减少者25例,年龄5~76岁,均未用过抗凝治疗。30例健康对照均为本院健康献血员,年龄为20~45岁。
1.2 仪器和材料
Coulter EPICS 流式细胞仪为美国Beckman Coulter公司产品,MEK-6108K型血球分析仪为日本光电公司产品,标准微球(直径为3mm和0.8mm)为Sigma公司产品,异硫氰荧光素(FITC)标记的抗血小板膜糖蛋白GPa(FITC-CD61)和枸橼酸钠抗凝的采血管为Beckon Dickinson公司产品,凝血酶和胶原等由本院药剂科提供。
1.3. 标本制备
, 百拇医药
1.3.1富含血小板血浆(PRP):抽取清晨空腹静息状态下静脉血2.7mL,以枸橼酸钠抗凝,轻轻混匀后迅速低速离心(70g)5 min,分离PRP。
1.3.2固定静止血小板悬液:以终浓度为1%的多聚甲醛(PFA)固定PRP,室温孵育5 min。
1.3.3 无血小板血浆(PFP,血小板微粒悬液):固定后的PRP在1 500g离心15 min,取上清液,再经3 500g离心15 min,分离上清液,此悬液通过血细胞分析仪计数,确认血小板数为零。
1.3.4阳性对照(体外诱导血小板释放PMPs):用磷酸盐缓冲液(PBS)调整未经固定的PRP中血小板浓度达300×109/L,加入凝血酶,胶原和氯化钙(终浓度分别为0.1NIH U/mL,10mg/L和2mmol/L),37℃孵育10 min,然后进行第2步和第3步。
, http://www.100md.com 1.4 PMPs免疫荧光标记
取30mL PFP加入20mL FITC-CD61(阴性对照加入等量的同型鼠IgG),4℃避光孵育30min,加入1.5mL PBS待测。上机前加入直径为3mm 和0.8mm的标准微球各1×105。
1.5 定位对照
每次测定前取一个仅含1.5mL PBS的试管,加入直径为3mm 和0.8mm的标准微球各1×105作为定位对照。
以上各步骤所用的PBS和PFA均经0.22mm的滤器过滤,所用试管和移液管头均为高压灭菌的塑料管。
1.6 FCM测定
1.6.1采用DNA-CHECK校准仪器光路,使之处于最佳状态(变异系数<2%)。
, http://www.100md.com
1.6.2 建立前向角光散射对侧向角光散射双对数散点图(FSC LOG-SSC LOG):根据定位对照调整仪器的检测阈值,SSC的阈值被调至200, FSC的增益和电压分别被调至100和1000,在此条件下收集和分析的信号均由PMPs和标准微球产生,并在同一条件下测定一管仅含去离子水的空白对照,以此验证仪器噪音信号的干扰程度。
1.6.3 收集3mm 标准微球2×104,通过FITC荧光直方图计算位于0.8mm标准微球区域内PMPs的表达绝对量,以C来表示。(见图1)

图 1 采用流式细胞术对血小板微粒PMPs 定量分析的测定图
Fig 1 Flow cytometric quantitation of PMPs
a.PMPs determination on FSC LOG and SSC LOG dot plot.FSC LOG:logarithmic forward scatter,SSC LOG:logarithmic side-
, http://www.100md.com
scatter,G:gate.Gate A was deigned by 0.8 m m latex beads.Gate B was defined by 3 m m beads.b.Fluorescence LOG and SSC LOG
dot plot of resting platelet-derived PMPs quantitation.c.Fluorescence LOG and SSC LOG dot plot of actived platelet-derived
PMPs quantitation.
1.7 计算公式
根据以下公式计算每mL血浆中含有的PMPs的绝对量,以N来表示。
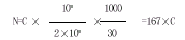
, 百拇医药
2 结果
2.1仪器噪音对PMPs测定的影响
通过SSC阈值的设定和FCS增益和电压的调整,定位对照中3mm和0.8mm的微球清楚而完全地分布在FSC LOG-SSC LOG散点图中,在此条件下,所测定的空白对照标本中的粒子数<5个/s,而PFP标本的粒子数为600~800个/s,因此噪音干扰可忽略。
2.2 静息血小板释放的PMPs量
30例健康对照和78例患者静息血小板释放的PMPs量见表1。
2.3 活化血小板释放的PMPs量
从健康人静止血小板和诱导剂激活血小板释放PMPs的荧光散点图(如图1b-c)可见:静止血小板释放的PMPs较低,而活化血小板释放的PMPs显著增高。本研究将体外诱导血小板活化释放PMPs作为阳性对照。30例健康人静息血小板释放的PMPs为1.2×105±5.7×104/mL血浆 ,而活化血小板释放的PMPs为1.6×106±9.1×105/mL血浆。
, http://www.100md.com
表1 静息血小板释放的PMPs 量
Table 1 Resting platelet-derived PMPs quantitation (particles /mL plasma) PMPs(particles/mLplasma)
Control(n=30)
CAD(n=18)
ACI(n=12)
CRF(n=23)
AL(n=25)
1.2×105+5.7×104
6.1×105+2.5×105*
, 百拇医药
6.8×105+3.4×105*
5.9×105+3.1×105*
1.3×105+6.1×104
3 讨论
PMPs是活化血小板释放的极小微粒,它携带多种血小板膜糖蛋白,如GPIb、GPIIb和GPa,并可以促进血小板聚集和加速凝血过程,有重要的促凝活性。实验证明[1],PMPs与血小板活化后磷脂酰丝氨酸暴露于质膜表面,导致血小板膜磷脂不对称性消失密切相关,这为研究止血和血栓形成等多种生理病理过程提供了重要指标。
例如,处于高凝状态的心肺搭桥患者,其血液中PMPs明显增高,这与凝血酶诱导的体内血小板活化和血流通过人工装置发生的体外血小板活化密切相关[2]。特发性血小板减少性紫癜(ITP)患者血液中PMPs较正常人高,无出血症状时高于有出血症状时,有神经系统并发症者(如阵发性脑缺血发作、四肢麻木等)PMPs增高更明显。血栓性血小板减少性紫癜(TTP)、溶血性尿毒症综合症(HUS)、肝素诱导的血小板减少症(HIT)和播散性血管内凝血(DIC)均存在着血管内血小板活化,极易形成血栓,因此与ITP一样表现有外周血小板减少和PMPs增高[4]。
, http://www.100md.com
虽然PMPs对研究出血和血栓性疾病有着重要作用,但目前为止,国内尚无人报道PMPs的检测方法。这主要是由于PMPs体积过小,除FCM外目前还没有更好的方法能直接对PMPs进行定量分析。
既往,FCM检测PMPs常采用PRP或全血法[4],这些方法均以相对单位表示PMPs的表达量,不利于实验结果的室间比较。而且,由于PMPs携带与血小板相同的膜糖蛋白,无法排除血小板对PMPs的干扰。本研究采用渐进性离心法制备标本,检测PFP中的 PMPs。首先,以70g低速离心制备PRP,随后对其固定,以防止在后续的标本处理过程中引起血小板活化,人为造成PMPs增多;然后1500g离心制备贫血小板血浆(PPP);最后用3500g高速离心,去除残存血小板和其它细胞碎片得到PFP,从而排除血小板对PMPs的干扰。
由于PMPs极小,即使是高分辨的FCM,如果仪器调整和设置不当,也难以排除仪器噪音的干扰。为解决这一问题,我们采用直径为3mm和0.8mm两种微球作为内参对照。0.8mm微球用于PMPs的定位;3mm微球有两个作用,一是帮助PMPs的定位,二是通过定量收集3mm微球(2×104),可对PMPs进行定量分析。
, http://www.100md.com
我们应用以上方法进行PMPs的检测,以凝血酶和胶原作为诱导剂激活血小板,活化血小板释放的PMPs量显著高于静止血小板,证明了PMPs可作为监测血小板活化的一项重要指标。对多种临床病例的检测结果发现,CAD和ACI患者血液中PMPs较对照组明显增高,CRF次之,AL伴有血小板明显减少者增高不明显。这是因为CAD和ACI均为明确的血栓性疾病,它们与血小板活化所致的血小板粘附性和聚集性增高密切相关;CRF患者血小板功能较差,常伴有包括肾小动脉在内的全身小动脉硬化,加之有毒物质所致的血液高凝状态,极易发生血管内血栓形成,所以CRF患者血液中PMPs增高可预示血栓形成倾向;而AL化疗后血小板减少虽然非常明显,易发生出血,但无一例伴有血栓形成,因此PMPs与正常相比增高不明显。
综上所述,PMPs是监测血小板活化、预测和诊断血栓性疾病的一个重要指标。采用FCM内参定位法可以准确而快速地定量分析PMPs,克服了以往相对单位表示法的缺点,有利于实验结果的室间比较和检测方法的标准化。
, 百拇医药
参考文献:
[1] Horstman LL, Ahn YS.Platelet microparticles: a wide-angle perspective[J].Crit Rev Oncol Hematol, 1999, 30: 111-142.
[2] Nieuwland R, Berckmans RJ, Rotteveel-Eijkman RC, et al. Cell-derived microparticles generated in patiets during cardiopulmonary bypass are highly procoagulant[J]. Circulation, 1997, 96: 3534-3541.
[3] 韩锐. 流式细胞仪在血栓与出血性疾病诊断中的意义[J].国外医学 :输血及血液学分册, 1998, 22: 284-287.
, 百拇医药
[4] Galli M, Grassi A, Barbui T. Platelet-derived microvesicles in thrombotic thrombocytopenic purpura and hemolytic uremic Syndrome[j].Thrombo and Haemost,1996,75: 427-431.
[5] Combes V, Simon AC, Grau GE, et al. In vitro generation of endothelial microparticles and possible prothrombotic activity in patients with lupus anticoagulant[J].J Clin Invest, 1999, 104 : 93-102.
2000-03-23
2000-04-06, 百拇医药