NO在高压氧调控脑微血管舒缩功能中的效用1
作者:刘 磊2 刘景昌2 蔺世龙2 李 斌2
单位:1 中国人民解放军“九五”医药重点课题(96L003);2 中国人民解放军海军医学研究所, 邮政编码 上海200433
关键词:高压氧;一氧化氮;微血管, 脑;沙土鼠;大鼠
微循环学杂志/990203
目的: 探讨一氧化氮(NO)在高压氧调控脑微血管舒缩功能中的效应和机制。 方法: 采用激光多普勒和显微荧光方法分别观察沙土鼠软脑膜及SD大鼠血管内皮细胞和平滑肌细胞实验前后的变化。 结果: (1) 高压氧暴露后, 细动脉收缩。 腹腔给予L-NAME, 毛细血管关闭, 再暴露高压氧, 毛细血管开放。 脑表面局部应用L-NAME, 细静脉呈节段性痉挛状态, 再暴露高压氧, 细静脉痉挛缓解。 (2) 高压氧直接暴露下, 共培养的内皮细胞[Ca2+]i增加, 平滑肌[Ca2+]i减少。 一氧化氮合酶抑制并高压氧暴露, 平滑肌[Ca2+]i增加。 结论: NO参与高压氧对脑微血管舒缩功能的调控。
, http://www.100md.com
Effects of Hyperbaric Oxygen on Functions of Brain Microvessels Via Nitric Oxide
Liu Lei, Liu Jingchang, Lin Shilong, et al
Navy Medical Research Institute of Chinese PLA, Shanghai 200433
Objective: To investigate the effect of hyrerbaric oxygen(HBO) on functions of brain microvessels via nitric oxide. Method: During the experiment, the changes on pia mater microvessels of gerbils and vascular endothelial cell and smooth muscle cell of SD rats were observed by using Laser Doppler and microfluorimetry. Results: (1) The pial microarteries contracted after exposure to HBO. The pial cappillaries closed after i.p. L-NAME, then opened when exposed to HBO. Dropping L-NAME onto the brain surface, the pial microveins convulsed in segmental state, then recovered from the convulsion after HBO exposure. (2) During HBO exposure, the endothelial cell [Ca2+]i increased and meanwhile the smooth muscle cell [Ca2+]i decreased. Both sorts of cells [Ca2+]i rised with L-NAME treatment and then exposed to HBO, the endothelial cell [Ca2+]i decreased while the smooth muscle cell [Ca2+]i was maintained at a higher level. Conclusions: NO takes part in HBO-mediated functions of brain mucrovessels.
, 百拇医药
Key words: Hyperbaric oxygen; Nitroc oxide; Microvessels, Brain; Gerbil; Rat
近年来研究表明, 一氧化氮(Nitric oxide; NO)参与低氧对血管平滑肌细胞(Smooth muscle cell; SMC)舒张功能的调控, 但对其在高压氧调控脑微血管舒缩功能中的效用尚不清楚, 故此本文拟对: (1) 高压氧对脑微血管舒缩功能的影响及一氧化氮合酶(Constutive Nitric oxide synthase; cNOS)抑制后的效应; (2) 高压氧对共培养的脑微血管内皮细胞(Endothelial cell; EC)和SMC[Ca2+]i的影响以及cNOS抑制后的效应等进行研究。
1 材料与方法
1.1 微血管管径的测量
, 百拇医药
成年健康沙土鼠96只, 体重80~100 g, 雌雄不拘, 按表1随机分组:
所有动物采用氨基甲酸乙酯(1.25 g/kg, 腹腔注射)麻醉, 采用密闭式颅窗[1], 盖玻片覆盖, 密封固定, 室温24 ℃±2 ℃放置30 min, 置动物氧舱内, 纯氧洗舱, 5 min加压, 维持压力30 min后按0.05 MPa/min减压至常压空气环境。
用国产LDF-1型激光多普勒血流仪测量药物干预及进舱前后同一部位的微血管管径。
表 1 动物分组(n) 处 置
高压氧
高压氧+L-NAME(0.04 g/kg,腹腔注射)
高压氧+L-NAME
, 百拇医药
(0.04 g/kg,脑表面滴入)
常压空气
(21% O2)
8
8
8
0.1 MPa
(99.2% O2)
12
12
12
0.2 MPa
, http://www.100md.com
(99.2% O2)
12
12
12
1.2 细胞内Ca2+的动态测定
加入新生SD大鼠皮层微血管的SMC和EC细胞悬液(1~2×105/ml)于盖玻片上共培养。 贴壁后取出, 置10 μmol/L的荧光指示剂Fluo-3/AM(Sigma)中, 37 ℃孵育60 min, MEM(Gibco)培养基反复冲洗后, 置上下二面嵌有石英玻璃的微型高压氧舱内(12×1.2×0.8 cm), 纯氧洗舱, 1 min加压至规定的压力并维持。
显微荧光动态监测L-NAME(0.04 g/L)干预及高压氧暴露前和暴露期间二种细胞的荧光强度, 激发波长为450~510 nm。2 结 果
, http://www.100md.com
2.1 微血管管径的变化
0.1和0.2 MPa O2暴露下, 细动脉轻度收缩, 以0.2 MPa O2暴露后较为显著, 与暴露前及常压空气组比较均具有明显的统计学意义(表1)。 一部分细静脉暴露后轻度扩张, 另一部分则轻度收缩。 腹腔注射cNOS抑制剂L-NAME(0.04 g/kg)后, 多数毛细血管关闭, 细动、 静脉未见明显变化; 再暴露HBO, 细动脉扩张(表1), 细静脉管径二极分化, 动-静脉直捷通路和毛细血管开放。 软脑膜表面直接滴入L-NAME(0.04 g/L), 可见细静脉明显收缩, 40 μm以下的细静脉呈节段性痉挛状态, 而对细动脉及大于100 μm的细静脉影响不明显, 再暴露HBO 30 min, 细动脉收缩(表1), 细静脉痉挛缓解(表2, 图1、 2), 动-静脉直捷通路开放。
2.2 细胞内Ca2+的变化
, 百拇医药
HBO直接暴露下, 3 min内共培养的SMC[Ca2+]i明显减少, 且以贴附于EC生长的SMC[Ca2+]i下降最为显著, 而EC[Ca2+]i则呈现先增加后减少的趋势, cNOS抑制后, 常氧下共培养的SMC和EC[Ca2+]i均有所增加, HBO暴露下, 5 min内EC[Ca2+]i明显减少, 而SMC[Ca2+]i则呈现出一个明显的下降峰, 而后维持在一个较高的水平(图3, 4)。
表 2 沙土鼠软脑膜二组细动脉管径的变化(μm,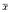 ±s) 组 别
±s) 组 别
高 压 氧
, http://www.100md.com
高压氧+L-NAME(腹腔注射)
高压氧+L-NAME(脑表面滴入)
常压空气
0.1 MPa
0.2 MPa
常压空气
0.1 MPa
0.2 MPa
常压空气
0.1 MPa
0.2 MPa
60~80 μm
, http://www.100md.com
暴露前
69.8±7.4
68.2±5.1
70.0±5.4
70.7±4.0
68.5±5.4
70.0±5.2
71.1±4.4
70.4±4.9
70.4±5.3
暴露后
70.1±7.0
, 百拇医药
66.0±6.8
62.9±8.01)3)
68.7±4.8
76.5±11.41)3)4)
74.5±7.53)5)
69.4±4.8
68.4±5.5
61.8±7.02)3)
20~40 μm
暴露前
30.0±4.8
, 百拇医药
30.8±6.6
30.0±4.1
31.4±4.8
30.0±5.3
30.6±4.5
30.3±4.6
30.8±4.0
30.3±4.9
暴露后
30.0±4.6
31.0±4.1
27.2±5.0
, 百拇医药
30.3±6.2
35.5±7.7
34.6±4.01)5)
29.4±4.4
27.2±3.61)4)
24.6±5.41)3)
注: 与暴露前比较: 1) P<0.05, 2) P<0.01; 3) 与常压空气组比较: P<0.05; 与高压氧组比较: 4) P<0.05, 5) P<0.01注: 与暴露前比较: 1) P<0.05, 2) P<0.01; 3) 与常压空气组比较: P<0.05; 与高压氧组比较: 4) P<0.05, 5) P<0.01 组 别
, http://www.100md.com
高 压 氧
高压氧+L-NAME(腹腔注射)
高压氧+L-NAME(脑表面滴入)
常压空气
0.1 MPa
0.2 MPa
常压空气
0.1 MPa
0.2 MPa
常压空气
0.1 MPa
0.2 MPa
, http://www.100md.com
60~80 μm
暴露前
69.8±7.4
70.0±6.6
71.8±5.0
70.0±3.7
70.0±4.5
70.9±5.2
70.3±3.7
70.2±3.8
70.0±3.5
暴露后
, http://www.100md.com
70.1±7.0
72.1±8.8
71.6±5.6
66.5±5.3
71.7±9.7
66.4±7.9
56.6±4.61)4)
67.4±5.63)
71.5±3.8
20~40 μm
暴露前
, 百拇医药
35.4±3.6
34.0±5.5
32.5±4.4
32.4±4.1
32.4±4.0
32.2±4.6
32.1±4.1
32.6±3.8
32.3±3.6
暴露后
35.3±3.6
35.4±6.7
, 百拇医药
31.1±5.1
32.5±4.0
32.3±5.8
27.4±6.1
13.9±2.11)4)
24.4±4.61)3)4)
27.4±5.42)
注: 与暴露前比较: 1) P<0.01, 2) P<0.05; 3) 与常压空气组比较: P<0.01; 4) 与高压氧组比较: P<0.01
, http://www.100md.com
3 讨 论
内皮细胞cNOS催化氧和L-精氨酸生成NO和L-瓜氨酸, NO又在氧的作用下生成亚硝酸根和硝酸根等, 因此氧既参与NO的合成, 又参与NO的代谢, 同时氧通过细胞内Ca2+的介导对cNOS活性具有调控作用。 正因为NO和氧有着如此复杂的关系, 以至于氧分压的变化对NO的影响争议较大。
本文的研究结果显示: 0.1和0.2 MPa O2可以促进NO的合成。 沙土鼠软脑膜表面滴入cNOS抑制剂L-NAME后, 细静脉明显收缩, 呈节段性痉挛状态, 表明NO参与常氧下脑微血管张力的维持, 这与Rosenblum报道的小鼠脑表面局部给予L-NAME后, 软脑膜细动脉收缩的结果[2]基本一致, 所不同的是沙土鼠仅表现出细静脉收缩, 细动脉变化不甚明显, 这可能与动物的种属不同有关。 再暴露HBO, 沙土鼠软脑膜细静脉痉挛缓解, 且0.2 MPa O2暴露后的缓解程度较0.1 MPa O2暴露更为明显, 提示HBO暴露可致NO合成增多。 同时, 离体研究也表明, 0.1和0.2 MPa O2暴露3 min, 可致共培养的SD大鼠脑微血管EC[Ca2+]i增加, SMC[Ca2+]i明显减少, 而cNOS抑制后, 这种现象消失, 表明HBO暴露确能致使EC内NO合成增加。 这与[Ca2+]i的增加、 cNOS活性增加[3]或/和氧分压增加、 合成NO的底物浓度增加有关[4]。 有学者研究表明, 0.3 MPa O2暴露下, 脑血流量的变化不受腹腔注入L-NAME的影响, 他们认为HBO暴露下, EC内NO合成未必增加[5]。 对此我们持有异议。 从我们的实际结果来看, 腹腔给予L-NAME与软脑膜表面滴入L-NAME, 微血管反应存在着明显差异, 前者在给药后, 除毛细血管明显关闭外, 细动、 静脉未见明显改变; 后者则呈现明显的细静脉节段性痉挛。 再暴露HBO, 微血管的反应也不相同, 前者表现为细动脉扩张, 细静脉管径二极分化现象加剧, 而后者则表现为细动脉收缩, 细静脉痉挛缓解。 我们认为, 给药途径不同所导致的这种反应性差异可能与在体条件下其它血管活性因子参与有关。 另外, 单纯HBO暴露, 微血管孔未必全部扩张, 而是表现为细动脉收缩, 细静脉一部分呈扩张状态、 一部分呈收缩状态。 这除了其它血管活性因子参与外, 还可能与氧对SMC的直接作用有关。 其确切的机制有待进一步研究。
, 百拇医药
HBO暴露所致EC内NO的增加是短暂的。 有研究表明, 低氧8 h或24 h后, 均可见培养的脑微血管EC[Ca2+]i增加[6], HBO直接暴露下, EC[Ca2+]i的变化却与此不同, 先呈现出短暂的一过性增加, 持续约3~5 min, 尔后很快下降, 直至荧光信号消失。 cNOS抑制后, EC和SMC[Ca2+]i均有所增加, 再暴露HBO, EC[Ca2+]i很快下降(<5 min), SMC[Ca2+]i却呈现出一个明显的下降峰, 尔后维持在一个较高的水平。 且0.2 MPa O2暴露下, 这种下降峰更为明显, 提示HBO所致EC内NO的增加是短暂的一过性的。
参考文献
1.翟启辉, 段重高. 活体动物脑微循环实际研究方法. 微循环学杂志, 1992, 2(2):26~82.
, http://www.100md.com
2.Rosenblum WI, Nishimura H, Nelson GH, et al. Endothelium-dependent L-Arg and L-NMMA sensitive mechanisms regulate tone of brain microvessels. Am J Physiol, 1990, 259:H1 396~H1 401.
3.Fukuto JM, Chaudhuri G. Inhibition of constitutive and inducible nitric oxide synthase: potential selective inhibition. Annu Rev Pharmacol Toxicol, 1995, 35:165~194.
4.Shaul PW, Wells LB. Oxygen modulates nitric oxide production selectively in fetal pulmonary endothelial cells. Am J Respir Cell Mol Biol, 1994, 11(4):432~438.
, 百拇医药
5.Zhang J, Sam AD, Kiltzman B, et al. Inhibition of nitric oxide synthase on brain oxygenation in anesthetized rats exposed to hyperbaric oxygen. Undersea Hyperb Med, 1995, 22(4):377~382.
6.吕敏, 顾正中. 一氧化氮在低氧脑血管舒张反应中的作用. 中国应用生理学杂志, 1997, 13(3增刊):增6~增7
收稿日期:本文1998-09-16收到, 1998-12-23修回, 1999-03-02接受, 百拇医药(刘 磊2 刘景昌2 蔺世龙2 李 斌2)
单位:1 中国人民解放军“九五”医药重点课题(96L003);2 中国人民解放军海军医学研究所, 邮政编码 上海200433
关键词:高压氧;一氧化氮;微血管, 脑;沙土鼠;大鼠
微循环学杂志/990203
目的: 探讨一氧化氮(NO)在高压氧调控脑微血管舒缩功能中的效应和机制。 方法: 采用激光多普勒和显微荧光方法分别观察沙土鼠软脑膜及SD大鼠血管内皮细胞和平滑肌细胞实验前后的变化。 结果: (1) 高压氧暴露后, 细动脉收缩。 腹腔给予L-NAME, 毛细血管关闭, 再暴露高压氧, 毛细血管开放。 脑表面局部应用L-NAME, 细静脉呈节段性痉挛状态, 再暴露高压氧, 细静脉痉挛缓解。 (2) 高压氧直接暴露下, 共培养的内皮细胞[Ca2+]i增加, 平滑肌[Ca2+]i减少。 一氧化氮合酶抑制并高压氧暴露, 平滑肌[Ca2+]i增加。 结论: NO参与高压氧对脑微血管舒缩功能的调控。
, http://www.100md.com
Effects of Hyperbaric Oxygen on Functions of Brain Microvessels Via Nitric Oxide
Liu Lei, Liu Jingchang, Lin Shilong, et al
Navy Medical Research Institute of Chinese PLA, Shanghai 200433
Objective: To investigate the effect of hyrerbaric oxygen(HBO) on functions of brain microvessels via nitric oxide. Method: During the experiment, the changes on pia mater microvessels of gerbils and vascular endothelial cell and smooth muscle cell of SD rats were observed by using Laser Doppler and microfluorimetry. Results: (1) The pial microarteries contracted after exposure to HBO. The pial cappillaries closed after i.p. L-NAME, then opened when exposed to HBO. Dropping L-NAME onto the brain surface, the pial microveins convulsed in segmental state, then recovered from the convulsion after HBO exposure. (2) During HBO exposure, the endothelial cell [Ca2+]i increased and meanwhile the smooth muscle cell [Ca2+]i decreased. Both sorts of cells [Ca2+]i rised with L-NAME treatment and then exposed to HBO, the endothelial cell [Ca2+]i decreased while the smooth muscle cell [Ca2+]i was maintained at a higher level. Conclusions: NO takes part in HBO-mediated functions of brain mucrovessels.
, 百拇医药
Key words: Hyperbaric oxygen; Nitroc oxide; Microvessels, Brain; Gerbil; Rat
近年来研究表明, 一氧化氮(Nitric oxide; NO)参与低氧对血管平滑肌细胞(Smooth muscle cell; SMC)舒张功能的调控, 但对其在高压氧调控脑微血管舒缩功能中的效用尚不清楚, 故此本文拟对: (1) 高压氧对脑微血管舒缩功能的影响及一氧化氮合酶(Constutive Nitric oxide synthase; cNOS)抑制后的效应; (2) 高压氧对共培养的脑微血管内皮细胞(Endothelial cell; EC)和SMC[Ca2+]i的影响以及cNOS抑制后的效应等进行研究。
1 材料与方法
1.1 微血管管径的测量
, 百拇医药
成年健康沙土鼠96只, 体重80~100 g, 雌雄不拘, 按表1随机分组:
所有动物采用氨基甲酸乙酯(1.25 g/kg, 腹腔注射)麻醉, 采用密闭式颅窗[1], 盖玻片覆盖, 密封固定, 室温24 ℃±2 ℃放置30 min, 置动物氧舱内, 纯氧洗舱, 5 min加压, 维持压力30 min后按0.05 MPa/min减压至常压空气环境。
用国产LDF-1型激光多普勒血流仪测量药物干预及进舱前后同一部位的微血管管径。
表 1 动物分组(n) 处 置
高压氧
高压氧+L-NAME(0.04 g/kg,腹腔注射)
高压氧+L-NAME
, 百拇医药
(0.04 g/kg,脑表面滴入)
常压空气
(21% O2)
8
8
8
0.1 MPa
(99.2% O2)
12
12
12
0.2 MPa
, http://www.100md.com
(99.2% O2)
12
12
12
1.2 细胞内Ca2+的动态测定
加入新生SD大鼠皮层微血管的SMC和EC细胞悬液(1~2×105/ml)于盖玻片上共培养。 贴壁后取出, 置10 μmol/L的荧光指示剂Fluo-3/AM(Sigma)中, 37 ℃孵育60 min, MEM(Gibco)培养基反复冲洗后, 置上下二面嵌有石英玻璃的微型高压氧舱内(12×1.2×0.8 cm), 纯氧洗舱, 1 min加压至规定的压力并维持。
显微荧光动态监测L-NAME(0.04 g/L)干预及高压氧暴露前和暴露期间二种细胞的荧光强度, 激发波长为450~510 nm。2 结 果
, http://www.100md.com
2.1 微血管管径的变化
0.1和0.2 MPa O2暴露下, 细动脉轻度收缩, 以0.2 MPa O2暴露后较为显著, 与暴露前及常压空气组比较均具有明显的统计学意义(表1)。 一部分细静脉暴露后轻度扩张, 另一部分则轻度收缩。 腹腔注射cNOS抑制剂L-NAME(0.04 g/kg)后, 多数毛细血管关闭, 细动、 静脉未见明显变化; 再暴露HBO, 细动脉扩张(表1), 细静脉管径二极分化, 动-静脉直捷通路和毛细血管开放。 软脑膜表面直接滴入L-NAME(0.04 g/L), 可见细静脉明显收缩, 40 μm以下的细静脉呈节段性痉挛状态, 而对细动脉及大于100 μm的细静脉影响不明显, 再暴露HBO 30 min, 细动脉收缩(表1), 细静脉痉挛缓解(表2, 图1、 2), 动-静脉直捷通路开放。
2.2 细胞内Ca2+的变化
, 百拇医药
HBO直接暴露下, 3 min内共培养的SMC[Ca2+]i明显减少, 且以贴附于EC生长的SMC[Ca2+]i下降最为显著, 而EC[Ca2+]i则呈现先增加后减少的趋势, cNOS抑制后, 常氧下共培养的SMC和EC[Ca2+]i均有所增加, HBO暴露下, 5 min内EC[Ca2+]i明显减少, 而SMC[Ca2+]i则呈现出一个明显的下降峰, 而后维持在一个较高的水平(图3, 4)。
表 2 沙土鼠软脑膜二组细动脉管径的变化(μm,
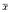 ±s) 组 别
±s) 组 别高 压 氧
, http://www.100md.com
高压氧+L-NAME(腹腔注射)
高压氧+L-NAME(脑表面滴入)
常压空气
0.1 MPa
0.2 MPa
常压空气
0.1 MPa
0.2 MPa
常压空气
0.1 MPa
0.2 MPa
60~80 μm
, http://www.100md.com
暴露前
69.8±7.4
68.2±5.1
70.0±5.4
70.7±4.0
68.5±5.4
70.0±5.2
71.1±4.4
70.4±4.9
70.4±5.3
暴露后
70.1±7.0
, 百拇医药
66.0±6.8
62.9±8.01)3)
68.7±4.8
76.5±11.41)3)4)
74.5±7.53)5)
69.4±4.8
68.4±5.5
61.8±7.02)3)
20~40 μm
暴露前
30.0±4.8
, 百拇医药
30.8±6.6
30.0±4.1
31.4±4.8
30.0±5.3
30.6±4.5
30.3±4.6
30.8±4.0
30.3±4.9
暴露后
30.0±4.6
31.0±4.1
27.2±5.0
, 百拇医药
30.3±6.2
35.5±7.7
34.6±4.01)5)
29.4±4.4
27.2±3.61)4)
24.6±5.41)3)
注: 与暴露前比较: 1) P<0.05, 2) P<0.01; 3) 与常压空气组比较: P<0.05; 与高压氧组比较: 4) P<0.05, 5) P<0.01注: 与暴露前比较: 1) P<0.05, 2) P<0.01; 3) 与常压空气组比较: P<0.05; 与高压氧组比较: 4) P<0.05, 5) P<0.01 组 别
, http://www.100md.com
高 压 氧
高压氧+L-NAME(腹腔注射)
高压氧+L-NAME(脑表面滴入)
常压空气
0.1 MPa
0.2 MPa
常压空气
0.1 MPa
0.2 MPa
常压空气
0.1 MPa
0.2 MPa
, http://www.100md.com
60~80 μm
暴露前
69.8±7.4
70.0±6.6
71.8±5.0
70.0±3.7
70.0±4.5
70.9±5.2
70.3±3.7
70.2±3.8
70.0±3.5
暴露后
, http://www.100md.com
70.1±7.0
72.1±8.8
71.6±5.6
66.5±5.3
71.7±9.7
66.4±7.9
56.6±4.61)4)
67.4±5.63)
71.5±3.8
20~40 μm
暴露前
, 百拇医药
35.4±3.6
34.0±5.5
32.5±4.4
32.4±4.1
32.4±4.0
32.2±4.6
32.1±4.1
32.6±3.8
32.3±3.6
暴露后
35.3±3.6
35.4±6.7
, 百拇医药
31.1±5.1
32.5±4.0
32.3±5.8
27.4±6.1
13.9±2.11)4)
24.4±4.61)3)4)
27.4±5.42)
注: 与暴露前比较: 1) P<0.01, 2) P<0.05; 3) 与常压空气组比较: P<0.01; 4) 与高压氧组比较: P<0.01

, http://www.100md.com
3 讨 论
内皮细胞cNOS催化氧和L-精氨酸生成NO和L-瓜氨酸, NO又在氧的作用下生成亚硝酸根和硝酸根等, 因此氧既参与NO的合成, 又参与NO的代谢, 同时氧通过细胞内Ca2+的介导对cNOS活性具有调控作用。 正因为NO和氧有着如此复杂的关系, 以至于氧分压的变化对NO的影响争议较大。
本文的研究结果显示: 0.1和0.2 MPa O2可以促进NO的合成。 沙土鼠软脑膜表面滴入cNOS抑制剂L-NAME后, 细静脉明显收缩, 呈节段性痉挛状态, 表明NO参与常氧下脑微血管张力的维持, 这与Rosenblum报道的小鼠脑表面局部给予L-NAME后, 软脑膜细动脉收缩的结果[2]基本一致, 所不同的是沙土鼠仅表现出细静脉收缩, 细动脉变化不甚明显, 这可能与动物的种属不同有关。 再暴露HBO, 沙土鼠软脑膜细静脉痉挛缓解, 且0.2 MPa O2暴露后的缓解程度较0.1 MPa O2暴露更为明显, 提示HBO暴露可致NO合成增多。 同时, 离体研究也表明, 0.1和0.2 MPa O2暴露3 min, 可致共培养的SD大鼠脑微血管EC[Ca2+]i增加, SMC[Ca2+]i明显减少, 而cNOS抑制后, 这种现象消失, 表明HBO暴露确能致使EC内NO合成增加。 这与[Ca2+]i的增加、 cNOS活性增加[3]或/和氧分压增加、 合成NO的底物浓度增加有关[4]。 有学者研究表明, 0.3 MPa O2暴露下, 脑血流量的变化不受腹腔注入L-NAME的影响, 他们认为HBO暴露下, EC内NO合成未必增加[5]。 对此我们持有异议。 从我们的实际结果来看, 腹腔给予L-NAME与软脑膜表面滴入L-NAME, 微血管反应存在着明显差异, 前者在给药后, 除毛细血管明显关闭外, 细动、 静脉未见明显改变; 后者则呈现明显的细静脉节段性痉挛。 再暴露HBO, 微血管的反应也不相同, 前者表现为细动脉扩张, 细静脉管径二极分化现象加剧, 而后者则表现为细动脉收缩, 细静脉痉挛缓解。 我们认为, 给药途径不同所导致的这种反应性差异可能与在体条件下其它血管活性因子参与有关。 另外, 单纯HBO暴露, 微血管孔未必全部扩张, 而是表现为细动脉收缩, 细静脉一部分呈扩张状态、 一部分呈收缩状态。 这除了其它血管活性因子参与外, 还可能与氧对SMC的直接作用有关。 其确切的机制有待进一步研究。
, 百拇医药
HBO暴露所致EC内NO的增加是短暂的。 有研究表明, 低氧8 h或24 h后, 均可见培养的脑微血管EC[Ca2+]i增加[6], HBO直接暴露下, EC[Ca2+]i的变化却与此不同, 先呈现出短暂的一过性增加, 持续约3~5 min, 尔后很快下降, 直至荧光信号消失。 cNOS抑制后, EC和SMC[Ca2+]i均有所增加, 再暴露HBO, EC[Ca2+]i很快下降(<5 min), SMC[Ca2+]i却呈现出一个明显的下降峰, 尔后维持在一个较高的水平。 且0.2 MPa O2暴露下, 这种下降峰更为明显, 提示HBO所致EC内NO的增加是短暂的一过性的。
参考文献
1.翟启辉, 段重高. 活体动物脑微循环实际研究方法. 微循环学杂志, 1992, 2(2):26~82.
, http://www.100md.com
2.Rosenblum WI, Nishimura H, Nelson GH, et al. Endothelium-dependent L-Arg and L-NMMA sensitive mechanisms regulate tone of brain microvessels. Am J Physiol, 1990, 259:H1 396~H1 401.
3.Fukuto JM, Chaudhuri G. Inhibition of constitutive and inducible nitric oxide synthase: potential selective inhibition. Annu Rev Pharmacol Toxicol, 1995, 35:165~194.
4.Shaul PW, Wells LB. Oxygen modulates nitric oxide production selectively in fetal pulmonary endothelial cells. Am J Respir Cell Mol Biol, 1994, 11(4):432~438.
, 百拇医药
5.Zhang J, Sam AD, Kiltzman B, et al. Inhibition of nitric oxide synthase on brain oxygenation in anesthetized rats exposed to hyperbaric oxygen. Undersea Hyperb Med, 1995, 22(4):377~382.
6.吕敏, 顾正中. 一氧化氮在低氧脑血管舒张反应中的作用. 中国应用生理学杂志, 1997, 13(3增刊):增6~增7
收稿日期:本文1998-09-16收到, 1998-12-23修回, 1999-03-02接受, 百拇医药(刘 磊2 刘景昌2 蔺世龙2 李 斌2)