CTLA-4/Ig融合蛋白在COS-7中的表达、纯化及鉴定
作者:易绍萱 吴军 王锡华 李彦 刘志刚 姜庆 罗高兴 周立新 肖光夏
单位:易绍萱(第三军医大学附属西南医院烧伤研究所,重庆 400038);吴军(第三军医大学附属西南医院烧伤研究所,重庆 400038);王锡华(第三军医大学附属西南医院烧伤研究所,重庆 400038);李彦(第三军医大学附属西南医院烧伤研究所,重庆 400038);刘志刚(第三军医大学附属西南医院烧伤研究所,重庆 400038)
关键词:CTLA-4;融合蛋白;亲和层析;基因表达;纯化;活性鉴定
第三军医大学学报000605 提 要: 目的 探讨pCTLA-4/Ig融合蛋白表达载体在哺乳动物细胞中的表达及表达产物的鉴定、纯化,为其功能研究和临床应用奠定基础。方法 将pCTLA-4/Ig表达质粒转染COS-7细胞,双抗体夹心ELISA检测细胞培养上清中融合蛋白表达;Protein A亲和层析纯化,SDS-PAGE、Western印迹、3H-TdR掺入等进行分子量、纯度、抗原特异性及生物学活性鉴定。结果 在pCTLA-4/Ig质粒转染后的48 h和96 h上清中,均能检测到CTLA-4/Ig融合蛋白表达;经亲和层析纯化后,在SDS-PAGE胶上出现一条分子量约50×103的与预期分子量大小相符的蛋白条带,该蛋白能与抗人CTLA-4单抗特异结合;该纯化融合蛋白能抑制人MLR,抑制率为60%~70%。结论 在哺乳动物细胞中成功地表达并纯化了有生物学活性的重组人CTLA-4/Ig融合蛋白。
, 百拇医药
中图法分类号: R329.21;R394-3 文献标识码: A
文章编号:1000-5404(2000)06-0523-04
Expression, purification and identification of CTLA-4/Ig fusion protein in COS-7 cells
YI Shao-xuan, WU Jun, WANG Xi-hua, LI Yan, LIU Zhi-gang, JIANG Qing, LUO Gao-xing, ZHOU Li-xin, XIAO Guang-xia
(Research Institute of Burn Injury, Southwest Hospital, Third Military Medical University, Chongqing 400038, China)
, 百拇医药
Abstract: Objective To study the expression of pCTLA-4/Ig fusion protein expression vector in mammalian cells and the purification and identification of its expressive product in vitro for the further study of its function and clinical application. Methods Expression vector pCTLA-4/Ig was transfected into COS-7 with lipid reagent. The expression of fusion protein in the supernatant of the cell culture media was detected with double-antibody sandwich ELISA. After purified with protein A affinity chromatography, the product was studied with SDS-PAGE, Western blot and 3H-TdR incorporation to determine its molecular weight, purity, antigen specificity and bioactivity. Results The fusion protein could be detected in the supernatant of cell culture media 48 and 96 h after the transfection of pCTLA-4/Ig. A protein band with molecular weight of 50×103 was found in the SDS-PAGE gel. This protein specifically bound with human CTLA-4 monoclonal antibody and inhibited 60% to 70% proliferation of peripheral blood mononuclear cell (PBMC) in mixed lymphocyte reaction (MLR). Conclusion Recombined bioactive human CTLA-4/Ig fusion protein can be successfully expressed and purified in mammalian cells.
, http://www.100md.com
Key words: CTLA-4; fusion protein; affinity chromatography; gene expression; purification; activity identification
自Linsley等[1]将人细胞毒性T淋巴细胞相关抗原4(CTLA-4)胞外区与人IgG Cγ1的铰链区和恒定区CH2、CH3 cDNA融合,构建了可溶性CTLA-4/Ig后,由于CTLA-4/Ig可封闭抗原递呈细胞上的B7分子,阻断共刺激通路,调节T细胞活性,对其在免疫应答中的作用和机制越来越引起人们的关注[2~6]。为了获得CTLA-4/Ig融合蛋白,我们在成功构建CTLA-4/Ig融合蛋白表达载体的基础上,利用脂质体转染法,将pCTLA-4/Ig融合蛋白表达质粒转染COS-7细胞,通过ELISA、SDS-PAGE、免疫印迹等对CTLA-4/Ig融合蛋白表达进行了鉴定及转染条件的优化;并用Protein A亲和层析柱对细胞转染上清中融合蛋白进行纯化,为大量获取该融合蛋白其及功能的深入研究和临床应用提供先期工作基础。
, http://www.100md.com
1 材料与方法
1.1 质粒和细胞株 pCTLA-4/Ig质粒由本所自行构建;COS-7细胞,中科院上海细胞所中国细胞库购买。
1.2 试剂
质粒提取试剂盒(QIAGEN);脂质体转染试剂盒DOSPER(B.M);鼠抗人CTLA-4单抗(Pharmingen);羊抗人IgG Fc-HRP,羊抗鼠IgG-HRP(帮定);亲和层析柱HiTrap Protein A(Pharmacia)。
1.3 质粒制备
参照质粒提取试剂盒说明,但最后洗脱液用HBS(pH 7.05),而不用去离子水或TE。
1.4 脂质体法转染COS-7细胞
, 百拇医药
取对数生长期的COS-7细胞,胰酶/EDTA常规消化,以1×105细胞/孔接种6孔塑料培养板,37°C,5%CO2培养24 h后(约70%融合),另取不同量的DOSPER和pCTLA-4/Ig质粒及空载体DNA加入HBS中,以100 μl/孔的量制备DNA-DOSPER混合液,室温放置15 min,缓慢滴加至COS-7细胞中,培养6 h,DMEM彻底洗去DOSPER,转染24 h后,换无血清DMEM培养基,收集48 h和96 h无血清培养上清,用于融合蛋白的检测和纯化。
1.5 双抗体夹心ELISA检测CTLA-4/Ig融合蛋白表达
用鼠抗人CTLA-4单抗(2 μg/ml,100 μl/孔)包被ELISA板,4℃ 48 h,分别加入pCTLA-4/Ig或空载体Cpx/Ig转染上清,4°C过夜,PBS-T洗板×3,再加入辣根过氧化物酶标记的羊抗人IgG Fc抗体(1∶1 000),37°C 1 h,PBS-T洗板×3,然后加入显色液(邻苯二胺),室温10 min,2 mol/L H2SO4终止反应,酶联免疫仪测定D490。
, http://www.100md.com
1.6 表达产物的回收与纯化
根据ELISA检测确立的转染条件,大量转染COS-7细胞,回收48 h和96 h无血清培养上清,调节pH至7.0,用HiTrap Protein A亲和层析预装柱一步纯化融合蛋白,0.5 mol/L柠檬酸(pH3.0)洗脱,1mol/L Tris(pH9.0)调节pH至7.0,再对PBS透析12~16 h备用。
1.7 SDS-PAGE、Western印迹鉴定融合蛋白
SDS-PAGE采用垂直板不连续凝胶电泳法。常规灌制12%分离胶和4.65%浓缩胶,取经亲和层析法纯化后的样品和蛋白分子量标准以每孔20 μl加样,100 V恒压电泳4~6h,硝酸银染色,待蛋白带显示深棕色地终止显色反应;Western印迹:SDS-PAGE电泳结束后,取下凝胶,将蛋白质转印至PVDF膜(40 V, 95 mA,4°C,16 h),1%BSA封闭,室温1~2h,加入鼠抗人CTLA-4单克隆抗体(1∶1000稀释),4°C过夜,再加入HRP-羊抗鼠IgG多克隆抗体(1∶500稀释),37°C60 min,DAB显色,待特异性条带出现后,蒸馏水漂洗终止反应。
, http://www.100md.com
1.8 3H-TdR测定融合蛋白生物学活性
常规分离人外周血淋巴细胞,调整细胞密度为2×106 cells/ml,将两人PBMC(同种异体双向MLR)等体积混合后以2×105 cells/孔接种“U”型96孔培养板,加入不同体积的纯化融合蛋白,设置等体积相应空载体转染上清或培养基作对照,每组3复孔,37°C,5%CO2培养5 d,终止培养前16 h加入3H-TdR(终浓度5 μCi/ml),收集细胞于0.45 μm微孔滤膜上,烘干,液体闪烁计数仪测DPM值。
1.9 统计学处理
结果以 ±s表示,Microsoft Excel统计程序进行均数差异显著性分析。
±s表示,Microsoft Excel统计程序进行均数差异显著性分析。
, http://www.100md.com
2 结果
2.1 ELISA检测CTLA-4/Ig融合蛋白表达
在pCTLA-4/Ig质粒转染COS-7细胞所收集的48 h和96 h上清中,均能检测到CTLA-4/Ig融合蛋白表达,其中48 h上清的含量明显高于96 h上清含量。而空载体转染上清和用无关抗体包被的结果均接近空白对照,见表1。
表1 脂质体转染COS-7细胞上清的ELISA鉴定
Tab 1 ELISA analysis of COS-7 cell culture supernatant after DOSPER transfection Coated antibody
Supernatant
Result
, 百拇医药
Transfect supernatant
Second antibody
Anti-human CTLA-4
pCTLA-4/Ig 48 h
HRP-hIgGFc
Anti-human CTLA-4
pCTLA-4/Ig 96 h
HRP-hIgGFc
+
Anti-human CTLA-4
, http://www.100md.com
pX/Ig
Anti-human CTLA-4
-
Anti-human B7-1
pCTLA-4/Ig 48 h
HRP-hIgGFc
-
2.2 SDS-PAGE、Western印迹鉴定融合蛋白 pCTLA-4/Ig质粒和空载体pX/Ig转染上清直接进行SDS-PAGE检测,未见明显的与预期大小相符的蛋白条带(照片略);而将转染上清经Protein A亲和层析柱纯化,再进行SDS-PAGE检测,有一条分子量约为50×103的清晰蛋白条带,与预期分子量大小相符,见图1。且空载体转染的纯化物中相应位置无明显条带;以鼠的人CTLA-4单克隆抗体为一抗,HRP-羊抗鼠IgG多克隆抗体为二抗进行免疫印迹分析,结果表明,pCTLA-4/Ig质粒转染上清纯化物中,该50×103蛋白条带能与抗人CTLA-4单抗特异结合,见图2,而空载体转染纯化物中相应位置无特异显色带,说明该50×103蛋白条带正是我们所构建并表达的CTLA-4/Ig融合蛋白。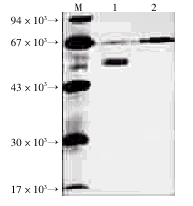
, http://www.100md.com
图1 Protein A亲和层析纯化CTLA-4/Ig融合蛋白的SDS-PAGE图谱
M:低分子量蛋白标准;1:pCTLA-4/Ig转染
COS-7上清;2:pX/Ig转染COS-7上清
Fig 1 SDS-PAGE of CTLA-4/Ig fusion protein after Protein A purification
M:Standard proteins marker,1:Supernatant after pCTLA-4/Ig
transfection,2:Supernatant after pX/Ig transfection
, http://www.100md.com
图2 CTLA-4/Ig融合蛋白免疫印迹图谱
M:低分子量蛋白标准;1:Protein A亲和层析
纯化pCTLA-4/Ig转染COS-7上清
Fig 2 Western Blot analysis of CTLA-4/Ig fusion protein
M:Standard proteins marker;1:Protein A purified
transfected supernatant (pCTLA-4/Ig)
2.3 纯化CTLA-4/Ig融合蛋白对PBMC增殖活性的影响
在MLR反应体系中,分别加入1 μl、5 μl和10 μl Protein A纯化pCTLA-4/Ig或空载体转染COS-7细胞上清,结果表明,即使加入1 μl Protein A纯化pCTLA-4/Ig融合蛋白,也能显著抑制人外周血MLR,抑制率为60%~70%;而加入同样体积的空载体转染COS-7细胞上清,则无此作用,经单因素方差分析,结果有统计学意义,见表2。同样,我们也曾用未纯化pCTLA-4/Ig转染上清直接进行MLR实验,未能观察到显著的抑制作用,这可能与未纯化细胞转染上清中异源蛋白的刺激作用与微量CTLA-4/Ig融合蛋白的抑制作用相互抵消有关。
, 百拇医药
表2 纯化CTLA-4/Ig对人MLR中淋巴细胞增殖的影响(DPM,n=3)
Tab 2 Effects of purified CTLA-4/Ig fusion protein
on human MLR (DPM,n=3) Group(μl/well)
0
1
5
10
Purified CTLA-4/Ig
4229±374
1698±257* △
, 百拇医药
1165±140* △
1101±183* △
Control
4229±374
3924±287
4198±334
4872±398
*:P<0.01 vs control;△:P<0.01 vs 0
3 讨论
融合蛋白表达载体pX/Ig具有人IgG1重链恒定区的铰链区及CH2,CH3结构域[3];通过逆转录-PCR扩增的CTLA-4胞膜外区基因片段具有Ig超家族可变区样结构域,将扩增的CTLA-4胞膜外区基因片段克隆入pX/Ig载体后获得的pCTLA-4/Ig融合蛋白表达载体,转染哺乳动物细胞后表达的融合蛋白有人Ig重链样结构,这不但可利用抗人CTLA-4抗体和抗人IgG Fc抗体的双抗体夹心ELISA法,检测以分泌蛋白形式表达的融合蛋白,还可利用蛋白A亲和层析法,从融合蛋白含量远低于血清、腹水等抗体含量的细胞培养上清中将融合蛋白高度纯化。在短暂表达系统中,外源蛋白的表达量与重组DNA对细胞的转染效率直接相关。为确立脂质体转染的最佳条件,对转染条件进行了优化。在DNA用量相同的情况下(1 μg/孔),不同的脂质体用量能明显影响融合蛋白的表达,若以相同的脂质体量与不同的DNA量混合制备脂质体-DNA复合物,外源蛋白的表达量则随DNA量增加而增加,但当DNA量达一定水平时,不能再提高融合蛋白表达。对pCTLA-4/Ig转染上清纯化后,在还原性SDS-PAGE中发现,除了在约50×103处出现与预期蛋白分子量一致的条带外,在相当于牛血清白蛋白分子量大小的67×103(与分子量标准比较)处也出现明显的蛋白条带;在Protein A纯化pX/Ig转染上清中未见50×103条带,而只有67×103蛋白条带;Western印迹检测发现:抗人CTLA-4单克隆抗体只能与SDS-PAGE中约50×103蛋白条带反应,且在pX/Ig转染上清样品的相应位置无显色带,因此,SDS-PAGE中出现的67×103蛋白条带可能是未去除干净牛血清白蛋白的细胞培养上清,由于流经蛋白A亲和层析柱的体积过大(>100倍柱床体积),未能彻底洗脱非特异性吸附的杂蛋白所至。MLR实验表明该纯化融合蛋白具有抑制免疫应答反应的活性。以上结果表明,我们成功克隆并在COS-7细胞中表达了有生物学活性的CTLA-4/Ig融合蛋白,为进一步大量表达纯化CTLA-4/Ig融合蛋白、及其免疫学活性研究和临床应用奠定了基础。
, 百拇医药
基金项目:国家自然科学基金资助重大项目(39993430-2);军队杰出人才基金资助项目(1996)
作者简介:易绍萱(1966-),女,重庆市万州区人,博士,主治医师,讲师,主要从事移植免疫方面的研究,发表论文10篇。电话:(023)68752688
作者单位:姜庆(第三军医大学附属西南医院烧伤研究所,重庆 400038)
罗高兴(第三军医大学附属西南医院烧伤研究所,重庆 400038)
周立新(第三军医大学附属西南医院烧伤研究所,重庆 400038)
肖光夏(第三军医大学附属西南医院烧伤研究所,重庆 400038)
参考文献:
, 百拇医药
[1] Linsley P S, Brady W, Urnes M, et al. CTLA-4 is a second receptor for the B cell activation antigen B7[J]. J Exp Med,1991,174(3):561-569.
[2] Boussiotis V A, Freeman G J, Gribben J G, et al. The role of B7-1/B7-2: CD28/CLTA-4 pathways in the prevention of anergy, induction of productive immunity and down-regulation of the immune response[J]. Immunol Rev,1996,153:5-26.
[3] Tarumi K, Yagihashi A, Tsuruma T, et al. Induction and maintenance of tolerance by CTLA-4/Ig in rat small bowel allografts[J]. Transplant Proc,1999,31(1-2):878-881.
, http://www.100md.com
[4] Elwood E T, Larsen C P, Cho H R, et al. Prolonged acceptance of concordant and discordant xenografts with combined CD40 and CD28 pathway blockade[J]. Transplantation,1998,65(11);1 422-1 428.
[5] Finck B K, Linsley P S, Wofsy D. Treatment of murine lupus with CTLA-4/Ig[J]. Science,1994,265(5176):1 225-1 227.
[6] Nishikawa K, Linsley P S, Collins A B, et al. Effect of CTLA-4 chimeric protein on rat autoimmune anti-glomerular basement membrane glomerulonephritis[J]. Eur J Immunol,1994,24(6):1 249-1 254.
[7] Seidman M. The development of transient SV40 based shuttle vectors mutagenesis studies: problems and solutions[J]. Mutat-Res,1989,220(2-3):55-60.
收稿日期:1999-11-25;修回日期:2000-03-10, 百拇医药
单位:易绍萱(第三军医大学附属西南医院烧伤研究所,重庆 400038);吴军(第三军医大学附属西南医院烧伤研究所,重庆 400038);王锡华(第三军医大学附属西南医院烧伤研究所,重庆 400038);李彦(第三军医大学附属西南医院烧伤研究所,重庆 400038);刘志刚(第三军医大学附属西南医院烧伤研究所,重庆 400038)
关键词:CTLA-4;融合蛋白;亲和层析;基因表达;纯化;活性鉴定
第三军医大学学报000605 提 要: 目的 探讨pCTLA-4/Ig融合蛋白表达载体在哺乳动物细胞中的表达及表达产物的鉴定、纯化,为其功能研究和临床应用奠定基础。方法 将pCTLA-4/Ig表达质粒转染COS-7细胞,双抗体夹心ELISA检测细胞培养上清中融合蛋白表达;Protein A亲和层析纯化,SDS-PAGE、Western印迹、3H-TdR掺入等进行分子量、纯度、抗原特异性及生物学活性鉴定。结果 在pCTLA-4/Ig质粒转染后的48 h和96 h上清中,均能检测到CTLA-4/Ig融合蛋白表达;经亲和层析纯化后,在SDS-PAGE胶上出现一条分子量约50×103的与预期分子量大小相符的蛋白条带,该蛋白能与抗人CTLA-4单抗特异结合;该纯化融合蛋白能抑制人MLR,抑制率为60%~70%。结论 在哺乳动物细胞中成功地表达并纯化了有生物学活性的重组人CTLA-4/Ig融合蛋白。
, 百拇医药
中图法分类号: R329.21;R394-3 文献标识码: A
文章编号:1000-5404(2000)06-0523-04
Expression, purification and identification of CTLA-4/Ig fusion protein in COS-7 cells
YI Shao-xuan, WU Jun, WANG Xi-hua, LI Yan, LIU Zhi-gang, JIANG Qing, LUO Gao-xing, ZHOU Li-xin, XIAO Guang-xia
(Research Institute of Burn Injury, Southwest Hospital, Third Military Medical University, Chongqing 400038, China)
, 百拇医药
Abstract: Objective To study the expression of pCTLA-4/Ig fusion protein expression vector in mammalian cells and the purification and identification of its expressive product in vitro for the further study of its function and clinical application. Methods Expression vector pCTLA-4/Ig was transfected into COS-7 with lipid reagent. The expression of fusion protein in the supernatant of the cell culture media was detected with double-antibody sandwich ELISA. After purified with protein A affinity chromatography, the product was studied with SDS-PAGE, Western blot and 3H-TdR incorporation to determine its molecular weight, purity, antigen specificity and bioactivity. Results The fusion protein could be detected in the supernatant of cell culture media 48 and 96 h after the transfection of pCTLA-4/Ig. A protein band with molecular weight of 50×103 was found in the SDS-PAGE gel. This protein specifically bound with human CTLA-4 monoclonal antibody and inhibited 60% to 70% proliferation of peripheral blood mononuclear cell (PBMC) in mixed lymphocyte reaction (MLR). Conclusion Recombined bioactive human CTLA-4/Ig fusion protein can be successfully expressed and purified in mammalian cells.
, http://www.100md.com
Key words: CTLA-4; fusion protein; affinity chromatography; gene expression; purification; activity identification
自Linsley等[1]将人细胞毒性T淋巴细胞相关抗原4(CTLA-4)胞外区与人IgG Cγ1的铰链区和恒定区CH2、CH3 cDNA融合,构建了可溶性CTLA-4/Ig后,由于CTLA-4/Ig可封闭抗原递呈细胞上的B7分子,阻断共刺激通路,调节T细胞活性,对其在免疫应答中的作用和机制越来越引起人们的关注[2~6]。为了获得CTLA-4/Ig融合蛋白,我们在成功构建CTLA-4/Ig融合蛋白表达载体的基础上,利用脂质体转染法,将pCTLA-4/Ig融合蛋白表达质粒转染COS-7细胞,通过ELISA、SDS-PAGE、免疫印迹等对CTLA-4/Ig融合蛋白表达进行了鉴定及转染条件的优化;并用Protein A亲和层析柱对细胞转染上清中融合蛋白进行纯化,为大量获取该融合蛋白其及功能的深入研究和临床应用提供先期工作基础。
, http://www.100md.com
1 材料与方法
1.1 质粒和细胞株 pCTLA-4/Ig质粒由本所自行构建;COS-7细胞,中科院上海细胞所中国细胞库购买。
1.2 试剂
质粒提取试剂盒(QIAGEN);脂质体转染试剂盒DOSPER(B.M);鼠抗人CTLA-4单抗(Pharmingen);羊抗人IgG Fc-HRP,羊抗鼠IgG-HRP(帮定);亲和层析柱HiTrap Protein A(Pharmacia)。
1.3 质粒制备
参照质粒提取试剂盒说明,但最后洗脱液用HBS(pH 7.05),而不用去离子水或TE。
1.4 脂质体法转染COS-7细胞
, 百拇医药
取对数生长期的COS-7细胞,胰酶/EDTA常规消化,以1×105细胞/孔接种6孔塑料培养板,37°C,5%CO2培养24 h后(约70%融合),另取不同量的DOSPER和pCTLA-4/Ig质粒及空载体DNA加入HBS中,以100 μl/孔的量制备DNA-DOSPER混合液,室温放置15 min,缓慢滴加至COS-7细胞中,培养6 h,DMEM彻底洗去DOSPER,转染24 h后,换无血清DMEM培养基,收集48 h和96 h无血清培养上清,用于融合蛋白的检测和纯化。
1.5 双抗体夹心ELISA检测CTLA-4/Ig融合蛋白表达
用鼠抗人CTLA-4单抗(2 μg/ml,100 μl/孔)包被ELISA板,4℃ 48 h,分别加入pCTLA-4/Ig或空载体Cpx/Ig转染上清,4°C过夜,PBS-T洗板×3,再加入辣根过氧化物酶标记的羊抗人IgG Fc抗体(1∶1 000),37°C 1 h,PBS-T洗板×3,然后加入显色液(邻苯二胺),室温10 min,2 mol/L H2SO4终止反应,酶联免疫仪测定D490。
, http://www.100md.com
1.6 表达产物的回收与纯化
根据ELISA检测确立的转染条件,大量转染COS-7细胞,回收48 h和96 h无血清培养上清,调节pH至7.0,用HiTrap Protein A亲和层析预装柱一步纯化融合蛋白,0.5 mol/L柠檬酸(pH3.0)洗脱,1mol/L Tris(pH9.0)调节pH至7.0,再对PBS透析12~16 h备用。
1.7 SDS-PAGE、Western印迹鉴定融合蛋白
SDS-PAGE采用垂直板不连续凝胶电泳法。常规灌制12%分离胶和4.65%浓缩胶,取经亲和层析法纯化后的样品和蛋白分子量标准以每孔20 μl加样,100 V恒压电泳4~6h,硝酸银染色,待蛋白带显示深棕色地终止显色反应;Western印迹:SDS-PAGE电泳结束后,取下凝胶,将蛋白质转印至PVDF膜(40 V, 95 mA,4°C,16 h),1%BSA封闭,室温1~2h,加入鼠抗人CTLA-4单克隆抗体(1∶1000稀释),4°C过夜,再加入HRP-羊抗鼠IgG多克隆抗体(1∶500稀释),37°C60 min,DAB显色,待特异性条带出现后,蒸馏水漂洗终止反应。
, http://www.100md.com
1.8 3H-TdR测定融合蛋白生物学活性
常规分离人外周血淋巴细胞,调整细胞密度为2×106 cells/ml,将两人PBMC(同种异体双向MLR)等体积混合后以2×105 cells/孔接种“U”型96孔培养板,加入不同体积的纯化融合蛋白,设置等体积相应空载体转染上清或培养基作对照,每组3复孔,37°C,5%CO2培养5 d,终止培养前16 h加入3H-TdR(终浓度5 μCi/ml),收集细胞于0.45 μm微孔滤膜上,烘干,液体闪烁计数仪测DPM值。
1.9 统计学处理
结果以
 ±s表示,Microsoft Excel统计程序进行均数差异显著性分析。
±s表示,Microsoft Excel统计程序进行均数差异显著性分析。, http://www.100md.com
2 结果
2.1 ELISA检测CTLA-4/Ig融合蛋白表达
在pCTLA-4/Ig质粒转染COS-7细胞所收集的48 h和96 h上清中,均能检测到CTLA-4/Ig融合蛋白表达,其中48 h上清的含量明显高于96 h上清含量。而空载体转染上清和用无关抗体包被的结果均接近空白对照,见表1。
表1 脂质体转染COS-7细胞上清的ELISA鉴定
Tab 1 ELISA analysis of COS-7 cell culture supernatant after DOSPER transfection Coated antibody
Supernatant
Result
, 百拇医药
Transfect supernatant
Second antibody
Anti-human CTLA-4
pCTLA-4/Ig 48 h
HRP-hIgGFc

Anti-human CTLA-4
pCTLA-4/Ig 96 h
HRP-hIgGFc
+
Anti-human CTLA-4
, http://www.100md.com
pX/Ig
Anti-human CTLA-4
-
Anti-human B7-1
pCTLA-4/Ig 48 h
HRP-hIgGFc
-
2.2 SDS-PAGE、Western印迹鉴定融合蛋白 pCTLA-4/Ig质粒和空载体pX/Ig转染上清直接进行SDS-PAGE检测,未见明显的与预期大小相符的蛋白条带(照片略);而将转染上清经Protein A亲和层析柱纯化,再进行SDS-PAGE检测,有一条分子量约为50×103的清晰蛋白条带,与预期分子量大小相符,见图1。且空载体转染的纯化物中相应位置无明显条带;以鼠的人CTLA-4单克隆抗体为一抗,HRP-羊抗鼠IgG多克隆抗体为二抗进行免疫印迹分析,结果表明,pCTLA-4/Ig质粒转染上清纯化物中,该50×103蛋白条带能与抗人CTLA-4单抗特异结合,见图2,而空载体转染纯化物中相应位置无特异显色带,说明该50×103蛋白条带正是我们所构建并表达的CTLA-4/Ig融合蛋白。

, http://www.100md.com
图1 Protein A亲和层析纯化CTLA-4/Ig融合蛋白的SDS-PAGE图谱
M:低分子量蛋白标准;1:pCTLA-4/Ig转染
COS-7上清;2:pX/Ig转染COS-7上清
Fig 1 SDS-PAGE of CTLA-4/Ig fusion protein after Protein A purification
M:Standard proteins marker,1:Supernatant after pCTLA-4/Ig
transfection,2:Supernatant after pX/Ig transfection

, http://www.100md.com
图2 CTLA-4/Ig融合蛋白免疫印迹图谱
M:低分子量蛋白标准;1:Protein A亲和层析
纯化pCTLA-4/Ig转染COS-7上清
Fig 2 Western Blot analysis of CTLA-4/Ig fusion protein
M:Standard proteins marker;1:Protein A purified
transfected supernatant (pCTLA-4/Ig)
2.3 纯化CTLA-4/Ig融合蛋白对PBMC增殖活性的影响
在MLR反应体系中,分别加入1 μl、5 μl和10 μl Protein A纯化pCTLA-4/Ig或空载体转染COS-7细胞上清,结果表明,即使加入1 μl Protein A纯化pCTLA-4/Ig融合蛋白,也能显著抑制人外周血MLR,抑制率为60%~70%;而加入同样体积的空载体转染COS-7细胞上清,则无此作用,经单因素方差分析,结果有统计学意义,见表2。同样,我们也曾用未纯化pCTLA-4/Ig转染上清直接进行MLR实验,未能观察到显著的抑制作用,这可能与未纯化细胞转染上清中异源蛋白的刺激作用与微量CTLA-4/Ig融合蛋白的抑制作用相互抵消有关。
, 百拇医药
表2 纯化CTLA-4/Ig对人MLR中淋巴细胞增殖的影响(DPM,n=3)
Tab 2 Effects of purified CTLA-4/Ig fusion protein
on human MLR (DPM,n=3) Group(μl/well)
0
1
5
10
Purified CTLA-4/Ig
4229±374
1698±257* △
, 百拇医药
1165±140* △
1101±183* △
Control
4229±374
3924±287
4198±334
4872±398
*:P<0.01 vs control;△:P<0.01 vs 0
3 讨论
融合蛋白表达载体pX/Ig具有人IgG1重链恒定区的铰链区及CH2,CH3结构域[3];通过逆转录-PCR扩增的CTLA-4胞膜外区基因片段具有Ig超家族可变区样结构域,将扩增的CTLA-4胞膜外区基因片段克隆入pX/Ig载体后获得的pCTLA-4/Ig融合蛋白表达载体,转染哺乳动物细胞后表达的融合蛋白有人Ig重链样结构,这不但可利用抗人CTLA-4抗体和抗人IgG Fc抗体的双抗体夹心ELISA法,检测以分泌蛋白形式表达的融合蛋白,还可利用蛋白A亲和层析法,从融合蛋白含量远低于血清、腹水等抗体含量的细胞培养上清中将融合蛋白高度纯化。在短暂表达系统中,外源蛋白的表达量与重组DNA对细胞的转染效率直接相关。为确立脂质体转染的最佳条件,对转染条件进行了优化。在DNA用量相同的情况下(1 μg/孔),不同的脂质体用量能明显影响融合蛋白的表达,若以相同的脂质体量与不同的DNA量混合制备脂质体-DNA复合物,外源蛋白的表达量则随DNA量增加而增加,但当DNA量达一定水平时,不能再提高融合蛋白表达。对pCTLA-4/Ig转染上清纯化后,在还原性SDS-PAGE中发现,除了在约50×103处出现与预期蛋白分子量一致的条带外,在相当于牛血清白蛋白分子量大小的67×103(与分子量标准比较)处也出现明显的蛋白条带;在Protein A纯化pX/Ig转染上清中未见50×103条带,而只有67×103蛋白条带;Western印迹检测发现:抗人CTLA-4单克隆抗体只能与SDS-PAGE中约50×103蛋白条带反应,且在pX/Ig转染上清样品的相应位置无显色带,因此,SDS-PAGE中出现的67×103蛋白条带可能是未去除干净牛血清白蛋白的细胞培养上清,由于流经蛋白A亲和层析柱的体积过大(>100倍柱床体积),未能彻底洗脱非特异性吸附的杂蛋白所至。MLR实验表明该纯化融合蛋白具有抑制免疫应答反应的活性。以上结果表明,我们成功克隆并在COS-7细胞中表达了有生物学活性的CTLA-4/Ig融合蛋白,为进一步大量表达纯化CTLA-4/Ig融合蛋白、及其免疫学活性研究和临床应用奠定了基础。
, 百拇医药
基金项目:国家自然科学基金资助重大项目(39993430-2);军队杰出人才基金资助项目(1996)
作者简介:易绍萱(1966-),女,重庆市万州区人,博士,主治医师,讲师,主要从事移植免疫方面的研究,发表论文10篇。电话:(023)68752688
作者单位:姜庆(第三军医大学附属西南医院烧伤研究所,重庆 400038)
罗高兴(第三军医大学附属西南医院烧伤研究所,重庆 400038)
周立新(第三军医大学附属西南医院烧伤研究所,重庆 400038)
肖光夏(第三军医大学附属西南医院烧伤研究所,重庆 400038)
参考文献:
, 百拇医药
[1] Linsley P S, Brady W, Urnes M, et al. CTLA-4 is a second receptor for the B cell activation antigen B7[J]. J Exp Med,1991,174(3):561-569.
[2] Boussiotis V A, Freeman G J, Gribben J G, et al. The role of B7-1/B7-2: CD28/CLTA-4 pathways in the prevention of anergy, induction of productive immunity and down-regulation of the immune response[J]. Immunol Rev,1996,153:5-26.
[3] Tarumi K, Yagihashi A, Tsuruma T, et al. Induction and maintenance of tolerance by CTLA-4/Ig in rat small bowel allografts[J]. Transplant Proc,1999,31(1-2):878-881.
, http://www.100md.com
[4] Elwood E T, Larsen C P, Cho H R, et al. Prolonged acceptance of concordant and discordant xenografts with combined CD40 and CD28 pathway blockade[J]. Transplantation,1998,65(11);1 422-1 428.
[5] Finck B K, Linsley P S, Wofsy D. Treatment of murine lupus with CTLA-4/Ig[J]. Science,1994,265(5176):1 225-1 227.
[6] Nishikawa K, Linsley P S, Collins A B, et al. Effect of CTLA-4 chimeric protein on rat autoimmune anti-glomerular basement membrane glomerulonephritis[J]. Eur J Immunol,1994,24(6):1 249-1 254.
[7] Seidman M. The development of transient SV40 based shuttle vectors mutagenesis studies: problems and solutions[J]. Mutat-Res,1989,220(2-3):55-60.
收稿日期:1999-11-25;修回日期:2000-03-10, 百拇医药