草鱼出血病病毒基因组的cDNA合成、克隆及部分序列分析
作者:田 静 邹桂平 方 勤
单位:中国科学院武汉病毒研究所,武汉 430071
关键词:草鱼出血病病毒;cDNA克隆;序列分析
中国病毒学990116 摘 要 采用差速离心的方法纯化感染草鱼出血病病毒的细胞悬液。提纯的病毒粒子经蛋白酶K处理和酚-氯仿抽提,在1%琼脂糖凝胶电泳条件下分离得到11条dsRNA,利用柱离心式胶回收试剂盒纯化各基因片段。纯化的dsRNA溶于90%的DMSO中,70℃变性15min,然后采用随机引物法反转录合成各基因片段的cDNA,并平头连接于pZErO 2.0载体的EcoRV位点,电转化TOP10感受态细胞。重组质粒经酶切、PCR扩增得到大小不等的插入片段,cDNA-RNA斑点杂交的结果进一步证实其插入为目的基因片段。采用循环PCR测序的方法,对其插入片段进行了序列测定,对其中第11片段的部分序列作了报道。
, http://www.100md.com
cDNA Synthesis, Cloning and Partial Nucleotide Sequence
of Grass Carp Hemorrhage Virus (GCHV)
Tian Jing Zou Guiping Fang Qin
(Wuhan Institute of Virology, Academia Sinica, Wuhan 430071)
Abstract Grass Carp Hemorrhage Virus (GCHV) was purified from infected fish cell culture by using different centrifugation. Its total genome was isolated by proteinase K treatment following phenol/chloroform extraction. The individual segment of GCHV-dsRNA was separated by running 1% agarose gel electrophoresis and recovered by Gel Extraction Kit. Each segment was denatured in 90% DMSO by heating at 70℃ for 15min. The cDNAs of several segments were synthesized with random hexamers method and cloned into EcoRV site of pZErO 2.0 vector, then transformed into TOP10 E.coli competent cell by electroporation transformation. It was showed that the recombinant plasmids contained GCHV-RNA genome of interest by dot hybridization besides both restriction analysis and PCR amplification. The partial DNA sequence of GCHV segment 11 was analysed.
, 百拇医药
Key words Grass Carp Hemorrhage Virus, cDNA cloning, cDNA sequence
草鱼出血病病毒为我国分离的第一株鱼类病毒,近年来的研究结果表明,该病毒为呼肠孤病毒科一新成员[1]。根据对该病毒的体外转录及转译研究,证实该病毒含内源RNA聚合酶[2],其病毒基因组具有mRNA的性质[3]。多肽的基因定位[4]结果表明,各基因片段与其编码的病毒多肽基本呈对应关系。为进一步了解该病毒的分子生物学性质、弄清各基因片段的结构与功能以及内在联系,我们对该病毒基因组进行了cDNA合成、克隆及序列分析,现将结果报道如下:
1 材料与方法
1.1 材料
1.1.1 细胞与病毒毒株
, 百拇医药
实验所用细胞为鱼肾CIK细胞系,病毒材料为本实验室分离的GCHV873毒株[5]。
1.1.2 试剂
cDNA合成试剂盒及一些酶类购自BRL公司。PCR扩增试剂及Taq酶为Perkin Elmer产品。克隆试剂盒购自Invitrogen公司。柱离心式胶回收试剂盒及PCR纯化试剂盒为华舜公司产品(上海)。32P系列产品购自亚辉生物公司(北京)。限制性内切酶类为华美公司产品。DNA测序试剂盒为Epicentre Technologies产品。
1.2 方法
1.2.1 病毒分离及基因组纯化
感染病毒的细胞悬液用差速离心方法[5]进行分离。纯化的病毒粒子经100ng/mL蛋白酶K及0.1%SDS消化后,用酚—氯仿提取病毒核酸。纯化的病毒核酸经1%琼脂糖凝胶电泳分离,紫外灯下切下各电泳条带,采用胶回收试剂盒进行各片段的纯化。纯化后的各基因片段经无水乙醇沉淀后,溶于少量无RNA酶的双蒸水中,于-20℃保存备用。
, 百拇医药
1.2.2 病毒基因片段的cDNA合成
取纯化的病毒基因片段2μg溶于10μL 90%DMSO中,70℃加热15min使之变性。cDNA合成参考Cashdollar[6]等人的方法。用随机引物法引导合成cDNA第一链,然后用0.5mol/L NaOH 37℃保温30min,以降解RNA模板,再用HC1中和。通过PCR纯化试剂盒除去引物六聚体,50℃条件下使其两条链退火形成双链cDNA,最后用DNA Polymerase大片段将cDNA末端补平。
1.2.3 cDNA克隆
各基因片段cDNA的克隆按克隆试剂盒指南进行。先用EcoRV酶解pZErO 2.0质粒,使其成为平头末端,与双链cDNA进行平头连接,电转化TOP10感受态细胞,电转化感受态细胞的制备按试剂盒指南进行。转化的细胞于SOC培养基中37℃保温30min后,涂布于含有Kanamycin(50ng/mL)的LB平板,37℃过夜培养。同时设置非重组质粒为阴性对照。
, 百拇医药
1.2.4 重组质粒的筛选与鉴定
挑选单个菌落接种于2mL含Kanamycin的LB培养基中进行小量培养,用煮沸法快速制备质粒DNA[7]。琼脂糖凝胶电泳及双酶切鉴定重组子。同时利用质粒载体SP6及T7启动子位点引物进行PCR扩增。PCR扩增条件为94℃变性30sec,50℃退火1min,70℃延伸2min,循环35次。
1.2.5 cDNA探针的合成及斑点杂交
采用缺口平移法标记克隆的cDNA片段,斑点杂交按分子克隆方法进行[7]。
1.2.6 DNA序列分析
双链质粒DNA序列测定按Sequi Therm EXCELTM DNA测序试剂盒进行。
, 百拇医药
2 结果
2.1 草鱼出血病病毒基因片段的分离及纯化
GCHV-dsRNA在7% SDS-聚丙烯酰胺凝胶电泳中呈现11条带,按其电泳图谱的大小顺序可分为四组[1]。I组为1~3片段,Ⅱ组为4~6片段,Ⅲ组为7~9片段,第Ⅳ组为10、11片段。为获得足够量的GCHV-dsRNA单个片段,我们将提纯的病毒核酸在1%琼脂糖凝胶上进行电泳分离,然后采用胶回收试剂盒纯化回收的单一片段,得到了大于70%的回收率。由于大分子片段(1、2、3和4、5)在该电泳条件下(60mA,90min)不能彼此分开,故我们采用两轮胶回收分离纯化的方法以获得单一大分子片段。为检查其回收效果,将电泳回收的11条RNA片段与GCHV-dsRNA基因组同时进行电泳(60mA,90min),所得结果见图1。从图中可以看到,回收的单一片段的迁移率与基因组中对应的片段完全吻合,完整性很好。由于大分子片段1~3及4、5在短距离凝胶电泳条件下泳动率基本相同,故图中所示胶回收的1~3及4、5片段的迁移率无明显差别。
, 百拇医药
图1 GCHV基因组及各片段的琼脂糖凝胶电泳
1,14:1kb DNA标准分子量;2:GCHV dsRNA;3~13:GCHV 各基因片段
Fig.1 GCHV dsRNA and individual dsRNA segments in 1% agarose gel
2.2 基因片段的cDNA合成
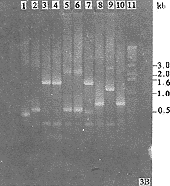
采用随机引物法反转录合成的cDNA第一链经碱降解RNA,HC1中和后,使分别以双链RNA为模板合成的两条互补的cDNA链退火形成双链DNA。图2显示随机引物法合成的第11片段cDNA。从图中可以看到其cDNA条带散布于400~850bp范围内,其上限区域基本与第11片段的分子量大小一致。由于随机引物法引导合成cDNA起始位点不同,故其产物由大小不同的片段组成。
, 百拇医药
图2 GCHV第11片段(S11)的cDNA
A: 1kb DNA 标准分子量; B: 所合成的GCHV第11片段的cDNA
Fig.2 cDNA synthesis of GCHV S11
A: 1kb DNA ladder;
B: Synthesized cDNA of GCHV S11
2.3 重组质粒的酶切鉴定、PCR扩增及斑点杂交
重组质粒的酶切鉴定、PCR扩增及斑点杂交结果见图3(A、B、C)。图3A、3B显示通过双酶切及PCR扩增,得到的大小不同插入片段的重组质粒。采用32P标记的第11片段的cDNA克隆与GCHV基因组RNA及分离的单一的第11片段在68℃条件下进行点杂交,其结果为阳性。阴性对照无斑点出现。由此可见,实验所得的GCHV单一片段的阳性克隆为相应的目的基因片段。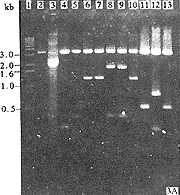
, 百拇医药
图3 重组质粒的酶切鉴定、PCR扩增及斑点杂交
3A.1:1kb DNA标准分子量 2:线性化的pZErO 2.0质粒
3:超螺旋和线性化的pZErO 2.0质粒
4~5:BamHI和XhoI消化的第9片段(S9)的重组质粒
6~10:BamHI和XhoI消化的第6片段(S6)的重组质粒
11~13:BamHI和XhoI消化的第11片段(S11)的重组质粒
3B.1~4:第6片段(S6)PCR扩增产物
5~7:第9片段(S9)PCR扩增产物
, 百拇医药 8~10:第11片段(S11)PCR扩增产物
11:1 kb DNA标准分子量
Fig.3 Restriction Analysis, RCR Amplification
and Dot hybridization of recombinant plasmids
3A.1:1 kb DNA ladder 2:Linearized pZErO 2.0
3:Supercoiled and Linearized pZErO 2.0
4~5:Digested recombinant plasmids of S9 by BamHI and XhoI
, 百拇医药
6~10:Digested recombinant plasmids of S6 by BamHI and XhoI
11~13:Digested recombinant plasmids of S11 by BamHI and XhoI
3B.1~4:PCR amplification products of S6
5~7:PCR amplification products of S9
8~10:PCR amplification products of S11
11:1 kb DNA ladder
, 百拇医药
3C.a1-3: GCHV第11片段的RNA
b1.3: GCHV基因组RNA b2: λDNA 阴性对照
3C.a 1~3: GCHV S11 RNA b1.3: GCHV genome RNA b2: λDNA Negative control
2.4 GCHV基因组第11片段的部分序列测定
在对草鱼出血病病毒核酸特异性的研究中,已测得GCHV873第11片段的大小为860bp[1]。选择经酶切鉴定插入为500bp及650bp左右的第11片段(S11)重组质粒,进行DNA序列测定。采用SP6及T7通用引物同时进行正反序列测定,通过重复序列区域分析,得到了第11片段共713bp的序列(见图4)。对于较大片段的插入子,我们正继续构建亚克隆,以期得到其全基因序列。
, 百拇医药
图4 GCHV第11片段的部分cDNA序列分析(713bp)
Fig.4 Partial cDNA Sequence of GCHV S11(713bp)
3 讨论
GCHV为双链分段RNA病毒。国际病毒学会分类委员会于1991年将其纳入呼肠孤病毒科新建水生呼肠孤病毒属,可见对其基因组的克隆及序列分析,不仅将为该属的分子生物学性质研究积累资料,且意义深远。研究证实,呼肠孤病毒科基因组RNA的3′末端不具备Poly(A)尾[8]。对于无Poly(A)尾的RNA一般采用Poly(A)Polymerase进行Poly(A)加尾,然后用Oligo(dT)作引物合成cDNA,或直接用随机引物法反转录合成cDNA。由于Poly(A)加尾反应效率低,加尾数难以控制,故经常造成实验失败。作者采用随机引物法合成cDNA,省略了Poly(A)加尾步骤,同时采用加大模板及反转录酶用量的方法以提高cDNA全长合成效率。此外,我们采用碱降解RNA,使其互补的cDNA复性为双链DNA,省略了第二链的合成。此法较常规第一链合成后,用发卡结构引导第二链合成后用S1酶消化显得更为简单,且更易得到近乎全长的cDNA。根据我们所选用的pZErO2.0质粒载体的特性,以致死基因的表达为选择标记,平头连接经DNA聚合酶补平的cDNA,使克隆及筛选更为快捷有效。
, 百拇医药
呼肠孤病毒科的不同属均具有不同末端序列。根据目前的序列分析结果,很难定义GCHV5′、3′末端序列。我们正利用外切酶降解的方法,继续构建亚克隆并结合DNA自动测序,以期得到第11片段的全长基因序列及其它片段的完整序列。
致谢 作者衷心感谢美国彼兹堡大学医学院分子遗传及生物化学系Prof.Bo Liu对该工作给予的大力支持和帮助。
* 本课题属国家自然科学基金资助项目
** 通讯作者
参考文献
[1] 柯丽华,方勤,蔡宜权. 一株新的草鱼出血病分离物特性. 水生生物学报,1990,14
(2):153~159
, http://www.100md.com [2] 黄捷,柯丽华,察宜权. 草鱼出血病病毒的RNA转录酶活性研究. 病毒学报,1992,8:49~56
[3] 柯丽华,王炜,方勤等. 草鱼出血病病毒多肽及基因组的体外翻译. 病毒学报,1992,8:169~173
[4] 王炜,蔡宜权,方勤等. 草鱼出血病病毒多肽的基因定位. 中国病毒学,1994,9(4):356~361
[5] 方勤,柯丽华,蔡宜权. 草鱼出血病病毒生长特性及高滴价培养. 病毒学杂志,1989,3:315~319
[6] Cashdollar L W, Esparza J, Hudson G R et al. Cloning the double-stranded RNA genes of reovirus: Sequence of the cloned S2 gene. Biochemistry, 1982,79:7644~7648
, 百拇医药
[7] Sambrook J, Fritsch E F, Maniatis T. Molecular cloning, A laboratory manual, 2nd ed. USA, NY: Cold Spring Harbor, 1998,22~23,474~490
[8] Imai M, Richardson M A, Ikegami N et al. Cloning and nucleotide sequencing of reoviride genomes. In: Richard W et al eds. Double-Stranded RNA Viruses. Elsevier Biomedical, 1983,15~26
收稿日期: 1998-09-16,修回日期: 1998-11-10, 百拇医药
单位:中国科学院武汉病毒研究所,武汉 430071
关键词:草鱼出血病病毒;cDNA克隆;序列分析
中国病毒学990116 摘 要 采用差速离心的方法纯化感染草鱼出血病病毒的细胞悬液。提纯的病毒粒子经蛋白酶K处理和酚-氯仿抽提,在1%琼脂糖凝胶电泳条件下分离得到11条dsRNA,利用柱离心式胶回收试剂盒纯化各基因片段。纯化的dsRNA溶于90%的DMSO中,70℃变性15min,然后采用随机引物法反转录合成各基因片段的cDNA,并平头连接于pZErO 2.0载体的EcoRV位点,电转化TOP10感受态细胞。重组质粒经酶切、PCR扩增得到大小不等的插入片段,cDNA-RNA斑点杂交的结果进一步证实其插入为目的基因片段。采用循环PCR测序的方法,对其插入片段进行了序列测定,对其中第11片段的部分序列作了报道。
, http://www.100md.com
cDNA Synthesis, Cloning and Partial Nucleotide Sequence
of Grass Carp Hemorrhage Virus (GCHV)
Tian Jing Zou Guiping Fang Qin
(Wuhan Institute of Virology, Academia Sinica, Wuhan 430071)
Abstract Grass Carp Hemorrhage Virus (GCHV) was purified from infected fish cell culture by using different centrifugation. Its total genome was isolated by proteinase K treatment following phenol/chloroform extraction. The individual segment of GCHV-dsRNA was separated by running 1% agarose gel electrophoresis and recovered by Gel Extraction Kit. Each segment was denatured in 90% DMSO by heating at 70℃ for 15min. The cDNAs of several segments were synthesized with random hexamers method and cloned into EcoRV site of pZErO 2.0 vector, then transformed into TOP10 E.coli competent cell by electroporation transformation. It was showed that the recombinant plasmids contained GCHV-RNA genome of interest by dot hybridization besides both restriction analysis and PCR amplification. The partial DNA sequence of GCHV segment 11 was analysed.
, 百拇医药
Key words Grass Carp Hemorrhage Virus, cDNA cloning, cDNA sequence
草鱼出血病病毒为我国分离的第一株鱼类病毒,近年来的研究结果表明,该病毒为呼肠孤病毒科一新成员[1]。根据对该病毒的体外转录及转译研究,证实该病毒含内源RNA聚合酶[2],其病毒基因组具有mRNA的性质[3]。多肽的基因定位[4]结果表明,各基因片段与其编码的病毒多肽基本呈对应关系。为进一步了解该病毒的分子生物学性质、弄清各基因片段的结构与功能以及内在联系,我们对该病毒基因组进行了cDNA合成、克隆及序列分析,现将结果报道如下:
1 材料与方法
1.1 材料
1.1.1 细胞与病毒毒株
, 百拇医药
实验所用细胞为鱼肾CIK细胞系,病毒材料为本实验室分离的GCHV873毒株[5]。
1.1.2 试剂
cDNA合成试剂盒及一些酶类购自BRL公司。PCR扩增试剂及Taq酶为Perkin Elmer产品。克隆试剂盒购自Invitrogen公司。柱离心式胶回收试剂盒及PCR纯化试剂盒为华舜公司产品(上海)。32P系列产品购自亚辉生物公司(北京)。限制性内切酶类为华美公司产品。DNA测序试剂盒为Epicentre Technologies产品。
1.2 方法
1.2.1 病毒分离及基因组纯化
感染病毒的细胞悬液用差速离心方法[5]进行分离。纯化的病毒粒子经100ng/mL蛋白酶K及0.1%SDS消化后,用酚—氯仿提取病毒核酸。纯化的病毒核酸经1%琼脂糖凝胶电泳分离,紫外灯下切下各电泳条带,采用胶回收试剂盒进行各片段的纯化。纯化后的各基因片段经无水乙醇沉淀后,溶于少量无RNA酶的双蒸水中,于-20℃保存备用。
, 百拇医药
1.2.2 病毒基因片段的cDNA合成
取纯化的病毒基因片段2μg溶于10μL 90%DMSO中,70℃加热15min使之变性。cDNA合成参考Cashdollar[6]等人的方法。用随机引物法引导合成cDNA第一链,然后用0.5mol/L NaOH 37℃保温30min,以降解RNA模板,再用HC1中和。通过PCR纯化试剂盒除去引物六聚体,50℃条件下使其两条链退火形成双链cDNA,最后用DNA Polymerase大片段将cDNA末端补平。
1.2.3 cDNA克隆
各基因片段cDNA的克隆按克隆试剂盒指南进行。先用EcoRV酶解pZErO 2.0质粒,使其成为平头末端,与双链cDNA进行平头连接,电转化TOP10感受态细胞,电转化感受态细胞的制备按试剂盒指南进行。转化的细胞于SOC培养基中37℃保温30min后,涂布于含有Kanamycin(50ng/mL)的LB平板,37℃过夜培养。同时设置非重组质粒为阴性对照。
, 百拇医药
1.2.4 重组质粒的筛选与鉴定
挑选单个菌落接种于2mL含Kanamycin的LB培养基中进行小量培养,用煮沸法快速制备质粒DNA[7]。琼脂糖凝胶电泳及双酶切鉴定重组子。同时利用质粒载体SP6及T7启动子位点引物进行PCR扩增。PCR扩增条件为94℃变性30sec,50℃退火1min,70℃延伸2min,循环35次。
1.2.5 cDNA探针的合成及斑点杂交
采用缺口平移法标记克隆的cDNA片段,斑点杂交按分子克隆方法进行[7]。
1.2.6 DNA序列分析
双链质粒DNA序列测定按Sequi Therm EXCELTM DNA测序试剂盒进行。
, 百拇医药
2 结果
2.1 草鱼出血病病毒基因片段的分离及纯化
GCHV-dsRNA在7% SDS-聚丙烯酰胺凝胶电泳中呈现11条带,按其电泳图谱的大小顺序可分为四组[1]。I组为1~3片段,Ⅱ组为4~6片段,Ⅲ组为7~9片段,第Ⅳ组为10、11片段。为获得足够量的GCHV-dsRNA单个片段,我们将提纯的病毒核酸在1%琼脂糖凝胶上进行电泳分离,然后采用胶回收试剂盒纯化回收的单一片段,得到了大于70%的回收率。由于大分子片段(1、2、3和4、5)在该电泳条件下(60mA,90min)不能彼此分开,故我们采用两轮胶回收分离纯化的方法以获得单一大分子片段。为检查其回收效果,将电泳回收的11条RNA片段与GCHV-dsRNA基因组同时进行电泳(60mA,90min),所得结果见图1。从图中可以看到,回收的单一片段的迁移率与基因组中对应的片段完全吻合,完整性很好。由于大分子片段1~3及4、5在短距离凝胶电泳条件下泳动率基本相同,故图中所示胶回收的1~3及4、5片段的迁移率无明显差别。

, 百拇医药
图1 GCHV基因组及各片段的琼脂糖凝胶电泳
1,14:1kb DNA标准分子量;2:GCHV dsRNA;3~13:GCHV 各基因片段
Fig.1 GCHV dsRNA and individual dsRNA segments in 1% agarose gel
2.2 基因片段的cDNA合成
采用随机引物法反转录合成的cDNA第一链经碱降解RNA,HC1中和后,使分别以双链RNA为模板合成的两条互补的cDNA链退火形成双链DNA。图2显示随机引物法合成的第11片段cDNA。从图中可以看到其cDNA条带散布于400~850bp范围内,其上限区域基本与第11片段的分子量大小一致。由于随机引物法引导合成cDNA起始位点不同,故其产物由大小不同的片段组成。

, 百拇医药
图2 GCHV第11片段(S11)的cDNA
A: 1kb DNA 标准分子量; B: 所合成的GCHV第11片段的cDNA
Fig.2 cDNA synthesis of GCHV S11
A: 1kb DNA ladder;
B: Synthesized cDNA of GCHV S11
2.3 重组质粒的酶切鉴定、PCR扩增及斑点杂交
重组质粒的酶切鉴定、PCR扩增及斑点杂交结果见图3(A、B、C)。图3A、3B显示通过双酶切及PCR扩增,得到的大小不同插入片段的重组质粒。采用32P标记的第11片段的cDNA克隆与GCHV基因组RNA及分离的单一的第11片段在68℃条件下进行点杂交,其结果为阳性。阴性对照无斑点出现。由此可见,实验所得的GCHV单一片段的阳性克隆为相应的目的基因片段。


, 百拇医药
图3 重组质粒的酶切鉴定、PCR扩增及斑点杂交
3A.1:1kb DNA标准分子量 2:线性化的pZErO 2.0质粒
3:超螺旋和线性化的pZErO 2.0质粒
4~5:BamHI和XhoI消化的第9片段(S9)的重组质粒
6~10:BamHI和XhoI消化的第6片段(S6)的重组质粒
11~13:BamHI和XhoI消化的第11片段(S11)的重组质粒
3B.1~4:第6片段(S6)PCR扩增产物
5~7:第9片段(S9)PCR扩增产物
, 百拇医药 8~10:第11片段(S11)PCR扩增产物
11:1 kb DNA标准分子量
Fig.3 Restriction Analysis, RCR Amplification
and Dot hybridization of recombinant plasmids
3A.1:1 kb DNA ladder 2:Linearized pZErO 2.0
3:Supercoiled and Linearized pZErO 2.0
4~5:Digested recombinant plasmids of S9 by BamHI and XhoI
, 百拇医药
6~10:Digested recombinant plasmids of S6 by BamHI and XhoI
11~13:Digested recombinant plasmids of S11 by BamHI and XhoI
3B.1~4:PCR amplification products of S6
5~7:PCR amplification products of S9
8~10:PCR amplification products of S11
11:1 kb DNA ladder

, 百拇医药
3C.a1-3: GCHV第11片段的RNA
b1.3: GCHV基因组RNA b2: λDNA 阴性对照
3C.a 1~3: GCHV S11 RNA b1.3: GCHV genome RNA b2: λDNA Negative control
2.4 GCHV基因组第11片段的部分序列测定
在对草鱼出血病病毒核酸特异性的研究中,已测得GCHV873第11片段的大小为860bp[1]。选择经酶切鉴定插入为500bp及650bp左右的第11片段(S11)重组质粒,进行DNA序列测定。采用SP6及T7通用引物同时进行正反序列测定,通过重复序列区域分析,得到了第11片段共713bp的序列(见图4)。对于较大片段的插入子,我们正继续构建亚克隆,以期得到其全基因序列。

, 百拇医药
图4 GCHV第11片段的部分cDNA序列分析(713bp)
Fig.4 Partial cDNA Sequence of GCHV S11(713bp)
3 讨论
GCHV为双链分段RNA病毒。国际病毒学会分类委员会于1991年将其纳入呼肠孤病毒科新建水生呼肠孤病毒属,可见对其基因组的克隆及序列分析,不仅将为该属的分子生物学性质研究积累资料,且意义深远。研究证实,呼肠孤病毒科基因组RNA的3′末端不具备Poly(A)尾[8]。对于无Poly(A)尾的RNA一般采用Poly(A)Polymerase进行Poly(A)加尾,然后用Oligo(dT)作引物合成cDNA,或直接用随机引物法反转录合成cDNA。由于Poly(A)加尾反应效率低,加尾数难以控制,故经常造成实验失败。作者采用随机引物法合成cDNA,省略了Poly(A)加尾步骤,同时采用加大模板及反转录酶用量的方法以提高cDNA全长合成效率。此外,我们采用碱降解RNA,使其互补的cDNA复性为双链DNA,省略了第二链的合成。此法较常规第一链合成后,用发卡结构引导第二链合成后用S1酶消化显得更为简单,且更易得到近乎全长的cDNA。根据我们所选用的pZErO2.0质粒载体的特性,以致死基因的表达为选择标记,平头连接经DNA聚合酶补平的cDNA,使克隆及筛选更为快捷有效。
, 百拇医药
呼肠孤病毒科的不同属均具有不同末端序列。根据目前的序列分析结果,很难定义GCHV5′、3′末端序列。我们正利用外切酶降解的方法,继续构建亚克隆并结合DNA自动测序,以期得到第11片段的全长基因序列及其它片段的完整序列。
致谢 作者衷心感谢美国彼兹堡大学医学院分子遗传及生物化学系Prof.Bo Liu对该工作给予的大力支持和帮助。
* 本课题属国家自然科学基金资助项目
** 通讯作者
参考文献
[1] 柯丽华,方勤,蔡宜权. 一株新的草鱼出血病分离物特性. 水生生物学报,1990,14
(2):153~159
, http://www.100md.com [2] 黄捷,柯丽华,察宜权. 草鱼出血病病毒的RNA转录酶活性研究. 病毒学报,1992,8:49~56
[3] 柯丽华,王炜,方勤等. 草鱼出血病病毒多肽及基因组的体外翻译. 病毒学报,1992,8:169~173
[4] 王炜,蔡宜权,方勤等. 草鱼出血病病毒多肽的基因定位. 中国病毒学,1994,9(4):356~361
[5] 方勤,柯丽华,蔡宜权. 草鱼出血病病毒生长特性及高滴价培养. 病毒学杂志,1989,3:315~319
[6] Cashdollar L W, Esparza J, Hudson G R et al. Cloning the double-stranded RNA genes of reovirus: Sequence of the cloned S2 gene. Biochemistry, 1982,79:7644~7648
, 百拇医药
[7] Sambrook J, Fritsch E F, Maniatis T. Molecular cloning, A laboratory manual, 2nd ed. USA, NY: Cold Spring Harbor, 1998,22~23,474~490
[8] Imai M, Richardson M A, Ikegami N et al. Cloning and nucleotide sequencing of reoviride genomes. In: Richard W et al eds. Double-Stranded RNA Viruses. Elsevier Biomedical, 1983,15~26
收稿日期: 1998-09-16,修回日期: 1998-11-10, 百拇医药