成人甲状腺机能亢进症治疗后的癌症死亡率
作者:王 杉
单位:
关键词:
美国医学会杂志中文版990304 Cancer Mortality Following Treatment for Adult Hyperthyroidism
Marlene B. Goldman, ScD; Benjamin S. H. Harris IIIf; Daniel A. Hoffman, PhD; William M. McConahey, MD; Harry R. Maxon, MD; Susan Preston-Martin. PhD; M. Ellen Warshauer, MS; F. Lennie Wong, PhD; John D. Boice, Jr, ScD; for the Cooperative Thyrotoxicosis Therapy Follow-up Study Group
, 百拇医药
背景——在美国,大多数成人甲状腺机能亢进患者均采用高剂量131I治疗。虽然几乎没有证据表明治疗性131I与癌症的发生有关,但是对其广泛应用仍需进一步评估。
目的——评估甲状腺机能亢进患者的癌症死亡率,特别是采用131I治疗的患者。
设计——回顾性队列研究。
地点——25所美国医院和一所英国医院。
病例——1946~1964年原“甲状腺毒症治疗随访协作研究”中的35 593例甲状腺机能亢进患者;其中91%为原发性甲状腺机能亢进,女性占79%,65%的病例应用131I治疗。
主要预后指标——三种方法治疗甲状腺机能亢进症后的标准化癌症死亡率比(SMRs)。
, 百拇医药
结果——研究队列中,50.5%的患者在1990年12月随访结束时已死亡。其癌症死亡数接近总人口预期死亡率(2 950/2 857.6),但肺癌、乳腺癌、肾癌和甲状腺癌的死亡率略高,子宫癌和前列腺癌的死亡率则低于预期死亡率。毒性结节性甲状腺肿患者的标准化死亡率比为1.16(95%可信区间[CI],1.03~1.30)。单纯应用抗甲状腺药物治疗者,治疗1年后癌症死亡的危险增加(SMR 1.31;95%CI 1.06~1.60)。除甲状腺癌外(SMR 3.94;95%CI 2.52~5.86),放射性碘与总癌症死亡率(SMR 1.02; 95%CI 0.98~1.07)或任何其他癌症无关。
结论——甲状腺机能亢进和131I均不造成总癌症死亡率的明显增加。尽管131I治疗后甲状腺癌死亡率有所增加,但死亡数增加很小而且甲状腺疾病本身也起一定作用。总之,131I是一种安全的治疗甲状腺机能亢进症的方法。
, http://www.100md.com 甲状腺机能亢进相当常见,尤其是在女性。在美国,80%以上的甲状腺机能亢进症为原发性甲亢(Graves病),其发病率介于0.02%~1%之间1-3。甲状腺机能亢进可用放射碘(131I)、手术(甲状腺次全切除术)或抗甲状腺制剂治疗,但是在美国大多数成人患者均采用131I治疗4。131I治疗的广泛应用引起人们对其潜在致癌性和致白血病性的关注,尽管几乎没有证据支持这种怀疑5-9。由于1986年切尔诺贝利核事故及以往核反应堆和核试验中131I的释放,近来有关131I接触对健康的影响重新引起公众的注意。
“甲状腺毒症治疗随访协作研究”(以下简称“甲状腺随访研究”——译者注)始于1961年。它包括1946~1964年26所医院收治的35 609例甲状腺机能亢进症患者。1968年研究结束时,平均随访期为8.2年。与其他患者比较,采用131I治疗者甲状腺癌的发病率、死亡率10以及白血病的发病率5并无显著增加。最近对Mayo医院(Rochester市,Minn州)和麻省总医院(波士顿市)的患者进行随访亦显示总癌症死亡率与131I治疗无关11,12。然而,在Mayo医院,采用131I治疗的患者,碘浓集器官的癌症发病率增加13(相对危险[RR]1.8;95%CI 1.1~3.2)。在麻省总医院,乳腺癌的发生率轻度增加(RR 1.3;95%CI 0.8~1.9)14。在瑞典,虽然甲状腺机能亢进的131I治疗与白血病(标准化死亡率比[SMR]0.98;95% CI 0.64~1.42)或乳腺癌的死亡率(SMR 0.86;95% CI 0.69~1.02)无关;但是呼吸道癌(SMR 1.26;95%CI 1.04~1.49)和消化道癌的死亡率(SMR 1.14,95%CI 1.03~1.25)则显著上升。随访头10年甲状腺癌的死亡率增加(SMR 3.22;95%CI 1.54~5.98),但在10年后这种现象完全消失(SMR 0.66;95%CI 0.08~2.37)15。为评估甲状腺机能亢进治疗的远期致癌作用,我们对截止1990年的甲状腺随访研究病例的死亡率进行了随访观察。





, 百拇医药
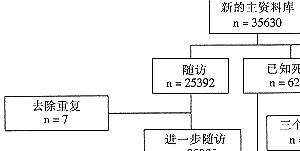
附图 研究数据流程图
方 法
最初的甲状腺随访研究包括1946年1月至1964年12月31日25所美国和1所英国医学中心收治所有甲亢病例(表1)。治疗方法包括131I、甲状腺手术、抗甲状腺药物或这些疗法的组合。从病历记录摘取有关临床数据,将甲状腺机能亢进分为原发性(91%)、毒性结节性甲状腺肿(8%)及原因未明(1%)三类。40%的病例在入组前曾应用某些针对性的治疗,其中75%单用抗甲状腺药物,22%单行甲状腺切除术或结合服用抗甲状腺药物。2%单独应用131I或结合其它疗法。在无病历记载时,随访资料从经治医师、医院或患者获得。第一次随访结束时,6 228例患者(17.5%)死亡,1 432例(4.0%)失访。最初的研究方法已有文献5,10,16,17描述。
应用计算机表格、缩微照片、缩微影盒及手写资料,于1984年建立了包括最初35 630例患者的主资料库(附图)。国立癌症研究所(NCH)与4个地区研究中心(波士顿哈佛大学、纽约Sloan-Kettering癌症中心、洛山矶南加州大学以及北卡罗来纳Triangle研究学院及研究中心)合作,进行了第二次死亡率随访列队研究。有4 010例未包括在内,其中1 414例来自其他地区的3个小治疗中心;另2 596例在完成第一次研究后已从经治医院记录中删除。将这些病例从进一步随访中删除是因为技术原因和无法与病例特点相联。删除这些病例后,31 620例患者符合进一步随访标准。由于在第一次随访时已有6 228例患者死亡,故只能对其余25 392例继续随访。在摘取补充鉴定资料后,使用国家死亡索引、卫生保健资金筹集署、社会安全局、国立人寿统计室、国立机动车管理局、当地追访系统以及商业追访公司的资料记录进行追访。死亡病例均获得死亡证明复印件,并根据国际疾病分类第8版(ICD-8)进行编码18。第一次随访研究的死亡原因,由经过训练的疾病分类学家,根据ICD-719和ICD-8重新编码。最终有35593例患者被编入本列队研究。
, 百拇医药
表1 治疗中心与研究人群 治疗中心
例数(%)*
Mayo医院,Rochester市,New York州
5068(14.2)
Lahey医院,Boston市,Massachusetts州
4282(12.0)
Mount Sinai医院,New York市,New York州
3169(8.9)
Cedars Sinai医学中心,Los
Angeles市,California州
, 百拇医药
2514(7.1)
Columbia Presbyterian医院,New York市,New York州
2373(6.7)
Massachusetts总医院,Boston市
2345(6.6)
Los Angeles县医院,Los
Angeles市,California州
1786(5.0)
New York医院-Cornell医学中心,New York市,1473(4.1)
, 百拇医药
Michigan大学,Ann Arbor市
1275(3.6)
Cleveland大学医院,Cleveland市,Ohio州
1111(3.1)
California大学,San Francisco市
1064(3.0)
Beth Israel医院,Boston市,Massachusetts州
1042(2.9)
Maryland大学,Baltimore市
978(2.7)
, 百拇医药
Montefiore医学中心,New
York市,New York州
952(2.7)
White Memorial医院,Los
Angeles市,California州
841(2.4)
Cincinnati大学,Cincinnati市,Ohio州
785(2.2)
St Louis大学,St Louis市,Missouri州
762(2.1)
, 百拇医药
Ochsner医院,New Orleans市,Louisana州
585(1.6)
Memorial Sloan-Kettering医院,New York市,New York州
573(1.6)
Strong Memorial医院,Rochester市,New York州
466(1.3)
Cleveland Metropolitan总医院,Cleveland市,Ohio州
450(1.3)
Sheffield医院,英国
, http://www.100md.com
1699(4.8)
* 包括最终研究人群35 593例 包括Veterans Affairs Wadsworth, Veterans Affairs Long Beach, Los Angeles市California大学南California大学和一些私人医院
包括Veterans Affairs Wadsworth, Veterans Affairs Long Beach, Los Angeles市California大学南California大学和一些私人医院 因技术原因,这次研究对这些中心没有进行随访
因技术原因,这次研究对这些中心没有进行随访
在主要分析中,我们对实际死亡数与预期死亡率(以美国全国死亡率为依据)进行了比较。以患者入选至死亡、最后存活日期(失访患者)或随访结束时(至1990年12月31日仍存活者)的时间为准,计算人-年危险数。将观察样本假定为泊松(Poisson)分布,计算其标准化死亡率比(实际死亡数/预期死亡数)和95%可信区间。不同病因预期死亡数用相应危险人-年时之不同年龄、性别、种族、年度死亡率计算20。由于我们用美国死亡率作为参照,所以须将1 699例英国患者从这些分析中去除。此外,还有146例因性别、出生日期、入组日期缺失而被剔除,最终剩下33 748例患者。
, 百拇医药
分别对原发性甲亢和毒性结节性甲状腺肿患者以及施实的7种治疗进行SMR分析。7种治疗包括:131I+药物;手术;手术+药物;131 I治疗;131I+手术;131I+手术+药物以及单纯药物治疗。实际上,由于4组131I治疗患者和二组手术患者结果相同,我们只展示了两个综合治疗组的结果。因为药物治疗开始日期不详,所以在估计潜伏期时,我们将入组日期作为药物治疗开始日期。98%的131I治疗的患者和78%的手术治疗的患者第一次治疗是在入组2年内,只有231例在131I治疗前先行手术。由于入组1年内死亡者不太可能为治疗甲亢所致,因此我们将这些死亡病例从所有与治疗有关的分析中去除。在用全美死亡率进行总死亡率分析时,未去除已患癌症的病例,因为他们也包括在全国死亡率中。
每例患者,131I进入17个器官的剂量可用131I放射剂量乘每个器官的剂量因子获得。后者是由国际放射保护委员会的表格提供的21,包括年龄(1、5、10、15和>15岁)和24小时甲状腺的摄取率(0%、25%、35%、45%和55%)。年龄等于或小于15岁的患者不足500例。大多数患者(70%)至少有一个24小时甲状腺摄碘量大于55%。因为许多医院均采用标准放射活性剂量,所以治疗前未测量甲状腺摄取量。我们应用3 162例治疗前1个月内测定摄取量的经验,根据性别、治疗时年龄、治疗次数、治疗年份、医院、甲亢类型及131I剂量,估计其摄取量。因为必须知道腺体大小、剂量分布和有效半衰期,所以我们没有测定进入甲状腺的量。然而,在治疗时通常至少50~70Gy到达甲状腺22。其他脏器仅有3个131I平均摄取量大于100mGy:胃(178mGy),膀胱(128mGy)和小肠(108mGy)。红骨髓平均为42mGy,乳腺为32mGy。应用不同估计方式,Saenger等5报道平均骨髓摄131I量为80~160mGy。他们的估计为我们的2~4倍,这可能与当时所获资料来自文献有关23,24。他们假设血浓度为给药浓度的1.7倍,骨髓摄碘量为血浓度的46~86%。最近Zanzonico等25重新测定了468例患者的摄131I量,其结果与我们相同:原发甲亢患者膀胱、红骨髓和乳腺的平均摄取量分别为190mGy、50mGy和30mGy。为保证摄取量不显著影响分析,我们假设所有未知摄取为25%~55%(采用国际放射保护委员会表格的上、下限)。按55%摄取量估计摄131I,与摄取量估计相同。按25%摄取估计,摄131I量虽然较低,但甲亢患者摄取量很少低于50%。
, 百拇医药
由于对甲状腺以及造血和淋巴增生性恶性疾病的特殊兴趣,为了评估死于造血和淋巴增生性恶性疾病与131I给药剂量和骨髓吸收量的关系,我们用Poisson回归法对组间队列时间/照射量数据进行了分析。分析甲状腺死亡率时,因为不能估计器官内剂量,所以我们仅测定了131I给药剂量。由于这些分析无外对照,我们采用了英国的病例,但将入组前已诊断癌症的病例剔除。对这些数据进行交叉分类。按照性别、治疗时年龄(0~29,30~39,40~49,50~59,≥60岁)、治疗后时间(0~4,5~9,10~19和≥20年)、甲亢类型(原发甲亢、毒性结节性甲状腺肿)、131I摄入量(0,0.01~4,5~6,7~9,10~14,15~19和≥20mCi)及为分析造血和淋巴增生性恶性疾病的红骨髓估计量(0,0.1~14,15~19,20~24,25~29,30~39,40~49,50~79和≥80mGy)建立一线性额外相对危险的剂量/反应模型(外暴露人群的基本疾病率×[1+额外相对危险]),并将所描述的相关变量一并考虑。用性别、治疗时年龄、治疗后时间和甲亢类型对基本率进行分组。得出最大参数指标。用似然比检验估计剂量反应显著性26。应用131I辐射作为连续变量进行趋势检验。这些分析均用EPICURE软件(HiroSoft国际公司、西雅图市、华盛顿州)进行27。
, 百拇医药
结 果
随访结束时,对35 593例研究对象(79%女性)共进行了738 831人-年的随访。入组时平均年龄为46岁,3%小于20岁。10 760例患
表2 治疗组与人群特点 治疗方法
女性
例数(%)
男性
例数(%)
合计
例数(%)*
年龄
平均,岁
, 百拇医药
随访
平均,年
131 I
18 020(63.8)
5 000(68.1)
23 020(64.7)
49.0
18.9
单纯131I
7 029(24.9)
1 999(27.2)
, 百拇医药 9 028(25.4)
49.9
18.0
131 I+药疗
7 999(28.3)
2 440(33.2)
10 439(29.3)
49.5
18.5
131 I+手术
757(2.7)
135(1.8)
, http://www.100md.com
892(2.5)
48.3
19.7
131 I+药疗+手术
2 235(7.9)
426(5.8)
2 661(7.5)
44.5
23.1
手术(无131 I)
9 119(32.3)
, http://www.100md.com 2 080(28.3)
11 199(31.5)
41.6
26.2
单纯手术
654(2.3)
164(2.2)
818(2.3)
50.8
22.7
手术+药疗
8 465(30.0)
, 百拇医药
1 916(26.1)
10 381(29.2)
40.8
26.5
单纯药疗
1 094(3.9)
260(26.1)
1 374(3.8)
44.9
17.8
合计
28 248(100.0)
, 百拇医药
7 345(100.0)
35 593(100.0)
46.5
21.2
* 入组时平均年龄
有15例女性和5例男性疗法不详或采用其他疗法者(30.2%)目前仍存活,17 959例(50.5%)已死亡,6 874例(19.3%)失访。88%的患者随访已5~10年,随访10年以上者占76%。平均随访21年(范围1~44年)。总随访率较好的为男性患者(83%,女性79%)、老年患者(入组时≥50岁86%,<50岁77%)和手术治疗的患者(手术88%,131I 78%,药物治疗75%)。治疗组间的差别为手术病例(4 010例)因技术原因不能随访者所占较少(13%)所致。进行随访者(31 620例),各种疗法间随访率无区别(手术92%,131I 92%,药物治疗90%)。约近65%的研究对象应用了131I;25%单用131I,39%为手术和/或药物治疗加131I(表2)。每次治疗平均131I给药剂量为6.1mCi(SD,5.2)。患者平均接受1.8次131I治疗,累积平均总量为10.4mCi(第5~第95百分位数为3.27mCi)。毒性结节性甲状腺肿患者的平均治疗数和累积给药剂量(2.1次,170mCi)比原发甲亢(1.7次,10.0mCi)高。20 639例患者首次查体记录的平均甲状腺摄碘率为62.4%,略大于手术治疗患者的40%,几乎所有患者均联合应用抗甲状腺药物。仅4%的患者单独使用药物治疗。女性较男性年轻,手术治疗率亦略高。原发甲亢患者,与手术(30.7%)或抗甲状腺药物(3.8%)相比,更倾向于应用131I治疗(65%)。与此相反,毒性结节性甲状腺肿则有43.2%的患者应用131I治疗,54.5%手术治疗,2.3%药物治疗。
, 百拇医药
表3 美国甲亢患者的实际和预期癌症死亡率*
全部恶性疾病
479/366.40
13.31(1.19-1.43)
402/389.84
1.03
2 069/2 101.39
0.98
2 950/2 857.64
1.03
, http://www.100md.com
全部实体癌症
443/338.59
1.31(1.19-1.44)
358/358.15
1.00
1 893/1 913.39
0.99
2 694/2 610.13
1.03
鼻窦
9/6.26
1.44
, 百拇医药
6/6.85
0.88
36/34.50
1.04
51/47.60
1.07
消化道
143/121.32
1.18
118/126.04
0.94
610/612.52
, 百拇医药
1.00
871/859.88
1.01
食道
1/4.84
0.21
6/5.40
1.11
30/30.33
0.99
37/40.57
0.91
胃
, 百拇医药
35/26.31
1.33
24/24.24
0.99
82/83.16
0.99
141/133.72
1.05
结直肠
66/55.73
1.18
73/59.90
, 百拇医药
1.22
313/312.46
1.00
452/428.09
1.06
肝
10/14.85
0.67
5/13.84
0.36(0.12-0.84)
45/48.91
0.92
, 百拇医药
60/77.59
0.77(0.59-1.00)
胰
25/16.64
1.50
8/19.50
0.41(0.18-0.81)
128/116.99
1.09
161/153.13
1.05
喉
, 百拇医药
2/2.08
0.96
1/2.27
0.44
5/11.65
0.43
8/16.00
0.50(0.22-0.99)
肺
54/33.84
1.60(1.20-2.08)
55/42.87
, 百拇医药
1.28
391/374.83
1.04
500/451.53
1.11(1.01-1.21)
乳腺
80/55.44
1.44(1.14-1.80)
68/58.01
1.17
312/279.94
1.11
, http://www.100md.com
460/393.37
1.17(1.06-1.28)
子宫
34/38.48
0.088
19/34.04
0.56(0.34-0.87)
64/101.71
0.63(0.48-0.80)
117/174.23
0.67(0.56-0.80)
, 百拇医药
卵巢§
22/19.08
1.15
26/19.99
1.30
104/98.09
1.06
152/137.16
1.11
前列腺
9/7.31
1.23
8/8.95
, http://www.100md.com
0.89
43/65.90
0.65(0.47-0.88)
60/82.16
0.73(0.56-0.94)
膀胱
10/7.96
1.26
5/8.78
0.57
49/47.05
1.04
, http://www.100md.com
64/63.79
1.00
肾
17/5.94
2.86(1.67-4.58)
7/6.57
1.07
42/37.77
1.11
66/50.28
1.31(1.02-1.67)
脑,神经系统
, 百拇医药
5/7.24
0.69
9/7.48
1.20
41/37.57
1.09
55/52.29
1.05
甲状腺
13/1.74
7.47(3.97-12.78)
2/1.76
, 百拇医药
1.14
14/6.97
2.01(1.10-3.37)
29/10.47
2.77(1.85-3.98)
全部造血和
36/27.81
0.77
44/31.69
1.39(1.01-1.86)
176/188.00
0.94
, http://www.100md.com
256/247.50
1.03
淋巴增生
淋巴瘤
16/13.39
1.24
13/14.46
0.90
69/75.28
0.92
98/103.13
0.95
, 百拇医药 白血病
15/12.55
1.19
22/13.59
1.62(1.01-2.45)
81/73.16
1.11
118/99.29
1.19
* 数据不包括英国病例 入组到癌症死亡人-年随访数:0-4年,158 654;5-9年,137 290;10或10年以上,420 715;总人-年随访数,716 659
入组到癌症死亡人-年随访数:0-4年,158 654;5-9年,137 290;10或10年以上,420 715;总人-年随访数,716 659 SMR:标准化死亡率;CL:可信限:标准化死亡率可信限显著性为0.05
SMR:标准化死亡率;CL:可信限:标准化死亡率可信限显著性为0.05
, http://www.100md.com
§ 包括其他和未特别指明的女性生殖系癌症
入组时,1 082例(1 338种)患者有既往肿瘤病史。研究期间,23%的病例死于恶性肿瘤,如除外有甲状腺癌病史的患者(通常手术治疗),单纯药物治疗者以往患癌率最高(达39.3‰),131I治疗居中(14.2‰),手术治疗者最低(5.5‰)。
表4 美国不同类型甲亢患者的癌症死亡率
全部
2 617/2 574.70
1.02
298/257.19
, 百拇医药 1.16(1.03-1.30)
鼻窦
48/43.36
1.11
2/3.86
0.52
消化道
777/759.06
1.02
81/92.01
0.88
食道
31/37.10
, http://www.100md.com
0.84
6/3.17
1.89
胃
117/116.26
1.01
19/15.97
1.19
结直肠
411/377.40
1.09
34/46.25
0.74
, http://www.100md.com
肝
51/67.39
0.76(0.56-1.00)
8/9.29
0.86
胰
149/137.03
1.09
12/14.69
0.82
喉
6/14.84
, http://www.100md.com 0.40(0.15-0.88)
2/1.06
1.88
肺
453/422.09
1.07
43/26.60
1.62(1.17-2.18)
乳腺
405/355.22
1.14(1.03-1.26)
48/34.48
, http://www.100md.com
1.39(1.03-1.85)
子宫
98/154.76
0.63(0.51-0.77)
19/17.65
1.08
卵巢§
139/123.85
1.12
12/12.03
1.00
前列腺
, 百拇医药
51/74.77
0.68(0.51-0.90)
9/6.74
1.34
膀胱
59/56.01
1.05
5/7.12
0.70
肾
61/45.46
1.34(1.03-1.72)
, 百拇医药
3/4.38
0.68
脑
49/48.80
1.00
6/3.13
1.92
甲状腺
19/9.12
2.08(1.25-3.25)
8/1.23
6.53(2.80-12.82)
, 百拇医药
CLL
26/22.84
1.14
5/3.02
1.66
Non-CLL
80/65.95
1.21
6/6.72
0.89
淋巴瘤
86/93.28
0.92
, 百拇医药
10/8.96
1.12
骨髓瘤
25/38.53
0.65(0.42-0.96)
5/3.47
1.44
* 数据不包括英国病例。SMR:标准化死亡率比;CI:可信区间;CLL:慢性淋巴细胞性白血病和未特别指明的淋巴细胞性白血病(国际疾病分类,修订版,编码204.1、204.9);Non-CLL:急性淋巴细胞性白血病,髓样和单核细胞性白血病,以及其他和非特别指明的白血病(国际疾病分类,修订版,编码204.0,205,206,207) 329例病人疾病类型不详者未包括在此分析中。原发甲亢人-年随访数;669 231;毒性结节性甲状腺,42 465
329例病人疾病类型不详者未包括在此分析中。原发甲亢人-年随访数;669 231;毒性结节性甲状腺,42 465 标准化死亡率比可信限显著性为0.05
标准化死亡率比可信限显著性为0.05
, 百拇医药
§ 包括其他和未特别指明的女性生殖系癌症所有治疗
所有病例:在33 748例已知出生日期、入组日期和性别的美国患者中,共有16 683例已死亡(49.4%)。除111例外,均已知死亡原因。2 950例主要死因为癌症,预期癌症死亡数为2 857.6例(表3)(SMR 1.03)。虽然癌症死亡的危险因随访年数而异,但是仅在头4年显著增加(SMR 1.31;95%CI 1.19~1.43),特别是第一年(SMR 1.52;95%CI 1.25~1.84)。研究期间死于肺癌(SMR 1.11)、乳腺癌(SMR 1.17)、肾癌(SMR 1.31)和甲状腺癌(2.77)者明显高于美国平均人口。所有4种癌的SMR均于入组5年内最高,仅甲状腺癌的死亡率在入组10年后仍显著增高(SMR 2.01;95%CI 1.10~3.37)。肝、喉、子宫和前列腺癌的死亡率显著低于预期值。研究期间,淋巴瘤、白血病及造血和淋巴增生性恶性疾病(作为一组)的死亡率无明显增加。但入组后5~9年白血病的死亡率增加(SMR 1.62;95%CI 1.01~2.45)。
, http://www.100md.com
由于79%的患者为女性,女性死亡率在总评估中占支配地位。女性患者预期癌症死亡数为2 101.8,实际死于癌症者2 252(SMR 1.07;95%CI 1.03~1.12),肺癌(SMR 1.28;95%CI 1.14~1.44)、乳腺癌(SMR 1.17;95%CI 1.07~1.28)、肾癌(SMR 1.37;95%CI 1.00~1.83)和甲状腺癌(SMR 2.66;95%CI 1.70~3.95)的实际死亡率均有增高。子宫癌(体和颈)的死亡率则较预期为低(SMR 0.67;95%CI 0.55~0.80)。在入组5年以后,仅肺癌和甲状腺癌的死亡率仍保持较高,而子宫癌的死亡率仍低于预期值。对于男性,总的癌症死亡危险低于预期值(SMR 0.92;95%CI 0.86~0.99)。甲状腺癌有5例死亡,其死亡危险增高(SMR 3.51;95%CI 1.13~8.18)主要为头4年死亡率危险增加了14倍所致(95% CI 2.35~33.72)。喉癌(SMR 0.29;95% CI 0.006~0.83)和前列腺癌(SMR 0.73;95% CI 0.56~0.94)均较预期值低。
, http://www.100md.com
原发性甲亢和毒性结节性甲状腺肿患者:总癌症死亡率增加与原发甲亢无关(SMR 1.02;95% CI 0.98~1.06),但毒性结节性甲状腺肿患者则比预期高16%(SMR 1.16;95% CI 1.03~1.30)(表4)。原发甲亢患者乳腺癌、肾癌和甲状腺癌的死亡率增加,但危险增加仅限于随访头4年,死于肝癌、喉癌、子宫癌、前列腺癌和多发骨髓瘤者均较预期值为低。毒性结节性甲状腺肿患者肺癌、乳腺癌、甲状腺癌和实际死亡率增加,并见于入组5年以上。(肺癌SMR 1.46[95%CI 1.01~2.06];乳腺癌SMR 1.45[95%CI 1.03~1.98];甲状腺癌SMR 4.3;[95%CI 1.16~11.01])。
131I治疗
评估癌症死亡率与治疗方法的关系不包括随访第一年(表5)。我们对几乎21 000例患者进行了高达385 000人-年的随访,结果显示131I治疗后总的癌症危险与预期全国癌症死亡率接近(SMR 1.02;95%CI 0.98~1.07)。甲状腺癌的死亡率有所增加(SMR 3.94;95%CI 2.52~5.86),但前列腺癌和子宫癌的死亡率低于预期值。8 054例单纯131I治疗者的分析结果与之相同。为了证实甲状腺癌死亡率增加与4例入组前甲状腺癌无关,我们将其剔除后进行分析,结果SMR仍然增高(SMR 3.28)。
, 百拇医药
在随访1~5年时,所有癌症标准化死亡率(表6)(SMR 1.24;95%CI 1.10~1.40)以及结直肠癌的死亡率均有显著增高(SMR 1.42;95%CI 1.04~1.90)。在头9年,肺癌(SMR 1.44;95%CI 1.13~1.81)和非慢性淋巴细胞性白血病(non-CLL)的死亡率增高(SMR 1.88;95%CI 1.18~2.84)。随访10年后,仅甲状腺癌的死亡率仍显著增高。但在365例小于20岁的用131I治疗的患者中,无论实际值或预期值均无死亡。
表5 美国不同治疗组甲亢患者的癌症死亡率*
全部
1742
1.02
, 百拇医药
659
1.04
1005
0.99
95
1.31(1.06-1.60)
鼻窦
32
1.12
12
1.12
13
0.79
, 百拇医药
5
4.16(1.34-9.72)
消化道
537
1.05
207
1.09
286
0.95
26
1.19
食道
25
, http://www.100md.com
1.00
11
1.15
10
0.74
1
0.99
胃
82
1.05
28
0.97
42
, 百拇医药 0.90
7
1.95
结直肠
282
1.11
108
1.15
154
1.02
12
1.12
肝
, 百拇医药 39
0.87
16
0.97
19
0.69
2
0.97
胰
99
1.07
38
1.10
56
, 百拇医药
1.05
3
0.79
喉
4
0.41
2
0.54
3
0.56
0
0
肺
295
, 百拇医药
1.06
96
0.91
182
1.17(1.01-1.35)
10
0.94
乳腺
248
1.10
90
1.08
172
, 百拇医药
1.17(1.00-1.36)
18
1.69
子宫
68
0.69(0.54-0.88)
22
0.61(0.38-0.93)
36
0.57(0.40-0.79)
4
0.83
, 百拇医药
卵巢§
86
1.09
31
1.07
54
1.06
5
1.37
前列腺
36
0.67(0.47-0.93)
10
, 百拇医药
0.50(0.24-0.91)
21
0.82
2
1.09
膀胱
42
1.08
14
0.97
17
0.78
2
, http://www.100md.com
1.30
肾
37
1.23
16
1.43
21
1.19
2
1.61
脑
30
0.98
, 百拇医药 18
1.60
20
1.05
5
3.71(1.19-8.64)
甲状腺
24
3.94(2.52-5.86)
11
4.91(2.45-8.79)
4
1.07
, http://www.100md.com
0
0
CLL
19
1.23
6
1.05
12
1.30
0
0
Non-CLL
53
, http://www.100md.com 1.22
18
1.12
30
1.14
1
0.54
淋巴瘤
52
0.85
26
1.16
39
, 百拇医药 1.06
4
1.53
骨髓瘤
21
0.81
10
1.02
7
0.48(0.40-0.79)
2
1.95
* 数据不包括英国病例。SMR:标准化死亡率;CI:可信区间;CLL:慢性淋巴细胞性白血病和未特别指明的淋巴细胞性白血病(国际疾病分类,修订版,编码204.1,204.9);Non-CLL:急性淋巴细胞性白血病,所有骨髓样和单核细胞性白血病以及其他和未特别指明的白血病(国际疾病分类,修订版,编码204.0,205,206,207)
, 百拇医药
 任何131I治疗的人年随访数为3 8546.8;单纯131I治疗,141 543;手术或手术+药疗,275 963;单纯药疗,21 415
任何131I治疗的人年随访数为3 8546.8;单纯131I治疗,141 543;手术或手术+药疗,275 963;单纯药疗,21 415 标准化死亡率可信限显著性为0.05
标准化死亡率可信限显著性为0.05
§ 包括其他和未特别指明的女性生殖系癌症表6 美国用131I治疗之甲亢患者的癌症死亡率*
全部
258
1.24(1.10-1.40)
, http://www.100md.com
278
1.05
1206
0.98
鼻窦
6
1.65
2
0.42
24
1.19
消化道
83
, http://www.100md.com
1.21
83
0.97
371
1.04
食道
0
0
5
1.31
20
1.09
胃
, 百拇医药 14
0.98
17
1.07
51
1.06
结直肠
45
1.42(1.04-1.90)
49
1.20
188
1.03
, http://www.100md.com
肝
6
0.74
4
0.45
29
1.04
胰
16
1.62
6
0.44(0.16-0.96)
77
, 百拇医药
1.11
喉
1
0.82
0
0
3
0.43
肺
31
1.49(1.01-2.12)
44
1.41(1.02-1.89)
, 百拇医药
220
0.97
乳腺
39
1.26
36
0.93
173
1.11
子宫
18
0.89
16
, http://www.100md.com
0.74
34
0.61(0.42-0.85)
卵巢§
8
0.75
18
1.35
60
1.09
前列腺
5
1.14
, http://www.100md.com
5
0.78
26
0.61(0.40-0.89)
膀胱
6
1.30
2
0.33
34
1.21
肾
6
, http://www.100md.com
1.75
4
0.88
27
1.22
脑
3
0.75
6
1.20
21
0.98
甲状腺
, http://www.100md.com 12
12.32(6.38-21.61)
1
0.86
11
2.78(1.38-4.97)
CLL
2
0.93
5
1.96
12
1.12
, http://www.100md.com
Non-CLL
8
1.61
14
2.10(1.14-3.52)
31
0.98
淋巴瘤
5
0.62
10
1.02
37
, 百拇医药
0.85
骨髓瘤
3
1.35
4
1.23
14
0.68
* 数据不包括英国病例。SMR:标准化死亡率比;CI:可信限;CLL:慢性淋巴细胞性白血病和未特别指明的淋巴细胞性白血病(国际疾病分类,修订版,编码204.1,204.9);Non-CLL:包括急性淋巴细胞性白血病、所有髓性和单核细胞性白血病和其他未特别指明的白血病(国际疾病分类,修订版,编码204.0,205,206,207)
, 百拇医药
 入组到癌症死亡人-年数:1-4年,78 372;5-9年,83 190;10或10年以上,22 3906
入组到癌症死亡人-年数:1-4年,78 372;5-9年,83 190;10或10年以上,22 3906 SMRs可信区间显著性水平为0.05
SMRs可信区间显著性水平为0.05
§ 包括其他和未特别指明的女性生殖系癌症
采用131I治疗原发性甲亢的患者(表7),甲状腺癌的死亡率增加(SMR 2.84;95%CI 1.62~4.61),但随访5年或5年以后无显著增高(SMR 1.88;95%CI 0.86~3.57)。采用131I治疗的毒性结节性甲状腺肿患者,总癌死亡率(SMR 1.31;95%CI 1.07~1.58)以及食管癌、子宫癌(特别是宫体)和甲状腺癌的死亡率增加(表7)。入组5年以上的毒性结节性甲状腺肿患者,食管癌(SMR 5.26;CI 1.42~13.5)、子宫体癌(SMR 3.0;CI 1.09~6.53)和甲状腺癌(SMR 11.1;CI 2.26~32.5),的死亡率仍然增高。131I治疗次数与总癌症死亡率(治疗1,2~4和≥5次者,SMR分别为1.00、1.09和0.99)和癌肿部位有明显关系(结果未显示),但甲状腺癌除外。严格分析随访5年、10年或更长结果并未改变这个结论。在研究期间,甲状腺癌的标准化死亡率比随治疗次数增加而增高(1,2~4和≥5次的SMR分别为2.74、6.21和6.61)。入组10年后的结果大体相同(1,2~4和≥5次SMR分别为2.66、4.48和5.43)。
, http://www.100md.com
表7提供了有关131I剂量与总癌症死亡率以及给药剂量与肺癌、甲状腺癌死亡率关系的证据。然而,入组10或10年以上者与给药的关系便不明显了。剂量<7 mCi、7~15 mCi和≥15 mCi时,所有癌症的SMR分别为0.90、1.03和1.06;肺癌为0.83、1.03和1.21;甲状腺癌为1.85、4.11和1.59。对不同甲亢类型进行分析提示,原发性甲亢患者甲状腺癌的死亡率随给药剂量的增加而增高。在毒性结节性甲状腺肿患者,癌症死亡率与给药量无关,癌症数较小,可信区间较宽。
我们还对放射剂量与甲状腺癌死亡率的关系进行了Poission回归分析。该分析考虑了甲亢的类型,但去除了采用手术治疗的患者(因为甲状腺癌的危险随组织容积的减少而降低)和入组前已患癌症的患者,共剩余16例甲状腺癌死亡(表8)。结果显示最高给药剂量组的相对危险为2.3(95%CI 0.97~9.5),但辐射-反应趋势无统计学差异(P=0.12)。同样,高相对危险点是阳性的(在1 mCi的高相对危险=0.12),但不显著。在入组5年或5年以后,给药剂量与甲状腺癌死亡率无关。
, 百拇医药
131 I剂量或骨髓估计量与慢性淋巴性白血病、非慢性淋巴性白血病、何杰金氏病、非何杰金氏淋巴瘤或多发骨髓瘤无关(表9)。由于放射线诱导非慢性淋巴性白血病的潜伏期较短,我们还分析了随访头10年的非慢性淋巴性白血病的资料,但结果仍与骨髓估计量无关(P=0.46),对于多发骨髓瘤,虽然二个最高剂量和骨髓估计量组相对危险增加,但是因为例数较少,剂量-反应趋势亦不显著。
表7 美国不同类型及不同131I治疗剂量甲亢患者的癌症死亡率*
全部
1615
1.01
104
, 百拇医药
1.31(1.07-1.58)
637
0.94
763
1.04
342
1.18(1.06-1.31)
鼻窦
30
1.10
1
0.85
14
, 百拇医药
1.23
15
1.21
3
0.61
消化道
501
1.05
30
1.07
211
1.07
216
, 百拇医药
0.98
110
1.18
食道
21
0.88
4
4.06(1.10-10.45)
9
0.91
9
0.83
7
, 百拇医药
1.62
结直肠
265
1.12
13
0.92
114
1.15
114
1.04
54
1.18
肝
, 百拇医药
36
0.87
2
0.73
16
0.95
14
0.72
9
1.05
胰
95
1.09
, 百拇医药 4
0.87
40
1.09
37
0.93
22
1.37
喉
4
0.42
0
0
0
, 百拇医药
0
4
0.93
0
0
肺
281
1.05
11
1.29
108
0.94
129
, http://www.100md.com 1.08
58
1.33(1.01-1.72)
乳腺
229
1.08
13
1.20
85
0.92
120
1.25(1.04-1.49)
43
, http://www.100md.com
1.18
子宫
57
0.62(0.47-0.81)
11
2.05(1.02-3.67)
14
0.36(0.20-0.61)
31
0.73
23
1.34
, 百拇医药 卵巢‖
81
1.09
4
1.06
32
0.98
39
1.16
15
1.19
前列腺
34
, http://www.100md.com 0.67(0.46-0.93)
2
1.00
14
0.69
14
0.60
8
0.81
膀胱
41
1.14
1
, 百拇医药
0.46
15
1.02
16
0.95
11
1.51
肾
35
1.23
1
0.74
16
, http://www.100md.com 1.33
19
1.46
2
0.39
脑
27
0.92
3
3.05
13
1.01
12
0.92
, 百拇医药
5
1.09
甲状腺
16
2.84(1.62-4.61)
7
18.88(7.58-38.98)
7
3.01(1.20-6.19)
9
3.42(1.56-6.50)
8
, http://www.100md.com
7.05(3.05-13.95)
CLL
19
1.33
0
0
8
1.36
8
1.20
3
1.04
Non-CLL
, http://www.100md.com
50
1.22
2
0.96
25
1.44
18
0.96
10
1.35
淋巴瘤
49
0.85
, 百拇医药
2
0.72
17
0.69
24
0.92
11
1.08
骨髓瘤
18
0.73
2
1.76
, 百拇医药
6
0.57
11
0.99
4
0.94
* 数据不包括英国病例。SMR:标准化死亡率比:CI:可信区间;CLL:慢性淋巴细胞性白血病和未特别指明的淋巴细胞性白血病(国际疾病分类,修订版,编码204.1,204.9);
Non-CLL:包括急性淋巴细胞性白血病、所有髓性和单核细胞性白血病,以及其他未特别指明的白血病(国际疾病分类,修订版,编码204.0,205,206,207) 原发甲亢人-年随访数,368 934;毒性结节性甲状腺,13 088:给药活性小于7年,160 563:7-14年,165 666:15或15年以上99 239
原发甲亢人-年随访数,368 934;毒性结节性甲状腺,13 088:给药活性小于7年,160 563:7-14年,165 666:15或15年以上99 239 疾病类型不详,523例
疾病类型不详,523例
, http://www.100md.com
§ SMRs可信区间显著性水平为0.05
‖包括其他和未特别指明的女性生殖系癌症表8 131I剂量与甲亢患者甲状腺癌死亡率* 放射剂量mCi
<7
146 494
4
1.00
112 832
3
1.00
7-14
, http://www.100md.com
145 700
6
1.24
109 679
6
1.67
≥15
52 786
6
2.28
38 162
1
0.57
, 百拇医药
趋势P值
0.12
>0.5
额外RR在1 mCi
0.12
0.009
* 数据包括美国和英国18 633例未行甲状腺部分或全切术和入组前未患癌症病例。PRY:人-年随访;RR:相对危险 参考值手术治疗
参考值手术治疗
10 876例未接受131I的手术患者,其总癌症死亡率的SMR为0.99(表5)。去除随访第一年的资料,手术患者肺癌、乳腺癌的死亡率显著增加,甲状腺癌的死亡率则无增加(SMR 1.07),多发性骨髓瘤的实际死亡率比预期低50%(SMR 0.48;95%CI 0.19~0.99)
, 百拇医药
抗甲状腺药物治疗
应用抗甲状腺药物治疗的患者,入组1年或1年以后,所有癌症的死亡数显著增加(包括鼻窦癌和脑癌)(表5)。由于用抗甲状腺药治疗的患者入组前癌症的诊断率很高,因此我们在分析标准化死亡率时,将入组前已诊断癌的病例去除。结果显示仅脑癌的死亡率仍有增加。去除入组前诊断癌症的病例,将低估SMR。
评 论
我们评估了甲亢三种方法治疗后的癌症死亡率。因为在美国131I是治疗甲亢的主要选择且其致癌作用不详,所以我们着重评估131I。甲状腺随访研究在第一次评估时报道,与其他方法相比,131I治疗并不增加白血病和甲状腺癌的发生率5,6,10,16。与此相反,Williams28的分析则显示,131I治疗组未分化型甲状腺癌轻度增加,他们认为这可能为放射线使原来未检测出的分化较好的癌转变为未分化癌所致。对原始队列中2个女性亚组进行额外随访提示,浓集131I的11,13的器官发生癌症的危险或乳腺癌的发生率轻度增加14。
, http://www.100md.com
表9 131I剂量与造血系恶性疾病的死亡率 给药剂量
PYR
131 Ⅰ放射剂量mCi
0
321 698
12
1.00
31
1.00
6
, http://www.100md.com 1.00
31
1.00
8
1.00
>0-6
177 360
5
0.61
25
1.19
3
0.77
, http://www.100md.com
15
0.66
4
0.81
7-14
176 279
4
0.44
17
0.76
1
0.17
20
, 百拇医药
0.89
12
2.23
≥15
63 494
3
0.83
10
1.12
2
1.36
8
0.95
, 百拇医药
4
1.73
P值
>0.5
>0.5
>0.5
>0.5
0.3
额外RR在1 mCi
-0.008
0.001
-0.008
-0.003
, http://www.100md.com
0.038
骨髓量,cGy
0
313 021
12
1.00
31
1.00
6
1.00
31
1.00
8
, http://www.100md.com
1.00
>0-4.9
331 955
8
0.50
38
0.92
4
0.56
34
0.80
16
1.69
, 百拇医药
≥5
90 279
3
0.63
13
1.11
2
1.00
9
0.79
4
1.36
P值
, 百拇医药 >0.5
>0.5
>0.5
>0.5
0.3
额外 RR在1cGY
-0.01
-0.01
-0.01
0.006
0.11
*CLL:慢性淋巴细胞性白血病:Non-CLL:非慢性淋巴细胞性白血病;PYR:人-年随访;RR:相对危险 数据包括英国病例,但不包括入组前已诊断癌症的患者
数据包括英国病例,但不包括入组前已诊断癌症的患者
, 百拇医药
本次随访将其与美国相应年龄、性别、年限死亡率进行了比较,结果显示131I没有造成更多的癌症死亡。131I浓集器官(唾液腺、食道、胃、结肠、直肠、肝、膀胱和肾,作为一个整体)的癌症死亡率亦无增加(SMR 1.03)。仔细分析显示,造血系统恶性疾病与131I剂量或者骨髓估计量与非慢性淋巴性白血病亦无关联。分析未获得阳性结果并不意外,因为除甲状腺外,其他器官的平均接受量均小于200 mGy。在这样低的剂量下,检测其作用在统计学上是有局限性的。本研究检测的几乎均为成人,因此其结果不能用于儿童。
死亡率研究并不十分适合甲状腺癌研究。然而,不管怎样,我们确实观察到男女毒性结节性甲状腺肿患者和原发甲亢患者甲状腺癌的死亡率增加。而且甲状腺癌死亡危险增高仅见于131I治疗的患者。不论是用外对照(SMR分析)还是内对照(Poisson分析),其危险度均随131I剂量的增加而增加。入组10年后或用内对照分析时,趋势不再有显著性。
, 百拇医药
在解释这些结果时有几点应予注意。在甲亢患者给药剂量与甲状腺放射量的相互关系通常较差22。一般患者所用放射剂量越大,疾病越重,其复发率亦越高;毒性结节性甲状腺肿患者死于甲状腺癌的危险较原发甲亢患者高(30%/8%);死亡率增加主要在治疗后头5年;甲状腺肿,尤其是结节性甲状腺肿,是甲状腺癌的危险因素之一29-31;有些毒性甲状腺肿患者入组前可能已有未被诊断的甲状腺癌。
假设实际甲状腺癌增加是有原因的,其危险度应较外照后小。某些差异可用131I治疗诱发细胞消亡解释。尽管不能直接估算甲状腺剂量,但是131I治疗的目的是破坏甲状腺32。131I杀死甲状腺细胞的作用有可能减少细胞恶变率。另一种解释与受辐射时的年龄有关。因为,外照射后发生甲状腺癌的危险随着年龄的增大而减小,20岁以后几乎没有危险。本文资料来自成人,因此不能据此对131I和外照射进行比较。到目前为止,几乎所有人类131I资料均来自成人15,33-37,而甲状腺外照射数据则大多来自儿童38,39。最后,本文部分患者于131I治疗后施行了甲状腺全切或次全切除术,切除放射损伤组织亦可能降低甲状腺癌的危险。
, http://www.100md.com
与我们的研究相比,瑞典死亡率研究的患者年龄稍大,随访期较短(4年),毒性结节性甲状腺肿所占比例较高,平均131I给药剂量较大。除甲状腺癌外,两项研究标准化总癌症死亡率之SMR均接近预期死亡率。其他癌症的SMR均在0.8和1.3之间。在瑞典研究,尽管消化道和呼吸道癌死亡危险增加达到显著性,但危险度仅比预期值增高10%和30%。我们亦发现131I治疗毒性结节性甲状腺肿时,呼吸道癌死亡危险增加。二项研究的差异可能为瑞典研究毒性结节性甲状腺肿比例较高或为偶然性所致。
本研究样本量大而且包括了非131I治疗的患者。与一般人群相比,本列随访期间乳腺癌、肺癌和肾癌的死亡率有所增加,比例虽小但有显著性。本文病例吸烟、生活习惯和生育史不详。这些因素均可混淆结果。由于死亡率增高大多发生在随访头几年,所以未发现的潜在疾病亦可能与之有关。本文采用抗甲状腺药物治疗的患者较少,然而尽管如此,仍有几个部位(总癌、鼻窦、胃、乳腺和脑)实际癌症死亡率高于全国预期死亡率。分析(排除了既往已有癌症的患者)表明在某种程度(不是全部),死亡率增加可能为药物治疗的病例选择所致。药物治疗主要应用硫脲衍生物、碘化物或两者的联合,但有时也使用其他药物。通常用药类型、剂量及用药日期病历并无记录,因此无法对其进行分析。因为本研究有关药物治疗的数据具有明显的局限性,所以对抗甲状腺药物的远期效果仍需进一步评估。
, 百拇医药
本研究虽有优势,但亦有局限性。第一,不能估计甲状腺剂量,放射反应以131I给药量为基础。第二,死亡率不是理想的研究终点。死亡证所列死亡原因常常欠准确,而且很少提及癌症的组织类型。除此之外,有关高存活率癌症(如甲状腺癌、乳腺癌)的资料亦有局限性。第三,仅对约20个部位癌症的潜伏期、甲亢类型、治疗组及131I给药剂量进行了评估。采用多元比较,不正确否决无效假设的概率增加,因此对这些数据的解释仍需谨慎。另一方面,许多亚组病例数及死亡率较小,除甲状腺外,大多数器官接受的放射量均较低,这些均限制了显著性检验的力度。最后,本文治疗方法的选择以患者的健康状况为依据。例如,手术病例比采用药物治疗或131I治疗者患癌(甲状腺癌除外)少,这样比较与治疗的危险度是有问题的。
总之,在随访甲亢患者几达一生的大系列研究中,癌症的死亡率并无明显增加。大剂量治疗性131I及高频度治疗均与总癌症死亡率无关。尽管少数甲状腺癌死亡可能与131I治疗有关,但是总体上看131I治疗是一种安全的疗法。
, 百拇医药
参考文献
1. FurszyferJ, Kuriand LT, McConahey WM, et al. 14. Goldman MB, Maloof F, Monson RR, et al. Rsi 26. Cox DR, Hinkley DV. Theoreticai Statistics.Epidemiologic aspects of Hashimoto's thyroiditis dioactive iodine therapy azid breast cancer. Am i London, Engiand: Chapman k Hall; 1974.and Graves' disease in Rochester, Minnesota, 1935- 1988;127:969-980. 27. Preston DL, LubinJH, Pierce DA. Epicure Us-1967. Metaboiisln. 1972;21:197-204. 15. Hall P,Berg G, Bjelkengren G, et al. Cancer er's Gi`ide. Seattle, Wash: HiroSoft international
, 百拇医药
2. Tunbridge WMG, Evered DD, Hall R, et al. The mortalityafteriodine-131 therapyforhyperthyroid- Corp; 1993.spectrum of thyroid disease in a community: the ism. Int J Cance r. 1992i50:886-890. 28. Williarns ED. Relaiionbetween 131therapyfor
Whickhaznsurvey. ClinEhocirinsi. 1977)7:481-493. 16. Becker DV, McConaheyWM, Dobyns BM, et al. thyrotoxicosis and development ofthyroid carcino-
3. Volp6 R. Graves' disease. In: Burrow GN, Op- The results of radioiodine treatment of hyl)erthy- ma. Lanset. 19862:456-457.penheimerJH, Volpe R, eds. ThgroidFunctionand roidism. In: Fellinger K, H0fer R, eds. Further 29. Hancock BW, Bing RF, DirmiAis SM, etal. Tliy-Insease. Philadelphia, Pa: WB Saunders Co; 1989: Advances in Thyroid Research. Wienna, Austria: roid carcinoma and concurrent hyperthyroidism.214260.
, 百拇医药
4. Klein i, Becker DV, Levey GS. Treatment ofhy 603-609. 30. Ron E, Kleinerman RA, BofceJD, et al. A popu-I)erthyroid disease. Ann Med. i994;121:281- 17. TompkinsE. Late effects ofradiofodinetherapy. lationbased case-control study of thyroid caiicer.288. In: Cloutier RJ, Edwards CL, Snyder WS, eds. J Nati Canser inst. 1987;79:1-12.
5. Saenger EL, Thoma GE, Tompkins EA. Inci- Medicai Radionuciides: Radiation Dose aui Ef 31. Franceschi S, Fassina A, Talamini R, et ai. Risk denceol\eukem\afo\\owtngtreatment fecte. WasKingion, DC: Atomic Energy Commis factorsforthFoidcancer in North ltaly. Int JEpi roidism. JAMA. 1968,205:855-862. sion; 1970:431-440. dsmioi. 1989;18:578-584.
, 百拇医药
6. Dobyns BM. Radiation hazardeexperience with 18. Mani,.ai of tho inte,`nationai Ctassification of 32. Maxon HR, Thomas SR, Saenger EL, et al. Ion therapeutic and diagnostic 131i. In: Ra imtion As inseases, Eighth Reinsion Adriptedfor Use in the izing irradintion and the induction of climcally sig-sociated Carcinoma. New York, NY: UnitedStates. Wasfrington, DC: USDeptofHealth, nificant disease in the human thgroid. Am J Med.Grune h Stratton; 1977:459-483. Education,andWelfare; 1967. PHSpublication 1693. 1977f63:967~969.
, 百拇医药
7. Halnan KE. Risks from redioiodine treatment of 19. Manuai ofthe inte,nationai Statisticai Ciassi- 33. G16bel B, G16bel H, Oberhausen E. Epidemio-thyrotoxicosis. BMJ. 1983;287:8121-8122Wzcati0n of Diseases, Seventh Remeion. Geneva
8. GraliamGD,Bui,nan gn. Radioiodinetreatment Switzeriand: Worid Health Organization; 1957. and therapy. In: ~~~~ A, Neider R, Pensko J, eds.of Graves' disease. Ann intet,i Med. 1986;105: 20. Monson RR. Anaiysis ofrelative survival and Radiation Risk Protection. Cologne, Ger'nany:9bo-905. proportional mortality. Comppt Biomed Res. 1974; Koun; 1989:565568.
, 百拇医药
9. Becker DV. Comparison of iodine-131 therapy 7:325332. 34. Holm LE, Wiklund KE, Lundell GE, et al. Thy-and alternative treatments ofhyperthgroidism. In: ZI.International Commission on Ra(liological Prry roid cancer after diagnostic doses of lodine-131.Nagatndi.S, ed. Radtation and tho Thg,oid. Tokyo, tection. Radiation dose to patients from radiophar- J Nati Cancer inst. 1988;80:11321138.Japan: Excerpta Medica Ltd; 1989:57-67. ryceuticals. Ann ICRP. 1988i18:275278. 35. Holm LE, Hall P, Wiklund K, et al. Cancer risk
, 百拇医药
10. Dobyns BM, Sheline GE, Workman JB, et al. 22. Becker DV, Hurley JR. Rndiofodine treatment afteriodine-131 therapyforhyperthyroidisrn`JNatl Maiiguant arid benign neoplasms of the thyroid in ofhypert,hyrofdism. In: SandlerMA,PattonJA,Cole- Cancer inst. 1991;83:1072-1077.patients treated for hyperthyroidism. J Clin Endo- inan RE, eds. Dzagtzostic Nusiear Medimns. 3ril ed. 36. HaJI P, Holm LE, Lundell G, et ai. Cancerrisks in c,`znst Metab. 1974f38:976-998. Baitimore, Md: Willianis k Wilkins; 1996:943-958. thyroidoocerpatients. BrJCanse r. 1991,4:159-163.
, http://www.100md.com
ll. Hoffman DA, McConahey WM, Diamond EL, 23. L0evinger R, Holt JG, Hine GJ. Internally ad- 37. Hail P, Mattsson AP, Boice JD. Thyroid cancer Kurland LT. Mortality in women treated for hypen ministered radioisotopos. In: Hine GJ, Brownwell after diagnostic administration of iodine-131. Ra-thyroidism. Am J Epz,iemioi. 1982;115:243253. GL,eds.RadiationDosimetry. Newyork, NY: Aca- diat Res. 1996i145:86~92.
12. Goldman MB, Monson RR, Maioof F. Cazicer demic Press Inc; 1956:870. 38. Shore RE. Issues and epidemiological evidence mortality in women with thyroid disease.24. Green M, Fisher M, Miller H, et al. Blood radia- regardingradiation-induced thyroid cancer. Radiat Res. 1990;50:2283-2289. tion dose after iail therapy ofthyrotoxicosis. BMJ. Res. 1992,131:98-111.
, http://www.100md.com
13. Hoffman DA, McConahey Th, Fraumeni JF, 1961il:210-215. 39. Ron E, LubinJH, Shore RE, et al. Thyroid can-Kuriand LT. Cazicer incidence following treatment 25. Zanzonico PB, BeckerDV, Brill AB, etal. Extra- cerfollowingexposure to externalradiation.Radmt of hyperthyroidism. Int J E;,idemioi. 1982;ll:218- ftyroidaiabsorbed dosesintalioiodinetreatment of Res. 1995i141:255-273.224. hyl)erthxroidism. J Nuci Med. 1989;30:833.
I4. Goldman MB, Maloof F, Monson RR, et al. Ra 3 dioactive iodine therapy and breast cazicer. Am J. Epidemiol. 1988i127:969-980.
, 百拇医药
15. Hall P, Berg G, Bjelkengren G, et al. Cancer 3 mortalityafteriodine-131 therapyforhyperthyroid- ism. Int i Cancer. 1992;50:886-890.
16. BeckerDV, McConahey WM, Dobyns BM, et ai.The results of radioiodine treatment of hyperthy-i roidism. In: Fellinger K, H0fer R, eds. Furtha: Advances in ~~~~~~~ Research. Vienna, Austria:Veriage derwiener Medizinischen Akademie, 1971:603-609.
17. Tompkins E. Lateeffectsofradioiodinetherapy.In: Cloutier Xi, Edwards CL, Snyder WS, eds.Medical Railionucizdes: Rndiation Dose and Ef . fects. Washington, DC: Atomic Energy Commis sion; 1970:431-440.
, http://www.100md.com
18. Mannai ofthe interuational Ctassifzcatzon of - Diseases, Eighth Revision Ad`iptedfor Use in the: UnitedStates. Washingion, DC: US DeptofHealth,Education, andWelfare; 1967. PHSpublication 1693.
19. Manual oft}ie inte),z(ztio?i,ai Statistical Classi-fication of Diseases, Seventh Revision. Geneva,5 Switzerland: W0rld Health Organization; 1957.
20. Monson RR. Analysis of relative survival and proportional mortality. Comppt Biomed Res. 1974,z 7:325-332.
, 百拇医药
21. International Commission on Radiological Pro-, tection. Radiation dose to patients from radiophar-maceuticals. Ann ICRP. 1988;18:275278.
22. Becker DV, Huriey JR. Radioiodine treatment i ofhypert,hyroiilism. In:SandlerMA,PattonJA,Cole-nian RE, eds. Diagnsstic Nusiear Mediri?i.e. 3rd ed.Baitimore, Md: Williams k Wilkins; 19be:943-958.
23. Loevinger R, Holt JG, Hine GJ. Internally ad-ministered radioisotopes. In: Hine GJ, Brownwell GL,eds.RadiationDosi?netry. Newyork, NY: Aea demic Press Inci 1956:870.
, http://www.100md.com
24. Green M, Fisher M, Miller H, et al. Blood radia-tion dose after isil therapy ofthyrotoxicosis. BMJ.1961il:210-215.
25. Zanzonico PB, Becker DV, BchlAB,etal. Extra. thyroidai absorbed doses in radioiodine treatment of hyperthyroidism. JNucl Med. 1989,30:833.ll
26. Cox DR, Hinkley DV. Theoretzcal Statistics.London, England: Chapman h Hall, 1974.
27. Preston DL, LubinJH, Pierce DA. Eghci `re Us-er's G uide. Seattle. Wash: HiroSoft international Corp; 1993.
, 百拇医药
28. Williams ED. Relationbetween 131-therapyfor thyrotoxicosis and development ofthyroid carcino-ma. Lanset. 19ed;2:456457.
29. HancockBW, Bing RF, Dirmikis SM, et ai. Thy roid carcinoma and concurrent hyperthyroidism.Cancer 1977,39:298-302.
30. Ron E, Kleinernian RA, BoiceJD, et al. A popu-lation-based case-control study of thyroid caz)cer.J Nati Cancer inst. 1987;79:1-12.
3I. Franceschi S, Fassina A, Talaniiin R, et al. Riskfactors for thyroid cancer in North ltaly. Int J Epi-delnioi. 1989;18:578-584.
, http://www.100md.com
32. Maxon HR, Thomas SR, Saenger EL, et al. Ion-izing irradintion and the induction of climcally sig-mficant disease in the human thyroid. Am J Med.
1977:63:967-969.
33. G16bel B, Globel H, Oberhausen E. Epidemio-logic studies on patients with iodine-131 diagnostic azid therapy. In: Kaul A, Neider R, Pensko J, eds.Radiatzon Risk Protectzon. Cologne, Germany:Koun; 1989:565568.
34. Holm LE, Wiklund KE, Lundell GE, et al. Thy-roid cancer after diagnostic doses of lodine-131.J Natl Cancer inst. 1988:80:11321138.
, http://www.100md.com
35. Holm LE, Hall P, Wiklund K, et al. Cancer risk ederiodine-131 therapyforhyperthyroidism.JNatl Cancer Inst. 1991;83:1072-1077.
36. Hall P, Holm LE, Lundell G, etal. Cancerrisksin thyroidoocerpatients. BrJCance r. 1991;4:159-163.
37. Hall P, Mattsson AP, Boice JD. Thyroid cancer after diagnostic administration of iodine-131. Ra-diat Res. 1996;145:86-92.
38. Shore RE. Issues and epidermological evidence regardingradiation-inducedthgroi cancer. Rndiat Res. 1992:131:98-111.
39. Ron E, Lubin JH, Shore RE, et al. Thyroid can cerfollowingexposure toexternal radiation.Radzat Res. 1995:141:255-273.
王 杉 译 祝学光 校
JAMA 1998;280:347~355, 百拇医药
单位:
关键词:
美国医学会杂志中文版990304 Cancer Mortality Following Treatment for Adult Hyperthyroidism
Marlene B. Goldman, ScD; Benjamin S. H. Harris IIIf; Daniel A. Hoffman, PhD; William M. McConahey, MD; Harry R. Maxon, MD; Susan Preston-Martin. PhD; M. Ellen Warshauer, MS; F. Lennie Wong, PhD; John D. Boice, Jr, ScD; for the Cooperative Thyrotoxicosis Therapy Follow-up Study Group
, 百拇医药
背景——在美国,大多数成人甲状腺机能亢进患者均采用高剂量131I治疗。虽然几乎没有证据表明治疗性131I与癌症的发生有关,但是对其广泛应用仍需进一步评估。
目的——评估甲状腺机能亢进患者的癌症死亡率,特别是采用131I治疗的患者。
设计——回顾性队列研究。
地点——25所美国医院和一所英国医院。
病例——1946~1964年原“甲状腺毒症治疗随访协作研究”中的35 593例甲状腺机能亢进患者;其中91%为原发性甲状腺机能亢进,女性占79%,65%的病例应用131I治疗。
主要预后指标——三种方法治疗甲状腺机能亢进症后的标准化癌症死亡率比(SMRs)。
, 百拇医药
结果——研究队列中,50.5%的患者在1990年12月随访结束时已死亡。其癌症死亡数接近总人口预期死亡率(2 950/2 857.6),但肺癌、乳腺癌、肾癌和甲状腺癌的死亡率略高,子宫癌和前列腺癌的死亡率则低于预期死亡率。毒性结节性甲状腺肿患者的标准化死亡率比为1.16(95%可信区间[CI],1.03~1.30)。单纯应用抗甲状腺药物治疗者,治疗1年后癌症死亡的危险增加(SMR 1.31;95%CI 1.06~1.60)。除甲状腺癌外(SMR 3.94;95%CI 2.52~5.86),放射性碘与总癌症死亡率(SMR 1.02; 95%CI 0.98~1.07)或任何其他癌症无关。
结论——甲状腺机能亢进和131I均不造成总癌症死亡率的明显增加。尽管131I治疗后甲状腺癌死亡率有所增加,但死亡数增加很小而且甲状腺疾病本身也起一定作用。总之,131I是一种安全的治疗甲状腺机能亢进症的方法。
, http://www.100md.com 甲状腺机能亢进相当常见,尤其是在女性。在美国,80%以上的甲状腺机能亢进症为原发性甲亢(Graves病),其发病率介于0.02%~1%之间1-3。甲状腺机能亢进可用放射碘(131I)、手术(甲状腺次全切除术)或抗甲状腺制剂治疗,但是在美国大多数成人患者均采用131I治疗4。131I治疗的广泛应用引起人们对其潜在致癌性和致白血病性的关注,尽管几乎没有证据支持这种怀疑5-9。由于1986年切尔诺贝利核事故及以往核反应堆和核试验中131I的释放,近来有关131I接触对健康的影响重新引起公众的注意。
“甲状腺毒症治疗随访协作研究”(以下简称“甲状腺随访研究”——译者注)始于1961年。它包括1946~1964年26所医院收治的35 609例甲状腺机能亢进症患者。1968年研究结束时,平均随访期为8.2年。与其他患者比较,采用131I治疗者甲状腺癌的发病率、死亡率10以及白血病的发病率5并无显著增加。最近对Mayo医院(Rochester市,Minn州)和麻省总医院(波士顿市)的患者进行随访亦显示总癌症死亡率与131I治疗无关11,12。然而,在Mayo医院,采用131I治疗的患者,碘浓集器官的癌症发病率增加13(相对危险[RR]1.8;95%CI 1.1~3.2)。在麻省总医院,乳腺癌的发生率轻度增加(RR 1.3;95%CI 0.8~1.9)14。在瑞典,虽然甲状腺机能亢进的131I治疗与白血病(标准化死亡率比[SMR]0.98;95% CI 0.64~1.42)或乳腺癌的死亡率(SMR 0.86;95% CI 0.69~1.02)无关;但是呼吸道癌(SMR 1.26;95%CI 1.04~1.49)和消化道癌的死亡率(SMR 1.14,95%CI 1.03~1.25)则显著上升。随访头10年甲状腺癌的死亡率增加(SMR 3.22;95%CI 1.54~5.98),但在10年后这种现象完全消失(SMR 0.66;95%CI 0.08~2.37)15。为评估甲状腺机能亢进治疗的远期致癌作用,我们对截止1990年的甲状腺随访研究病例的死亡率进行了随访观察。







, 百拇医药
附图 研究数据流程图
方 法
最初的甲状腺随访研究包括1946年1月至1964年12月31日25所美国和1所英国医学中心收治所有甲亢病例(表1)。治疗方法包括131I、甲状腺手术、抗甲状腺药物或这些疗法的组合。从病历记录摘取有关临床数据,将甲状腺机能亢进分为原发性(91%)、毒性结节性甲状腺肿(8%)及原因未明(1%)三类。40%的病例在入组前曾应用某些针对性的治疗,其中75%单用抗甲状腺药物,22%单行甲状腺切除术或结合服用抗甲状腺药物。2%单独应用131I或结合其它疗法。在无病历记载时,随访资料从经治医师、医院或患者获得。第一次随访结束时,6 228例患者(17.5%)死亡,1 432例(4.0%)失访。最初的研究方法已有文献5,10,16,17描述。
应用计算机表格、缩微照片、缩微影盒及手写资料,于1984年建立了包括最初35 630例患者的主资料库(附图)。国立癌症研究所(NCH)与4个地区研究中心(波士顿哈佛大学、纽约Sloan-Kettering癌症中心、洛山矶南加州大学以及北卡罗来纳Triangle研究学院及研究中心)合作,进行了第二次死亡率随访列队研究。有4 010例未包括在内,其中1 414例来自其他地区的3个小治疗中心;另2 596例在完成第一次研究后已从经治医院记录中删除。将这些病例从进一步随访中删除是因为技术原因和无法与病例特点相联。删除这些病例后,31 620例患者符合进一步随访标准。由于在第一次随访时已有6 228例患者死亡,故只能对其余25 392例继续随访。在摘取补充鉴定资料后,使用国家死亡索引、卫生保健资金筹集署、社会安全局、国立人寿统计室、国立机动车管理局、当地追访系统以及商业追访公司的资料记录进行追访。死亡病例均获得死亡证明复印件,并根据国际疾病分类第8版(ICD-8)进行编码18。第一次随访研究的死亡原因,由经过训练的疾病分类学家,根据ICD-719和ICD-8重新编码。最终有35593例患者被编入本列队研究。
, 百拇医药
表1 治疗中心与研究人群 治疗中心
例数(%)*
Mayo医院,Rochester市,New York州
5068(14.2)
Lahey医院,Boston市,Massachusetts州
4282(12.0)
Mount Sinai医院,New York市,New York州
3169(8.9)
Cedars Sinai医学中心,Los
Angeles市,California州
, 百拇医药
2514(7.1)
Columbia Presbyterian医院,New York市,New York州
2373(6.7)
Massachusetts总医院,Boston市
2345(6.6)
Los Angeles县医院,Los
Angeles市,California州
1786(5.0)
New York医院-Cornell医学中心,New York市,1473(4.1)
, 百拇医药
Michigan大学,Ann Arbor市
1275(3.6)
Cleveland大学医院,Cleveland市,Ohio州
1111(3.1)
California大学,San Francisco市
1064(3.0)
Beth Israel医院,Boston市,Massachusetts州
1042(2.9)
Maryland大学,Baltimore市
978(2.7)
, 百拇医药
Montefiore医学中心,New
York市,New York州
952(2.7)
White Memorial医院,Los
Angeles市,California州
841(2.4)
Cincinnati大学,Cincinnati市,Ohio州
785(2.2)
St Louis大学,St Louis市,Missouri州
762(2.1)
, 百拇医药
Ochsner医院,New Orleans市,Louisana州
585(1.6)
Memorial Sloan-Kettering医院,New York市,New York州
573(1.6)
Strong Memorial医院,Rochester市,New York州
466(1.3)
Cleveland Metropolitan总医院,Cleveland市,Ohio州
450(1.3)
Sheffield医院,英国
, http://www.100md.com
1699(4.8)
* 包括最终研究人群35 593例
 包括Veterans Affairs Wadsworth, Veterans Affairs Long Beach, Los Angeles市California大学南California大学和一些私人医院
包括Veterans Affairs Wadsworth, Veterans Affairs Long Beach, Los Angeles市California大学南California大学和一些私人医院 因技术原因,这次研究对这些中心没有进行随访
因技术原因,这次研究对这些中心没有进行随访在主要分析中,我们对实际死亡数与预期死亡率(以美国全国死亡率为依据)进行了比较。以患者入选至死亡、最后存活日期(失访患者)或随访结束时(至1990年12月31日仍存活者)的时间为准,计算人-年危险数。将观察样本假定为泊松(Poisson)分布,计算其标准化死亡率比(实际死亡数/预期死亡数)和95%可信区间。不同病因预期死亡数用相应危险人-年时之不同年龄、性别、种族、年度死亡率计算20。由于我们用美国死亡率作为参照,所以须将1 699例英国患者从这些分析中去除。此外,还有146例因性别、出生日期、入组日期缺失而被剔除,最终剩下33 748例患者。
, 百拇医药
分别对原发性甲亢和毒性结节性甲状腺肿患者以及施实的7种治疗进行SMR分析。7种治疗包括:131I+药物;手术;手术+药物;131 I治疗;131I+手术;131I+手术+药物以及单纯药物治疗。实际上,由于4组131I治疗患者和二组手术患者结果相同,我们只展示了两个综合治疗组的结果。因为药物治疗开始日期不详,所以在估计潜伏期时,我们将入组日期作为药物治疗开始日期。98%的131I治疗的患者和78%的手术治疗的患者第一次治疗是在入组2年内,只有231例在131I治疗前先行手术。由于入组1年内死亡者不太可能为治疗甲亢所致,因此我们将这些死亡病例从所有与治疗有关的分析中去除。在用全美死亡率进行总死亡率分析时,未去除已患癌症的病例,因为他们也包括在全国死亡率中。
每例患者,131I进入17个器官的剂量可用131I放射剂量乘每个器官的剂量因子获得。后者是由国际放射保护委员会的表格提供的21,包括年龄(1、5、10、15和>15岁)和24小时甲状腺的摄取率(0%、25%、35%、45%和55%)。年龄等于或小于15岁的患者不足500例。大多数患者(70%)至少有一个24小时甲状腺摄碘量大于55%。因为许多医院均采用标准放射活性剂量,所以治疗前未测量甲状腺摄取量。我们应用3 162例治疗前1个月内测定摄取量的经验,根据性别、治疗时年龄、治疗次数、治疗年份、医院、甲亢类型及131I剂量,估计其摄取量。因为必须知道腺体大小、剂量分布和有效半衰期,所以我们没有测定进入甲状腺的量。然而,在治疗时通常至少50~70Gy到达甲状腺22。其他脏器仅有3个131I平均摄取量大于100mGy:胃(178mGy),膀胱(128mGy)和小肠(108mGy)。红骨髓平均为42mGy,乳腺为32mGy。应用不同估计方式,Saenger等5报道平均骨髓摄131I量为80~160mGy。他们的估计为我们的2~4倍,这可能与当时所获资料来自文献有关23,24。他们假设血浓度为给药浓度的1.7倍,骨髓摄碘量为血浓度的46~86%。最近Zanzonico等25重新测定了468例患者的摄131I量,其结果与我们相同:原发甲亢患者膀胱、红骨髓和乳腺的平均摄取量分别为190mGy、50mGy和30mGy。为保证摄取量不显著影响分析,我们假设所有未知摄取为25%~55%(采用国际放射保护委员会表格的上、下限)。按55%摄取量估计摄131I,与摄取量估计相同。按25%摄取估计,摄131I量虽然较低,但甲亢患者摄取量很少低于50%。
, 百拇医药
由于对甲状腺以及造血和淋巴增生性恶性疾病的特殊兴趣,为了评估死于造血和淋巴增生性恶性疾病与131I给药剂量和骨髓吸收量的关系,我们用Poisson回归法对组间队列时间/照射量数据进行了分析。分析甲状腺死亡率时,因为不能估计器官内剂量,所以我们仅测定了131I给药剂量。由于这些分析无外对照,我们采用了英国的病例,但将入组前已诊断癌症的病例剔除。对这些数据进行交叉分类。按照性别、治疗时年龄(0~29,30~39,40~49,50~59,≥60岁)、治疗后时间(0~4,5~9,10~19和≥20年)、甲亢类型(原发甲亢、毒性结节性甲状腺肿)、131I摄入量(0,0.01~4,5~6,7~9,10~14,15~19和≥20mCi)及为分析造血和淋巴增生性恶性疾病的红骨髓估计量(0,0.1~14,15~19,20~24,25~29,30~39,40~49,50~79和≥80mGy)建立一线性额外相对危险的剂量/反应模型(外暴露人群的基本疾病率×[1+额外相对危险]),并将所描述的相关变量一并考虑。用性别、治疗时年龄、治疗后时间和甲亢类型对基本率进行分组。得出最大参数指标。用似然比检验估计剂量反应显著性26。应用131I辐射作为连续变量进行趋势检验。这些分析均用EPICURE软件(HiroSoft国际公司、西雅图市、华盛顿州)进行27。
, 百拇医药
结 果
随访结束时,对35 593例研究对象(79%女性)共进行了738 831人-年的随访。入组时平均年龄为46岁,3%小于20岁。10 760例患
表2 治疗组与人群特点 治疗方法
女性
例数(%)
男性
例数(%)
合计
例数(%)*
年龄
平均,岁
, 百拇医药
随访
平均,年
131 I
18 020(63.8)
5 000(68.1)
23 020(64.7)
49.0
18.9
单纯131I
7 029(24.9)
1 999(27.2)
, 百拇医药 9 028(25.4)
49.9
18.0
131 I+药疗
7 999(28.3)
2 440(33.2)
10 439(29.3)
49.5
18.5
131 I+手术
757(2.7)
135(1.8)
, http://www.100md.com
892(2.5)
48.3
19.7
131 I+药疗+手术
2 235(7.9)
426(5.8)
2 661(7.5)
44.5
23.1
手术(无131 I)
9 119(32.3)
, http://www.100md.com 2 080(28.3)
11 199(31.5)
41.6
26.2
单纯手术
654(2.3)
164(2.2)
818(2.3)
50.8
22.7
手术+药疗
8 465(30.0)
, 百拇医药
1 916(26.1)
10 381(29.2)
40.8
26.5
单纯药疗
1 094(3.9)
260(26.1)
1 374(3.8)
44.9
17.8
合计
28 248(100.0)
, 百拇医药
7 345(100.0)
35 593(100.0)
46.5
21.2
* 入组时平均年龄
有15例女性和5例男性疗法不详或采用其他疗法者(30.2%)目前仍存活,17 959例(50.5%)已死亡,6 874例(19.3%)失访。88%的患者随访已5~10年,随访10年以上者占76%。平均随访21年(范围1~44年)。总随访率较好的为男性患者(83%,女性79%)、老年患者(入组时≥50岁86%,<50岁77%)和手术治疗的患者(手术88%,131I 78%,药物治疗75%)。治疗组间的差别为手术病例(4 010例)因技术原因不能随访者所占较少(13%)所致。进行随访者(31 620例),各种疗法间随访率无区别(手术92%,131I 92%,药物治疗90%)。约近65%的研究对象应用了131I;25%单用131I,39%为手术和/或药物治疗加131I(表2)。每次治疗平均131I给药剂量为6.1mCi(SD,5.2)。患者平均接受1.8次131I治疗,累积平均总量为10.4mCi(第5~第95百分位数为3.27mCi)。毒性结节性甲状腺肿患者的平均治疗数和累积给药剂量(2.1次,170mCi)比原发甲亢(1.7次,10.0mCi)高。20 639例患者首次查体记录的平均甲状腺摄碘率为62.4%,略大于手术治疗患者的40%,几乎所有患者均联合应用抗甲状腺药物。仅4%的患者单独使用药物治疗。女性较男性年轻,手术治疗率亦略高。原发甲亢患者,与手术(30.7%)或抗甲状腺药物(3.8%)相比,更倾向于应用131I治疗(65%)。与此相反,毒性结节性甲状腺肿则有43.2%的患者应用131I治疗,54.5%手术治疗,2.3%药物治疗。
, 百拇医药
表3 美国甲亢患者的实际和预期癌症死亡率*

全部恶性疾病
479/366.40
13.31(1.19-1.43)
402/389.84
1.03
2 069/2 101.39
0.98
2 950/2 857.64
1.03
, http://www.100md.com
全部实体癌症
443/338.59
1.31(1.19-1.44)
358/358.15
1.00
1 893/1 913.39
0.99
2 694/2 610.13
1.03
鼻窦
9/6.26
1.44
, 百拇医药
6/6.85
0.88
36/34.50
1.04
51/47.60
1.07
消化道
143/121.32
1.18
118/126.04
0.94
610/612.52
, 百拇医药
1.00
871/859.88
1.01
食道
1/4.84
0.21
6/5.40
1.11
30/30.33
0.99
37/40.57
0.91
胃
, 百拇医药
35/26.31
1.33
24/24.24
0.99
82/83.16
0.99
141/133.72
1.05
结直肠
66/55.73
1.18
73/59.90
, 百拇医药
1.22
313/312.46
1.00
452/428.09
1.06
肝
10/14.85
0.67
5/13.84
0.36(0.12-0.84)
45/48.91
0.92
, 百拇医药
60/77.59
0.77(0.59-1.00)
胰
25/16.64
1.50
8/19.50
0.41(0.18-0.81)
128/116.99
1.09
161/153.13
1.05
喉
, 百拇医药
2/2.08
0.96
1/2.27
0.44
5/11.65
0.43
8/16.00
0.50(0.22-0.99)
肺
54/33.84
1.60(1.20-2.08)
55/42.87
, 百拇医药
1.28
391/374.83
1.04
500/451.53
1.11(1.01-1.21)
乳腺
80/55.44
1.44(1.14-1.80)
68/58.01
1.17
312/279.94
1.11
, http://www.100md.com
460/393.37
1.17(1.06-1.28)
子宫
34/38.48
0.088
19/34.04
0.56(0.34-0.87)
64/101.71
0.63(0.48-0.80)
117/174.23
0.67(0.56-0.80)
, 百拇医药
卵巢§
22/19.08
1.15
26/19.99
1.30
104/98.09
1.06
152/137.16
1.11
前列腺
9/7.31
1.23
8/8.95
, http://www.100md.com
0.89
43/65.90
0.65(0.47-0.88)
60/82.16
0.73(0.56-0.94)
膀胱
10/7.96
1.26
5/8.78
0.57
49/47.05
1.04
, http://www.100md.com
64/63.79
1.00
肾
17/5.94
2.86(1.67-4.58)
7/6.57
1.07
42/37.77
1.11
66/50.28
1.31(1.02-1.67)
脑,神经系统
, 百拇医药
5/7.24
0.69
9/7.48
1.20
41/37.57
1.09
55/52.29
1.05
甲状腺
13/1.74
7.47(3.97-12.78)
2/1.76
, 百拇医药
1.14
14/6.97
2.01(1.10-3.37)
29/10.47
2.77(1.85-3.98)
全部造血和
36/27.81
0.77
44/31.69
1.39(1.01-1.86)
176/188.00
0.94
, http://www.100md.com
256/247.50
1.03
淋巴增生
淋巴瘤
16/13.39
1.24
13/14.46
0.90
69/75.28
0.92
98/103.13
0.95
, 百拇医药 白血病
15/12.55
1.19
22/13.59
1.62(1.01-2.45)
81/73.16
1.11
118/99.29
1.19
* 数据不包括英国病例
 入组到癌症死亡人-年随访数:0-4年,158 654;5-9年,137 290;10或10年以上,420 715;总人-年随访数,716 659
入组到癌症死亡人-年随访数:0-4年,158 654;5-9年,137 290;10或10年以上,420 715;总人-年随访数,716 659 SMR:标准化死亡率;CL:可信限:标准化死亡率可信限显著性为0.05
SMR:标准化死亡率;CL:可信限:标准化死亡率可信限显著性为0.05, http://www.100md.com
§ 包括其他和未特别指明的女性生殖系癌症
入组时,1 082例(1 338种)患者有既往肿瘤病史。研究期间,23%的病例死于恶性肿瘤,如除外有甲状腺癌病史的患者(通常手术治疗),单纯药物治疗者以往患癌率最高(达39.3‰),131I治疗居中(14.2‰),手术治疗者最低(5.5‰)。
表4 美国不同类型甲亢患者的癌症死亡率
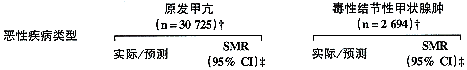
全部
2 617/2 574.70
1.02
298/257.19
, 百拇医药 1.16(1.03-1.30)
鼻窦
48/43.36
1.11
2/3.86
0.52
消化道
777/759.06
1.02
81/92.01
0.88
食道
31/37.10
, http://www.100md.com
0.84
6/3.17
1.89
胃
117/116.26
1.01
19/15.97
1.19
结直肠
411/377.40
1.09
34/46.25
0.74
, http://www.100md.com
肝
51/67.39
0.76(0.56-1.00)
8/9.29
0.86
胰
149/137.03
1.09
12/14.69
0.82
喉
6/14.84
, http://www.100md.com 0.40(0.15-0.88)
2/1.06
1.88
肺
453/422.09
1.07
43/26.60
1.62(1.17-2.18)
乳腺
405/355.22
1.14(1.03-1.26)
48/34.48
, http://www.100md.com
1.39(1.03-1.85)
子宫
98/154.76
0.63(0.51-0.77)
19/17.65
1.08
卵巢§
139/123.85
1.12
12/12.03
1.00
前列腺
, 百拇医药
51/74.77
0.68(0.51-0.90)
9/6.74
1.34
膀胱
59/56.01
1.05
5/7.12
0.70
肾
61/45.46
1.34(1.03-1.72)
, 百拇医药
3/4.38
0.68
脑
49/48.80
1.00
6/3.13
1.92
甲状腺
19/9.12
2.08(1.25-3.25)
8/1.23
6.53(2.80-12.82)
, 百拇医药
CLL
26/22.84
1.14
5/3.02
1.66
Non-CLL
80/65.95
1.21
6/6.72
0.89
淋巴瘤
86/93.28
0.92
, 百拇医药
10/8.96
1.12
骨髓瘤
25/38.53
0.65(0.42-0.96)
5/3.47
1.44
* 数据不包括英国病例。SMR:标准化死亡率比;CI:可信区间;CLL:慢性淋巴细胞性白血病和未特别指明的淋巴细胞性白血病(国际疾病分类,修订版,编码204.1、204.9);Non-CLL:急性淋巴细胞性白血病,髓样和单核细胞性白血病,以及其他和非特别指明的白血病(国际疾病分类,修订版,编码204.0,205,206,207)
 329例病人疾病类型不详者未包括在此分析中。原发甲亢人-年随访数;669 231;毒性结节性甲状腺,42 465
329例病人疾病类型不详者未包括在此分析中。原发甲亢人-年随访数;669 231;毒性结节性甲状腺,42 465 标准化死亡率比可信限显著性为0.05
标准化死亡率比可信限显著性为0.05, 百拇医药
§ 包括其他和未特别指明的女性生殖系癌症所有治疗
所有病例:在33 748例已知出生日期、入组日期和性别的美国患者中,共有16 683例已死亡(49.4%)。除111例外,均已知死亡原因。2 950例主要死因为癌症,预期癌症死亡数为2 857.6例(表3)(SMR 1.03)。虽然癌症死亡的危险因随访年数而异,但是仅在头4年显著增加(SMR 1.31;95%CI 1.19~1.43),特别是第一年(SMR 1.52;95%CI 1.25~1.84)。研究期间死于肺癌(SMR 1.11)、乳腺癌(SMR 1.17)、肾癌(SMR 1.31)和甲状腺癌(2.77)者明显高于美国平均人口。所有4种癌的SMR均于入组5年内最高,仅甲状腺癌的死亡率在入组10年后仍显著增高(SMR 2.01;95%CI 1.10~3.37)。肝、喉、子宫和前列腺癌的死亡率显著低于预期值。研究期间,淋巴瘤、白血病及造血和淋巴增生性恶性疾病(作为一组)的死亡率无明显增加。但入组后5~9年白血病的死亡率增加(SMR 1.62;95%CI 1.01~2.45)。
, http://www.100md.com
由于79%的患者为女性,女性死亡率在总评估中占支配地位。女性患者预期癌症死亡数为2 101.8,实际死于癌症者2 252(SMR 1.07;95%CI 1.03~1.12),肺癌(SMR 1.28;95%CI 1.14~1.44)、乳腺癌(SMR 1.17;95%CI 1.07~1.28)、肾癌(SMR 1.37;95%CI 1.00~1.83)和甲状腺癌(SMR 2.66;95%CI 1.70~3.95)的实际死亡率均有增高。子宫癌(体和颈)的死亡率则较预期为低(SMR 0.67;95%CI 0.55~0.80)。在入组5年以后,仅肺癌和甲状腺癌的死亡率仍保持较高,而子宫癌的死亡率仍低于预期值。对于男性,总的癌症死亡危险低于预期值(SMR 0.92;95%CI 0.86~0.99)。甲状腺癌有5例死亡,其死亡危险增高(SMR 3.51;95%CI 1.13~8.18)主要为头4年死亡率危险增加了14倍所致(95% CI 2.35~33.72)。喉癌(SMR 0.29;95% CI 0.006~0.83)和前列腺癌(SMR 0.73;95% CI 0.56~0.94)均较预期值低。
, http://www.100md.com
原发性甲亢和毒性结节性甲状腺肿患者:总癌症死亡率增加与原发甲亢无关(SMR 1.02;95% CI 0.98~1.06),但毒性结节性甲状腺肿患者则比预期高16%(SMR 1.16;95% CI 1.03~1.30)(表4)。原发甲亢患者乳腺癌、肾癌和甲状腺癌的死亡率增加,但危险增加仅限于随访头4年,死于肝癌、喉癌、子宫癌、前列腺癌和多发骨髓瘤者均较预期值为低。毒性结节性甲状腺肿患者肺癌、乳腺癌、甲状腺癌和实际死亡率增加,并见于入组5年以上。(肺癌SMR 1.46[95%CI 1.01~2.06];乳腺癌SMR 1.45[95%CI 1.03~1.98];甲状腺癌SMR 4.3;[95%CI 1.16~11.01])。
131I治疗
评估癌症死亡率与治疗方法的关系不包括随访第一年(表5)。我们对几乎21 000例患者进行了高达385 000人-年的随访,结果显示131I治疗后总的癌症危险与预期全国癌症死亡率接近(SMR 1.02;95%CI 0.98~1.07)。甲状腺癌的死亡率有所增加(SMR 3.94;95%CI 2.52~5.86),但前列腺癌和子宫癌的死亡率低于预期值。8 054例单纯131I治疗者的分析结果与之相同。为了证实甲状腺癌死亡率增加与4例入组前甲状腺癌无关,我们将其剔除后进行分析,结果SMR仍然增高(SMR 3.28)。
, 百拇医药
在随访1~5年时,所有癌症标准化死亡率(表6)(SMR 1.24;95%CI 1.10~1.40)以及结直肠癌的死亡率均有显著增高(SMR 1.42;95%CI 1.04~1.90)。在头9年,肺癌(SMR 1.44;95%CI 1.13~1.81)和非慢性淋巴细胞性白血病(non-CLL)的死亡率增高(SMR 1.88;95%CI 1.18~2.84)。随访10年后,仅甲状腺癌的死亡率仍显著增高。但在365例小于20岁的用131I治疗的患者中,无论实际值或预期值均无死亡。
表5 美国不同治疗组甲亢患者的癌症死亡率*

全部
1742
1.02
, 百拇医药
659
1.04
1005
0.99
95
1.31(1.06-1.60)
鼻窦
32
1.12
12
1.12
13
0.79
, 百拇医药
5
4.16(1.34-9.72)
消化道
537
1.05
207
1.09
286
0.95
26
1.19
食道
25
, http://www.100md.com
1.00
11
1.15
10
0.74
1
0.99
胃
82
1.05
28
0.97
42
, 百拇医药 0.90
7
1.95
结直肠
282
1.11
108
1.15
154
1.02
12
1.12
肝
, 百拇医药 39
0.87
16
0.97
19
0.69
2
0.97
胰
99
1.07
38
1.10
56
, 百拇医药
1.05
3
0.79
喉
4
0.41
2
0.54
3
0.56
0
0
肺
295
, 百拇医药
1.06
96
0.91
182
1.17(1.01-1.35)
10
0.94
乳腺
248
1.10
90
1.08
172
, 百拇医药
1.17(1.00-1.36)
18
1.69
子宫
68
0.69(0.54-0.88)
22
0.61(0.38-0.93)
36
0.57(0.40-0.79)
4
0.83
, 百拇医药
卵巢§
86
1.09
31
1.07
54
1.06
5
1.37
前列腺
36
0.67(0.47-0.93)
10
, 百拇医药
0.50(0.24-0.91)
21
0.82
2
1.09
膀胱
42
1.08
14
0.97
17
0.78
2
, http://www.100md.com
1.30
肾
37
1.23
16
1.43
21
1.19
2
1.61
脑
30
0.98
, 百拇医药 18
1.60
20
1.05
5
3.71(1.19-8.64)
甲状腺
24
3.94(2.52-5.86)
11
4.91(2.45-8.79)
4
1.07
, http://www.100md.com
0
0
CLL
19
1.23
6
1.05
12
1.30
0
0
Non-CLL
53
, http://www.100md.com 1.22
18
1.12
30
1.14
1
0.54
淋巴瘤
52
0.85
26
1.16
39
, 百拇医药 1.06
4
1.53
骨髓瘤
21
0.81
10
1.02
7
0.48(0.40-0.79)
2
1.95
* 数据不包括英国病例。SMR:标准化死亡率;CI:可信区间;CLL:慢性淋巴细胞性白血病和未特别指明的淋巴细胞性白血病(国际疾病分类,修订版,编码204.1,204.9);Non-CLL:急性淋巴细胞性白血病,所有骨髓样和单核细胞性白血病以及其他和未特别指明的白血病(国际疾病分类,修订版,编码204.0,205,206,207)
, 百拇医药
 任何131I治疗的人年随访数为3 8546.8;单纯131I治疗,141 543;手术或手术+药疗,275 963;单纯药疗,21 415
任何131I治疗的人年随访数为3 8546.8;单纯131I治疗,141 543;手术或手术+药疗,275 963;单纯药疗,21 415 标准化死亡率可信限显著性为0.05
标准化死亡率可信限显著性为0.05§ 包括其他和未特别指明的女性生殖系癌症表6 美国用131I治疗之甲亢患者的癌症死亡率*

全部
258
1.24(1.10-1.40)
, http://www.100md.com
278
1.05
1206
0.98
鼻窦
6
1.65
2
0.42
24
1.19
消化道
83
, http://www.100md.com
1.21
83
0.97
371
1.04
食道
0
0
5
1.31
20
1.09
胃
, 百拇医药 14
0.98
17
1.07
51
1.06
结直肠
45
1.42(1.04-1.90)
49
1.20
188
1.03
, http://www.100md.com
肝
6
0.74
4
0.45
29
1.04
胰
16
1.62
6
0.44(0.16-0.96)
77
, 百拇医药
1.11
喉
1
0.82
0
0
3
0.43
肺
31
1.49(1.01-2.12)
44
1.41(1.02-1.89)
, 百拇医药
220
0.97
乳腺
39
1.26
36
0.93
173
1.11
子宫
18
0.89
16
, http://www.100md.com
0.74
34
0.61(0.42-0.85)
卵巢§
8
0.75
18
1.35
60
1.09
前列腺
5
1.14
, http://www.100md.com
5
0.78
26
0.61(0.40-0.89)
膀胱
6
1.30
2
0.33
34
1.21
肾
6
, http://www.100md.com
1.75
4
0.88
27
1.22
脑
3
0.75
6
1.20
21
0.98
甲状腺
, http://www.100md.com 12
12.32(6.38-21.61)
1
0.86
11
2.78(1.38-4.97)
CLL
2
0.93
5
1.96
12
1.12
, http://www.100md.com
Non-CLL
8
1.61
14
2.10(1.14-3.52)
31
0.98
淋巴瘤
5
0.62
10
1.02
37
, 百拇医药
0.85
骨髓瘤
3
1.35
4
1.23
14
0.68
* 数据不包括英国病例。SMR:标准化死亡率比;CI:可信限;CLL:慢性淋巴细胞性白血病和未特别指明的淋巴细胞性白血病(国际疾病分类,修订版,编码204.1,204.9);Non-CLL:包括急性淋巴细胞性白血病、所有髓性和单核细胞性白血病和其他未特别指明的白血病(国际疾病分类,修订版,编码204.0,205,206,207)
, 百拇医药
 入组到癌症死亡人-年数:1-4年,78 372;5-9年,83 190;10或10年以上,22 3906
入组到癌症死亡人-年数:1-4年,78 372;5-9年,83 190;10或10年以上,22 3906 SMRs可信区间显著性水平为0.05
SMRs可信区间显著性水平为0.05§ 包括其他和未特别指明的女性生殖系癌症
采用131I治疗原发性甲亢的患者(表7),甲状腺癌的死亡率增加(SMR 2.84;95%CI 1.62~4.61),但随访5年或5年以后无显著增高(SMR 1.88;95%CI 0.86~3.57)。采用131I治疗的毒性结节性甲状腺肿患者,总癌死亡率(SMR 1.31;95%CI 1.07~1.58)以及食管癌、子宫癌(特别是宫体)和甲状腺癌的死亡率增加(表7)。入组5年以上的毒性结节性甲状腺肿患者,食管癌(SMR 5.26;CI 1.42~13.5)、子宫体癌(SMR 3.0;CI 1.09~6.53)和甲状腺癌(SMR 11.1;CI 2.26~32.5),的死亡率仍然增高。131I治疗次数与总癌症死亡率(治疗1,2~4和≥5次者,SMR分别为1.00、1.09和0.99)和癌肿部位有明显关系(结果未显示),但甲状腺癌除外。严格分析随访5年、10年或更长结果并未改变这个结论。在研究期间,甲状腺癌的标准化死亡率比随治疗次数增加而增高(1,2~4和≥5次的SMR分别为2.74、6.21和6.61)。入组10年后的结果大体相同(1,2~4和≥5次SMR分别为2.66、4.48和5.43)。
, http://www.100md.com
表7提供了有关131I剂量与总癌症死亡率以及给药剂量与肺癌、甲状腺癌死亡率关系的证据。然而,入组10或10年以上者与给药的关系便不明显了。剂量<7 mCi、7~15 mCi和≥15 mCi时,所有癌症的SMR分别为0.90、1.03和1.06;肺癌为0.83、1.03和1.21;甲状腺癌为1.85、4.11和1.59。对不同甲亢类型进行分析提示,原发性甲亢患者甲状腺癌的死亡率随给药剂量的增加而增高。在毒性结节性甲状腺肿患者,癌症死亡率与给药量无关,癌症数较小,可信区间较宽。
我们还对放射剂量与甲状腺癌死亡率的关系进行了Poission回归分析。该分析考虑了甲亢的类型,但去除了采用手术治疗的患者(因为甲状腺癌的危险随组织容积的减少而降低)和入组前已患癌症的患者,共剩余16例甲状腺癌死亡(表8)。结果显示最高给药剂量组的相对危险为2.3(95%CI 0.97~9.5),但辐射-反应趋势无统计学差异(P=0.12)。同样,高相对危险点是阳性的(在1 mCi的高相对危险=0.12),但不显著。在入组5年或5年以后,给药剂量与甲状腺癌死亡率无关。
, 百拇医药
131 I剂量或骨髓估计量与慢性淋巴性白血病、非慢性淋巴性白血病、何杰金氏病、非何杰金氏淋巴瘤或多发骨髓瘤无关(表9)。由于放射线诱导非慢性淋巴性白血病的潜伏期较短,我们还分析了随访头10年的非慢性淋巴性白血病的资料,但结果仍与骨髓估计量无关(P=0.46),对于多发骨髓瘤,虽然二个最高剂量和骨髓估计量组相对危险增加,但是因为例数较少,剂量-反应趋势亦不显著。
表7 美国不同类型及不同131I治疗剂量甲亢患者的癌症死亡率*

全部
1615
1.01
104
, 百拇医药
1.31(1.07-1.58)
637
0.94
763
1.04
342
1.18(1.06-1.31)
鼻窦
30
1.10
1
0.85
14
, 百拇医药
1.23
15
1.21
3
0.61
消化道
501
1.05
30
1.07
211
1.07
216
, 百拇医药
0.98
110
1.18
食道
21
0.88
4
4.06(1.10-10.45)
9
0.91
9
0.83
7
, 百拇医药
1.62
结直肠
265
1.12
13
0.92
114
1.15
114
1.04
54
1.18
肝
, 百拇医药
36
0.87
2
0.73
16
0.95
14
0.72
9
1.05
胰
95
1.09
, 百拇医药 4
0.87
40
1.09
37
0.93
22
1.37
喉
4
0.42
0
0
0
, 百拇医药
0
4
0.93
0
0
肺
281
1.05
11
1.29
108
0.94
129
, http://www.100md.com 1.08
58
1.33(1.01-1.72)
乳腺
229
1.08
13
1.20
85
0.92
120
1.25(1.04-1.49)
43
, http://www.100md.com
1.18
子宫
57
0.62(0.47-0.81)
11
2.05(1.02-3.67)
14
0.36(0.20-0.61)
31
0.73
23
1.34
, 百拇医药 卵巢‖
81
1.09
4
1.06
32
0.98
39
1.16
15
1.19
前列腺
34
, http://www.100md.com 0.67(0.46-0.93)
2
1.00
14
0.69
14
0.60
8
0.81
膀胱
41
1.14
1
, 百拇医药
0.46
15
1.02
16
0.95
11
1.51
肾
35
1.23
1
0.74
16
, http://www.100md.com 1.33
19
1.46
2
0.39
脑
27
0.92
3
3.05
13
1.01
12
0.92
, 百拇医药
5
1.09
甲状腺
16
2.84(1.62-4.61)
7
18.88(7.58-38.98)
7
3.01(1.20-6.19)
9
3.42(1.56-6.50)
8
, http://www.100md.com
7.05(3.05-13.95)
CLL
19
1.33
0
0
8
1.36
8
1.20
3
1.04
Non-CLL
, http://www.100md.com
50
1.22
2
0.96
25
1.44
18
0.96
10
1.35
淋巴瘤
49
0.85
, 百拇医药
2
0.72
17
0.69
24
0.92
11
1.08
骨髓瘤
18
0.73
2
1.76
, 百拇医药
6
0.57
11
0.99
4
0.94
* 数据不包括英国病例。SMR:标准化死亡率比:CI:可信区间;CLL:慢性淋巴细胞性白血病和未特别指明的淋巴细胞性白血病(国际疾病分类,修订版,编码204.1,204.9);
Non-CLL:包括急性淋巴细胞性白血病、所有髓性和单核细胞性白血病,以及其他未特别指明的白血病(国际疾病分类,修订版,编码204.0,205,206,207)
 原发甲亢人-年随访数,368 934;毒性结节性甲状腺,13 088:给药活性小于7年,160 563:7-14年,165 666:15或15年以上99 239
原发甲亢人-年随访数,368 934;毒性结节性甲状腺,13 088:给药活性小于7年,160 563:7-14年,165 666:15或15年以上99 239 疾病类型不详,523例
疾病类型不详,523例, http://www.100md.com
§ SMRs可信区间显著性水平为0.05
‖包括其他和未特别指明的女性生殖系癌症表8 131I剂量与甲亢患者甲状腺癌死亡率* 放射剂量mCi

<7
146 494
4
1.00
112 832
3
1.00
7-14
, http://www.100md.com
145 700
6
1.24
109 679
6
1.67
≥15
52 786
6
2.28
38 162
1
0.57
, 百拇医药
趋势P值
0.12
>0.5
额外RR在1 mCi
0.12
0.009
* 数据包括美国和英国18 633例未行甲状腺部分或全切术和入组前未患癌症病例。PRY:人-年随访;RR:相对危险
 参考值手术治疗
参考值手术治疗10 876例未接受131I的手术患者,其总癌症死亡率的SMR为0.99(表5)。去除随访第一年的资料,手术患者肺癌、乳腺癌的死亡率显著增加,甲状腺癌的死亡率则无增加(SMR 1.07),多发性骨髓瘤的实际死亡率比预期低50%(SMR 0.48;95%CI 0.19~0.99)
, 百拇医药
抗甲状腺药物治疗
应用抗甲状腺药物治疗的患者,入组1年或1年以后,所有癌症的死亡数显著增加(包括鼻窦癌和脑癌)(表5)。由于用抗甲状腺药治疗的患者入组前癌症的诊断率很高,因此我们在分析标准化死亡率时,将入组前已诊断癌的病例去除。结果显示仅脑癌的死亡率仍有增加。去除入组前诊断癌症的病例,将低估SMR。
评 论
我们评估了甲亢三种方法治疗后的癌症死亡率。因为在美国131I是治疗甲亢的主要选择且其致癌作用不详,所以我们着重评估131I。甲状腺随访研究在第一次评估时报道,与其他方法相比,131I治疗并不增加白血病和甲状腺癌的发生率5,6,10,16。与此相反,Williams28的分析则显示,131I治疗组未分化型甲状腺癌轻度增加,他们认为这可能为放射线使原来未检测出的分化较好的癌转变为未分化癌所致。对原始队列中2个女性亚组进行额外随访提示,浓集131I的11,13的器官发生癌症的危险或乳腺癌的发生率轻度增加14。
, http://www.100md.com
表9 131I剂量与造血系恶性疾病的死亡率 给药剂量
PYR

131 Ⅰ放射剂量mCi
0
321 698
12
1.00
31
1.00
6
, http://www.100md.com 1.00
31
1.00
8
1.00
>0-6
177 360
5
0.61
25
1.19
3
0.77
, http://www.100md.com
15
0.66
4
0.81
7-14
176 279
4
0.44
17
0.76
1
0.17
20
, 百拇医药
0.89
12
2.23
≥15
63 494
3
0.83
10
1.12
2
1.36
8
0.95
, 百拇医药
4
1.73
P值
>0.5
>0.5
>0.5
>0.5
0.3
额外RR在1 mCi
-0.008
0.001
-0.008
-0.003
, http://www.100md.com
0.038
骨髓量,cGy
0
313 021
12
1.00
31
1.00
6
1.00
31
1.00
8
, http://www.100md.com
1.00
>0-4.9
331 955
8
0.50
38
0.92
4
0.56
34
0.80
16
1.69
, 百拇医药
≥5
90 279
3
0.63
13
1.11
2
1.00
9
0.79
4
1.36
P值
, 百拇医药 >0.5
>0.5
>0.5
>0.5
0.3
额外 RR在1cGY
-0.01
-0.01
-0.01
0.006
0.11
*CLL:慢性淋巴细胞性白血病:Non-CLL:非慢性淋巴细胞性白血病;PYR:人-年随访;RR:相对危险
 数据包括英国病例,但不包括入组前已诊断癌症的患者
数据包括英国病例,但不包括入组前已诊断癌症的患者, 百拇医药
本次随访将其与美国相应年龄、性别、年限死亡率进行了比较,结果显示131I没有造成更多的癌症死亡。131I浓集器官(唾液腺、食道、胃、结肠、直肠、肝、膀胱和肾,作为一个整体)的癌症死亡率亦无增加(SMR 1.03)。仔细分析显示,造血系统恶性疾病与131I剂量或者骨髓估计量与非慢性淋巴性白血病亦无关联。分析未获得阳性结果并不意外,因为除甲状腺外,其他器官的平均接受量均小于200 mGy。在这样低的剂量下,检测其作用在统计学上是有局限性的。本研究检测的几乎均为成人,因此其结果不能用于儿童。
死亡率研究并不十分适合甲状腺癌研究。然而,不管怎样,我们确实观察到男女毒性结节性甲状腺肿患者和原发甲亢患者甲状腺癌的死亡率增加。而且甲状腺癌死亡危险增高仅见于131I治疗的患者。不论是用外对照(SMR分析)还是内对照(Poisson分析),其危险度均随131I剂量的增加而增加。入组10年后或用内对照分析时,趋势不再有显著性。
, 百拇医药
在解释这些结果时有几点应予注意。在甲亢患者给药剂量与甲状腺放射量的相互关系通常较差22。一般患者所用放射剂量越大,疾病越重,其复发率亦越高;毒性结节性甲状腺肿患者死于甲状腺癌的危险较原发甲亢患者高(30%/8%);死亡率增加主要在治疗后头5年;甲状腺肿,尤其是结节性甲状腺肿,是甲状腺癌的危险因素之一29-31;有些毒性甲状腺肿患者入组前可能已有未被诊断的甲状腺癌。
假设实际甲状腺癌增加是有原因的,其危险度应较外照后小。某些差异可用131I治疗诱发细胞消亡解释。尽管不能直接估算甲状腺剂量,但是131I治疗的目的是破坏甲状腺32。131I杀死甲状腺细胞的作用有可能减少细胞恶变率。另一种解释与受辐射时的年龄有关。因为,外照射后发生甲状腺癌的危险随着年龄的增大而减小,20岁以后几乎没有危险。本文资料来自成人,因此不能据此对131I和外照射进行比较。到目前为止,几乎所有人类131I资料均来自成人15,33-37,而甲状腺外照射数据则大多来自儿童38,39。最后,本文部分患者于131I治疗后施行了甲状腺全切或次全切除术,切除放射损伤组织亦可能降低甲状腺癌的危险。
, http://www.100md.com
与我们的研究相比,瑞典死亡率研究的患者年龄稍大,随访期较短(4年),毒性结节性甲状腺肿所占比例较高,平均131I给药剂量较大。除甲状腺癌外,两项研究标准化总癌症死亡率之SMR均接近预期死亡率。其他癌症的SMR均在0.8和1.3之间。在瑞典研究,尽管消化道和呼吸道癌死亡危险增加达到显著性,但危险度仅比预期值增高10%和30%。我们亦发现131I治疗毒性结节性甲状腺肿时,呼吸道癌死亡危险增加。二项研究的差异可能为瑞典研究毒性结节性甲状腺肿比例较高或为偶然性所致。
本研究样本量大而且包括了非131I治疗的患者。与一般人群相比,本列随访期间乳腺癌、肺癌和肾癌的死亡率有所增加,比例虽小但有显著性。本文病例吸烟、生活习惯和生育史不详。这些因素均可混淆结果。由于死亡率增高大多发生在随访头几年,所以未发现的潜在疾病亦可能与之有关。本文采用抗甲状腺药物治疗的患者较少,然而尽管如此,仍有几个部位(总癌、鼻窦、胃、乳腺和脑)实际癌症死亡率高于全国预期死亡率。分析(排除了既往已有癌症的患者)表明在某种程度(不是全部),死亡率增加可能为药物治疗的病例选择所致。药物治疗主要应用硫脲衍生物、碘化物或两者的联合,但有时也使用其他药物。通常用药类型、剂量及用药日期病历并无记录,因此无法对其进行分析。因为本研究有关药物治疗的数据具有明显的局限性,所以对抗甲状腺药物的远期效果仍需进一步评估。
, 百拇医药
本研究虽有优势,但亦有局限性。第一,不能估计甲状腺剂量,放射反应以131I给药量为基础。第二,死亡率不是理想的研究终点。死亡证所列死亡原因常常欠准确,而且很少提及癌症的组织类型。除此之外,有关高存活率癌症(如甲状腺癌、乳腺癌)的资料亦有局限性。第三,仅对约20个部位癌症的潜伏期、甲亢类型、治疗组及131I给药剂量进行了评估。采用多元比较,不正确否决无效假设的概率增加,因此对这些数据的解释仍需谨慎。另一方面,许多亚组病例数及死亡率较小,除甲状腺外,大多数器官接受的放射量均较低,这些均限制了显著性检验的力度。最后,本文治疗方法的选择以患者的健康状况为依据。例如,手术病例比采用药物治疗或131I治疗者患癌(甲状腺癌除外)少,这样比较与治疗的危险度是有问题的。
总之,在随访甲亢患者几达一生的大系列研究中,癌症的死亡率并无明显增加。大剂量治疗性131I及高频度治疗均与总癌症死亡率无关。尽管少数甲状腺癌死亡可能与131I治疗有关,但是总体上看131I治疗是一种安全的疗法。
, 百拇医药
参考文献
1. FurszyferJ, Kuriand LT, McConahey WM, et al. 14. Goldman MB, Maloof F, Monson RR, et al. Rsi 26. Cox DR, Hinkley DV. Theoreticai Statistics.Epidemiologic aspects of Hashimoto's thyroiditis dioactive iodine therapy azid breast cancer. Am i London, Engiand: Chapman k Hall; 1974.and Graves' disease in Rochester, Minnesota, 1935- 1988;127:969-980. 27. Preston DL, LubinJH, Pierce DA. Epicure Us-1967. Metaboiisln. 1972;21:197-204. 15. Hall P,Berg G, Bjelkengren G, et al. Cancer er's Gi`ide. Seattle, Wash: HiroSoft international
, 百拇医药
2. Tunbridge WMG, Evered DD, Hall R, et al. The mortalityafteriodine-131 therapyforhyperthyroid- Corp; 1993.spectrum of thyroid disease in a community: the ism. Int J Cance r. 1992i50:886-890. 28. Williarns ED. Relaiionbetween 131therapyfor
Whickhaznsurvey. ClinEhocirinsi. 1977)7:481-493. 16. Becker DV, McConaheyWM, Dobyns BM, et al. thyrotoxicosis and development ofthyroid carcino-
3. Volp6 R. Graves' disease. In: Burrow GN, Op- The results of radioiodine treatment of hyl)erthy- ma. Lanset. 19862:456-457.penheimerJH, Volpe R, eds. ThgroidFunctionand roidism. In: Fellinger K, H0fer R, eds. Further 29. Hancock BW, Bing RF, DirmiAis SM, etal. Tliy-Insease. Philadelphia, Pa: WB Saunders Co; 1989: Advances in Thyroid Research. Wienna, Austria: roid carcinoma and concurrent hyperthyroidism.214260.
, 百拇医药
4. Klein i, Becker DV, Levey GS. Treatment ofhy 603-609. 30. Ron E, Kleinerman RA, BofceJD, et al. A popu-I)erthyroid disease. Ann Med. i994;121:281- 17. TompkinsE. Late effects ofradiofodinetherapy. lationbased case-control study of thyroid caiicer.288. In: Cloutier RJ, Edwards CL, Snyder WS, eds. J Nati Canser inst. 1987;79:1-12.
5. Saenger EL, Thoma GE, Tompkins EA. Inci- Medicai Radionuciides: Radiation Dose aui Ef 31. Franceschi S, Fassina A, Talamini R, et ai. Risk denceol\eukem\afo\\owtngtreatment fecte. WasKingion, DC: Atomic Energy Commis factorsforthFoidcancer in North ltaly. Int JEpi roidism. JAMA. 1968,205:855-862. sion; 1970:431-440. dsmioi. 1989;18:578-584.
, 百拇医药
6. Dobyns BM. Radiation hazardeexperience with 18. Mani,.ai of tho inte,`nationai Ctassification of 32. Maxon HR, Thomas SR, Saenger EL, et al. Ion therapeutic and diagnostic 131i. In: Ra imtion As inseases, Eighth Reinsion Adriptedfor Use in the izing irradintion and the induction of climcally sig-sociated Carcinoma. New York, NY: UnitedStates. Wasfrington, DC: USDeptofHealth, nificant disease in the human thgroid. Am J Med.Grune h Stratton; 1977:459-483. Education,andWelfare; 1967. PHSpublication 1693. 1977f63:967~969.
, 百拇医药
7. Halnan KE. Risks from redioiodine treatment of 19. Manuai ofthe inte,nationai Statisticai Ciassi- 33. G16bel B, G16bel H, Oberhausen E. Epidemio-thyrotoxicosis. BMJ. 1983;287:8121-8122Wzcati0n of Diseases, Seventh Remeion. Geneva
8. GraliamGD,Bui,nan gn. Radioiodinetreatment Switzeriand: Worid Health Organization; 1957. and therapy. In: ~~~~ A, Neider R, Pensko J, eds.of Graves' disease. Ann intet,i Med. 1986;105: 20. Monson RR. Anaiysis ofrelative survival and Radiation Risk Protection. Cologne, Ger'nany:9bo-905. proportional mortality. Comppt Biomed Res. 1974; Koun; 1989:565568.
, 百拇医药
9. Becker DV. Comparison of iodine-131 therapy 7:325332. 34. Holm LE, Wiklund KE, Lundell GE, et al. Thy-and alternative treatments ofhyperthgroidism. In: ZI.International Commission on Ra(liological Prry roid cancer after diagnostic doses of lodine-131.Nagatndi.S, ed. Radtation and tho Thg,oid. Tokyo, tection. Radiation dose to patients from radiophar- J Nati Cancer inst. 1988;80:11321138.Japan: Excerpta Medica Ltd; 1989:57-67. ryceuticals. Ann ICRP. 1988i18:275278. 35. Holm LE, Hall P, Wiklund K, et al. Cancer risk
, 百拇医药
10. Dobyns BM, Sheline GE, Workman JB, et al. 22. Becker DV, Hurley JR. Rndiofodine treatment afteriodine-131 therapyforhyperthyroidisrn`JNatl Maiiguant arid benign neoplasms of the thyroid in ofhypert,hyrofdism. In: SandlerMA,PattonJA,Cole- Cancer inst. 1991;83:1072-1077.patients treated for hyperthyroidism. J Clin Endo- inan RE, eds. Dzagtzostic Nusiear Medimns. 3ril ed. 36. HaJI P, Holm LE, Lundell G, et ai. Cancerrisks in c,`znst Metab. 1974f38:976-998. Baitimore, Md: Willianis k Wilkins; 1996:943-958. thyroidoocerpatients. BrJCanse r. 1991,4:159-163.
, http://www.100md.com
ll. Hoffman DA, McConahey WM, Diamond EL, 23. L0evinger R, Holt JG, Hine GJ. Internally ad- 37. Hail P, Mattsson AP, Boice JD. Thyroid cancer Kurland LT. Mortality in women treated for hypen ministered radioisotopos. In: Hine GJ, Brownwell after diagnostic administration of iodine-131. Ra-thyroidism. Am J Epz,iemioi. 1982;115:243253. GL,eds.RadiationDosimetry. Newyork, NY: Aca- diat Res. 1996i145:86~92.
12. Goldman MB, Monson RR, Maioof F. Cazicer demic Press Inc; 1956:870. 38. Shore RE. Issues and epidemiological evidence mortality in women with thyroid disease.24. Green M, Fisher M, Miller H, et al. Blood radia- regardingradiation-induced thyroid cancer. Radiat Res. 1990;50:2283-2289. tion dose after iail therapy ofthyrotoxicosis. BMJ. Res. 1992,131:98-111.
, http://www.100md.com
13. Hoffman DA, McConahey Th, Fraumeni JF, 1961il:210-215. 39. Ron E, LubinJH, Shore RE, et al. Thyroid can-Kuriand LT. Cazicer incidence following treatment 25. Zanzonico PB, BeckerDV, Brill AB, etal. Extra- cerfollowingexposure to externalradiation.Radmt of hyperthyroidism. Int J E;,idemioi. 1982;ll:218- ftyroidaiabsorbed dosesintalioiodinetreatment of Res. 1995i141:255-273.224. hyl)erthxroidism. J Nuci Med. 1989;30:833.
I4. Goldman MB, Maloof F, Monson RR, et al. Ra 3 dioactive iodine therapy and breast cazicer. Am J. Epidemiol. 1988i127:969-980.
, 百拇医药
15. Hall P, Berg G, Bjelkengren G, et al. Cancer 3 mortalityafteriodine-131 therapyforhyperthyroid- ism. Int i Cancer. 1992;50:886-890.
16. BeckerDV, McConahey WM, Dobyns BM, et ai.The results of radioiodine treatment of hyperthy-i roidism. In: Fellinger K, H0fer R, eds. Furtha: Advances in ~~~~~~~ Research. Vienna, Austria:Veriage derwiener Medizinischen Akademie, 1971:603-609.
17. Tompkins E. Lateeffectsofradioiodinetherapy.In: Cloutier Xi, Edwards CL, Snyder WS, eds.Medical Railionucizdes: Rndiation Dose and Ef . fects. Washington, DC: Atomic Energy Commis sion; 1970:431-440.
, http://www.100md.com
18. Mannai ofthe interuational Ctassifzcatzon of - Diseases, Eighth Revision Ad`iptedfor Use in the: UnitedStates. Washingion, DC: US DeptofHealth,Education, andWelfare; 1967. PHSpublication 1693.
19. Manual oft}ie inte),z(ztio?i,ai Statistical Classi-fication of Diseases, Seventh Revision. Geneva,5 Switzerland: W0rld Health Organization; 1957.
20. Monson RR. Analysis of relative survival and proportional mortality. Comppt Biomed Res. 1974,z 7:325-332.
, 百拇医药
21. International Commission on Radiological Pro-, tection. Radiation dose to patients from radiophar-maceuticals. Ann ICRP. 1988;18:275278.
22. Becker DV, Huriey JR. Radioiodine treatment i ofhypert,hyroiilism. In:SandlerMA,PattonJA,Cole-nian RE, eds. Diagnsstic Nusiear Mediri?i.e. 3rd ed.Baitimore, Md: Williams k Wilkins; 19be:943-958.
23. Loevinger R, Holt JG, Hine GJ. Internally ad-ministered radioisotopes. In: Hine GJ, Brownwell GL,eds.RadiationDosi?netry. Newyork, NY: Aea demic Press Inci 1956:870.
, http://www.100md.com
24. Green M, Fisher M, Miller H, et al. Blood radia-tion dose after isil therapy ofthyrotoxicosis. BMJ.1961il:210-215.
25. Zanzonico PB, Becker DV, BchlAB,etal. Extra. thyroidai absorbed doses in radioiodine treatment of hyperthyroidism. JNucl Med. 1989,30:833.ll
26. Cox DR, Hinkley DV. Theoretzcal Statistics.London, England: Chapman h Hall, 1974.
27. Preston DL, LubinJH, Pierce DA. Eghci `re Us-er's G uide. Seattle. Wash: HiroSoft international Corp; 1993.
, 百拇医药
28. Williams ED. Relationbetween 131-therapyfor thyrotoxicosis and development ofthyroid carcino-ma. Lanset. 19ed;2:456457.
29. HancockBW, Bing RF, Dirmikis SM, et ai. Thy roid carcinoma and concurrent hyperthyroidism.Cancer 1977,39:298-302.
30. Ron E, Kleinernian RA, BoiceJD, et al. A popu-lation-based case-control study of thyroid caz)cer.J Nati Cancer inst. 1987;79:1-12.
3I. Franceschi S, Fassina A, Talaniiin R, et al. Riskfactors for thyroid cancer in North ltaly. Int J Epi-delnioi. 1989;18:578-584.
, http://www.100md.com
32. Maxon HR, Thomas SR, Saenger EL, et al. Ion-izing irradintion and the induction of climcally sig-mficant disease in the human thyroid. Am J Med.
1977:63:967-969.
33. G16bel B, Globel H, Oberhausen E. Epidemio-logic studies on patients with iodine-131 diagnostic azid therapy. In: Kaul A, Neider R, Pensko J, eds.Radiatzon Risk Protectzon. Cologne, Germany:Koun; 1989:565568.
34. Holm LE, Wiklund KE, Lundell GE, et al. Thy-roid cancer after diagnostic doses of lodine-131.J Natl Cancer inst. 1988:80:11321138.
, http://www.100md.com
35. Holm LE, Hall P, Wiklund K, et al. Cancer risk ederiodine-131 therapyforhyperthyroidism.JNatl Cancer Inst. 1991;83:1072-1077.
36. Hall P, Holm LE, Lundell G, etal. Cancerrisksin thyroidoocerpatients. BrJCance r. 1991;4:159-163.
37. Hall P, Mattsson AP, Boice JD. Thyroid cancer after diagnostic administration of iodine-131. Ra-diat Res. 1996;145:86-92.
38. Shore RE. Issues and epidermological evidence regardingradiation-inducedthgroi cancer. Rndiat Res. 1992:131:98-111.
39. Ron E, Lubin JH, Shore RE, et al. Thyroid can cerfollowingexposure toexternal radiation.Radzat Res. 1995:141:255-273.
王 杉 译 祝学光 校
JAMA 1998;280:347~355, 百拇医药