表达hEGF导入基因的角朊细胞促进体外培养的正常角朊细胞增殖
作者:胡大海 陈璧 汤朝武 刘毅 阎小军 惠宏襄
单位:胡大海(第四军医大学西京医院烧伤外科,陕西 西安 710032);陈璧(第四军医大学西京医院烧伤外科,陕西 西安 710032);汤朝武(第四军医大学西京医院烧伤外科,陕西 西安 710032);刘毅(兰州军区兰州总医院烧伤整形科,甘肃 兰州 730050);阎小军(第四军医大学基础部:全军基因技术诊断研究所,生物化学教研室)
关键词:人表皮细胞生长因子;基因;真核表达质粒;人角朊细胞;增殖
西北国防医学杂志000201 摘要:目的:观察含外源性人表皮细胞生长因子(hEGF)基因改造的角朊细胞(hEGF-MHK),对正常培养的角朊细胞(NHK)增殖的影响;探讨转hEGF基因HK对创面愈合的生物学效应及作用机理。方法:收集含真核表达质粒pcDNA3-hEGF的hEGF-MHK细胞培养上清,采用放射免疫分析法测定收集的上清液中hEGF含量;以10%的浓度加入由正常人皮肤组织分离培养的NHK细胞培养基内;MTT法测定NHK细胞培养15 d内的增殖速率并绘制细胞生长曲线;3H-TdR掺入法测定细胞培养72 h内的DNA合成速率。结果:转基因HK细胞培养上清内含有高水平的免疫活性hEGF,培养7~9 d的测定值为每天约(37.89±4.13~35.79±4.33)μg.L-1, 而正常HK培养上清、转染空载体的HK培养上清内均低于5 μg.L-1;加10%的转基因HK细胞培养上清的NHK增殖明显加快, 较对照组提前4 d以上融合达到生长平台期;转基因HK细胞培养上清作用24 h后可使NHK细胞DNA合成率明显提高。结论:含hEGF基因真核表达质粒的hEGF-MHK细胞具有表达分泌hEGF的功能, 分泌的hEGF可促进NHK细胞生长增殖, 其机理为启动NHK细胞DNA合成;说明hEGF-MHK细胞可借助旁分泌途径刺激正常角朊细胞增生, 提示其活体移植后促进创面利用残余角朊细胞再生修复的潜在应用价值。观察含外源性人表皮细胞生长因子(hEGF)基因改造的角朊细胞(hEGF-MHK),对正常培养的角朊细胞(NHK)增殖的影响;探讨转hEGF基因HK对创面愈合的生物学效应及作用机理。方法:收集含真核表达质粒pcDNA3-hEGF的hEGF-MHK细胞培养上清,采用放射免疫分析法测定收集的上清液中hEGF含量;以10%的浓度加入由正常人皮肤组织分离培养的NHK细胞培养基内;MTT法测定NHK细胞培养15 d内的增殖速率并绘制细胞生长曲线;3H-TdR掺入法测定细胞培养72 h内的DNA合成速率。结果:转基因HK细胞培养上清内含有高水平的免疫活性hEGF,培养7~9 d的测定值为每天约(37.89±4.13~35.79±4.33)μg.L-1, 而正常HK培养上清、转染空载体的HK培养上清内均低于5 μg.L-1;加10%的转基因HK细胞培养上清的NHK增殖明显加快, 较对照组提前4 d以上融合达到生长平台期;转基因HK细胞培养上清作用24 h后可使NHK细胞DNA合成率明显提高。结论:含hEGF基因真核表达质粒的hEGF-MHK细胞具有表达分泌hEGF的功能, 分泌的hEGF可促进NHK细胞生长增殖, 其机理为启动NHK细胞DNA合成;说明hEGF-MHK细胞可借助旁分泌途径刺激正常角朊细胞增生, 提示其活体移植后促进创面利用残余角朊细胞再生修复的潜在应用价值。
, 百拇医药
中图分类号:Q 782 文献标识码:A 文章编号:1007-8622(2000)02-0083-04
Enhancement effects of pcDNA3-hEGF modified human keratinocytes on the proliferation of normal human keratinocytes in vitro
HU Da-hai, CHEN Bi, TANG Chao-wu,et al. (Department of Burn Surgery, Xijing Hospital,The 4th Military Medical University, 710032)
Abstract: Objective: By observation of effects produced by pcDNA3-hEGF modified human keratinocytes (hEGF-MHK) on the proliferation of normal human keratinocytes (NHK), to investigate the biological effects of hEGF-MHK on wound healing.Methods: The supernatants were collected from normal human keratinocytes, pcDNA3-neo and pcDNA3-hEGF modified human keratinocytes cultures and the concentrations of hEGF in the supernatants were measured by radioactive immunoassay. Then 10% of the supernatants were added into the cultivated normal human keratinocytes respectively.Cell proliferation and DNA synthesis rate were determined by MTT assay and 3 H-TdR incorporation.Results: hEGF were about 37.89±4.13 μg.L-1 to 35.79±4.33 μg.L-1 per day in supernatants of hEGF-MHK from day 7 to day 9 after culture. At the same time, less than 5 μg.L-1 per day were detectable in supernatants of NHK and pcDNA3-neo modified human keratinocytes. NHK proliferation was enhanced observably by the addition of 10% of hEGF-MHK supernatant, which could stimulate the DNA synthesis of NHK.Conclusion:hEGF-MHK could secrete active hEGF to enhance NHK proliferation and DNA synthesis. These results demonstrate that hEGF-MHK might promote the wound healing processin vivo.
, http://www.100md.com
Key words: Human epidermal growth factor; Gene; Eukaryotic expression plasmid; Human keratinocyte; Proliferation
自从Rheinwald和Green[1]建立了人角朊细胞(human keratinocyte, HK)体外分离培养方法以来, 人们对角朊细胞进行了大量的基础及临床研究, 实验表明异体移植培养的角朊细胞只能暂时替代性覆盖创面,而自体移植则只适用于有一定真皮尚存的创面,否则将难获得理想的结果[2]。生长因子如EGF、bFGF、TGF、PDGF等参与损伤后组织细胞的增殖、分化、以及基质形成等再生过程,并在某些组织的再生过程中起关键性作用。因此,近年来成为组织修复领域的研究热点之一[3]。临床实验发现,应用生长因子促进创面愈合的效果与能否达到有效的用药浓度及维持药物作用时间具有直接关系,迄今为止,人们尚不能找出理想的办法来解决这些问题,因而阻碍了其临床应用[4]。本研究拟在我们已成功地应用真核表达质粒pcDNA3-hEGF转染体外培养的人角朊细胞,并对其进行纯化及扩大培养,获得了具有分泌hEGF功能的人角朊细胞的基础上,进一步观察该转基因细胞对体外培养的NHK细胞生长增殖的影响,探讨其对创面上皮化可能发挥的生物学效应及作用机理, 为探索hEGF-MHK活体创面移植奠定基础。
, http://www.100md.com
1 材料和方法
1.1 HK细胞培养上清的收集:①复苏冻存的正常HK、转染pcDNA3-noe, pcDNA3-hbFGF的HK细胞(本实验室组织库保存);②以3×105cells/瓶接种于3.5 cm×6.5 cm大小的培养瓶, 每种HK细胞各接种3瓶,用K-SFM/PBE(30 mg.L-1)+ rEGF (0.2 μg.L-1) (Gibco) 4 ml/瓶, 培养24 h;③用不含BPE及rEGF的K-SFM换液,3 d一次,连续培养;④于第6 天换液后, 分别收集第7、8、9天时换液上清,置于-40℃保存待用。
1.2 放射免疫分析测定: 取部分收集冻存的HK培养上清, 按hEGF放射免疫分析测定Kit(北京北方生物技术研究所)的操作说明, 对HK培养上清内hEGF含量进行测定。
, 百拇医药
1.3 NHK增殖实验: NHK来源同前, 扩大培养至细胞达到95%融合时应用。①胰酶消化传代, 调整细胞悬液浓度为1.5×104cells.ml-1,以100 μl/孔接种于96孔板, K-SFM完全培养基培养24 h换液, 用不含添加成分的K-SFM再培养48 h;②用K-SFM(不含BPE及rEGF)配制含10%不同HK培养上清的培养基;③吸弃96孔板内培养基,加入②配制的培养基,每种培养基重复8孔、100 μl/孔,置CO2孵箱内培养, 隔日换液, 各孔所用换液培养基成分保持不变;④于培养后1, 3, 5, 7, 9, 11, 13, 15天分别采用MTT比色法测定NHK细胞的增殖量, 并绘制细胞生长曲线。
1.4 MTT比色测定方法:于不同测定时间点,向待测的96孔板内的培养细胞加0.5%MTT(Sigma)溶液, 每孔20 μl,37℃孵育4 h后,吸弃培养基; 每孔加100 μl纯二甲基亚砜, 彻底溶解细胞内的蓝色甲 (formazan),于570 nm波长下测定吸光值A,并用A值代表细胞增殖量。
(formazan),于570 nm波长下测定吸光值A,并用A值代表细胞增殖量。
, 百拇医药
1.5 NHK的DNA合成率测定:①细胞准备及所加HK培养上清方法均同前;②于加入HK培养上清后12, 24, 48 h分别测定3H-TdR掺入量。 相应各处理组的NHK培养细胞, 每孔加18.5 kBq(体积20 μl)的3H-TdR(北京中国原子能科学研究所),继续培养12 h吸去培养基,胰酶消化,收集细胞于999型纤维膜上,红外线烤干后加闪烁液,LS-6500型闪烁仪(Beckman)计数cpm值。
1.6 统计学方法:数据处理采用第四军医大学统计学教研室开发的SPLM医用统计软件包进行方差分析。
2 结果
2.1 HK培养上清hEGF含量:放射免疫分析结果显示, 转基因hEGF-MHK培养上清 (HKPES) 组,可于细胞培养后的第7、8、9天检测到高水平的hEGF,分别为37.89±4.13,36.89±2.61,35.79±4.33 μg.L-1;正常HK培养上清(NHKS)组及转染空载体HK培养上清(HKPOS)组检测到的hEGF均低于5 μg.L-1(图1)。
, http://www.100md.com
图1 HK培养上清hEGF含量放射免疫测定
2.2 转基因hEGF-MHK培养上清对NHK生长曲线的影响:与加10%NHKS组、10% HKPOS组相比,加10%HKPES组的NHK培养3天后, 生长速度明显加快, 且于培养后11天时达到生长平台期;在15天的实验观察时间内加NHKS及HKPOS的NHK培养生长均未达到生长平台期(图2)。在应用MTT法测定NHK增殖量的过程中,采用以往报道过的方法[5], 对细胞形态进行了观察;具体观察结果为:加入5%MTT后20 min,镜下可见细胞内由线粒体脱氢酶还原后蓝色甲月 赞形成,因而细胞形态更易于观察,可见加HKPES培养3天后的NHK密度增加较加NHKS及HKPOS迅速;至11天时HKPES组的NHK细胞已完全融合,细胞形态良好, 外观呈典型的鹅卵石状角朊细胞紧密排列,而相同观察点加NHKS及HKPOS组的NHK细胞大小相差较大,示分化程度不均,细胞仅部分散在融合, 融合区细胞之间存在比较大的空隙(图3,4)。
, 百拇医药
图2 HK培养上清对NHK生长曲线的影响(MTT测定法)
图3 加正常HK细胞培养上清的NHK培养11天后
生长情况,MTT染色 (×200)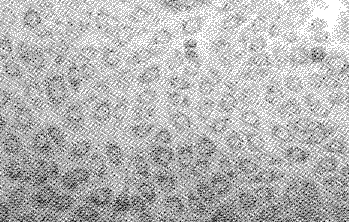
图4 加转基因hEGF-MHK细胞培养上清的NHK培养
11天后生长情况,MTT染色 (×200)
2.3 转基因hEGF-MHK培养上清对NHK细胞DNA合成的影响:加入10% 的NHKS、 HKPOS和HKPES的NHK培养12 h时, 各组之间NHK细胞DNA合成速度相互比较无显著性差别(P>0.05); 培养24及48 h时HKPES组与NHKS组、HKPOS组相比,NHK细胞DNA合成率分别增加了(54.96±8.80)%、(52.98±9.76)%及(35.94±6.66)%、(54.32±5.89)%, 统计学比较均为P<0.01(图5)。说明转基因hEGF-MHK细胞培养上清作用24 h后,可以启动并促进NHK细胞的DNA合成。
, 百拇医药
图5 HK培养上清对NHK DNA合成的影响
注:P<0.01, 与NHKS或HKPOS组相比
3 讨论
本项研究首先经放射免疫测定表明hEGF-MHK培养上清中含有高水平的免疫活性hEGF, 其含量与我们另外实验获得的测定值相类似[6]。实验进一步显示应用这种基因改造过的细胞培养上清尚可明显刺激NHK增殖, 提示其分泌的hEGF具有生物活性, 同时说明hEGF-MHK移植创面后潜在的旁分泌功能。
现代医学的进步使复苏技术及其它全身支持治疗达到了相当高的水平,因此,在病程的早期挽救了很多大面积严重烧伤患者的生命,同时使烧伤临床治疗的进一步提高面临着新的疑难问题有待解决,其中最重要的问题之一是如何尽快有效地覆盖修复皮肤广泛缺损的创面,这对保证早期全身生命支持治疗的巩固及提高烧伤患者创面愈合后功能和外形的恢复起决定性作用[9]。综合分析严重烧伤皮肤创面存在面积大、自体可供移植的皮源受限的特点,以及近年来创面愈合领域有关的细胞生物学、分子生物学、再生生物学、组织工程学、多肽生长因子的研究进展及部分临床应用所面临的问题,我们认为利用少量的人表皮最主要的修复细胞角朊细胞,于体外经改造导入与创面再生修复关系密切的生长因子基因,使细胞获得主动分泌目的基因蛋白的功能,再将细胞扩大培养后以适当的形式移植于创面的治疗策略为一条非常值得探索的途径,希望由此达到既覆盖创面,同时依靠移植后的细胞分泌特定的目的蛋白发挥启动促进创面潜在的皮肤再生修复过程的作用。
, 百拇医药
本实验应用MTT比色法观察到加入10% 的hEGF-MHK培养上清后, 与对照组相比NHK可提前至少4 d达到生长平台期, 此时镜下观察NHK已完全融合。角朊细胞的生长融合为皮肤创面修复过程中上皮化所必须的。细胞及分子水平的研究表明, 皮肤创面愈合过程中修复细胞的行为受到细胞内外的各种信号的调控, 同时每一种细胞又以一定的信号调节方式影响着其它细胞的变化。同强调尽早促进创面上皮化, 以减少瘢痕形成提高皮肤修复质量的临床治疗经验原则相一致, 有实验显示角朊细胞可抑制成纤维细胞胶原蛋白的合成, 因此发挥控制瘢痕过度形成保证皮肤修复趋于正常化的作用[7] 。我们在该实验中观察到hEGF-MHK体外具有促进正常角朊细胞增殖的生物学效应, 这对进一步探讨其应用于包括深二度烧伤创面切痂后等活体移植, 从而获得覆盖创面并促进残余角朊细胞再生修复, 同时减少瘢痕形成的治疗途径奠定了基础。
大面积深度烧伤的另一个难题是三度创面的修复。皮肤组织工程为解决该课题提供了新的探索途径。Eming等[8]将经逆转录病毒载体MFG-PDGF-A(含人血小板源性生长因子-A基因序列)改造的人角朊细胞用于皮肤组织工程研究。其方法为把改造的角朊细胞种植于去细胞的真皮表面制成复合皮,然后移植于动物全层皮肤缺损创面,发现这种复合皮在移植后早期的关键几天内迅速出现纤维血管细胞并伴随有新生基质形成,其覆盖的皮肤创面修复质量较对照组明显提高;放射免疫测定显示复合皮内含有高水平的PDGF-AA。Sheridan等[9]最近在分析未来复合皮的研制发展方向中指出, 对体外经生长因子基因改造的细胞的研究与应用为一条富有希望的探索方向。我们正在积极进行hEGF-MHK应用于复合皮研制方面的相关工作, 大量的研究探讨尚待深入。
, 百拇医药
本研究中, 在观察到hEGF-MHK培养上清对NHK细胞整体数量增殖呈现明显促进的基础上, 应用 3 H-TdR掺入法进一步观察了启动NHK的DNA合成代谢的作用。可见hEGF-MHK培养上清对NHK作用24 h后, 使NHK的DNA合成明显加快; 提示hEGF-MHK具有启动NHK的DNA合成效应, 并由此发挥促进角朊细胞再生加速上皮化作用。
总之, 本研究测定分析了导入hEGF基因的角朊细胞对正常皮肤角朊细胞的生物学效应, 体外实验肯定了hEGF基因改造的角朊细胞具有分泌hEGF及促进正常皮肤角朊细胞生长增殖的作用。理论上推断,该基因改造的细胞在活体创面上移植生长后,具有潜在的持续释放hEGF的功能; 这将非常有助于创面间质内维持较高浓度的hEGF,从而达到有效地激活启动受体角朊细胞等靶细胞的增殖。本项研究结果为确定进一步活体创面实验观察提供了依据。
基金项目:国家自然科学基金资助项目(39600153)
, 百拇医药
作者简介:胡大海(1963—),男,博士,主治医师
惠宏襄(第四军医大学基础部:全军基因技术诊断研究所,生物化学教研室)
参考文献:
[1]Rheinwald JG, Green H. Serial cultivation of strains of human epidermal keratinocytes: the formation of keratinizing colonies from single cells[J]. Cell, 1975,6.(Nov):331-344.
[2]Phillips TJ. Keratinocyte grafts for wound healing[J]. Clin Dermatol, 1994,12(2):171-181.
, 百拇医药
[3]Lawrence WT,Diegelmann RF. Growth factors in wound healing[J].Clin Dermatol, 1994,12(2):157-169.
[4]Tchorzewski MT, Duncan MD, Nass P, et al. Characterization of an aFGF gene expression vector with therapeutic potential[J]. J Surg Res, 1998,77(2):99-103.
[5]胡大海, Hughes MA, 陈 璧, 等. 应用MTT法观察人皮肤培养细胞的形态学特征[J]. 第四军医大学学报, 1999, 20(11):1009-1012.
[6]胡大海, 陈 璧, 陈 军, 等. hEGF cDNA导入培养的人角朊细胞及其表达[J]. 第四军医大学学报, 2000; 21(待刊出)
, http://www.100md.com
[7]Garner WL. Epidermal regulation of dermal fibroblast activity[J]. Plast Reconstr Surg, 1998,102(1):135-139.
[8]Eming SA, Medalie DA, Tompkins RG,et al. Genetically modified human keratinocytes overexpressing PDGF-A enhance the performance of a composite skin graft[J]. Hum Gene Ther, 1998,9(4):529-539.
[9]Sheridan RL, Tompkins RG. Skin substitutes in Burns[J]. Burns, 1999,25(2): 97-103.
收稿日期:2000-01-26, http://www.100md.com
单位:胡大海(第四军医大学西京医院烧伤外科,陕西 西安 710032);陈璧(第四军医大学西京医院烧伤外科,陕西 西安 710032);汤朝武(第四军医大学西京医院烧伤外科,陕西 西安 710032);刘毅(兰州军区兰州总医院烧伤整形科,甘肃 兰州 730050);阎小军(第四军医大学基础部:全军基因技术诊断研究所,生物化学教研室)
关键词:人表皮细胞生长因子;基因;真核表达质粒;人角朊细胞;增殖
西北国防医学杂志000201 摘要:目的:观察含外源性人表皮细胞生长因子(hEGF)基因改造的角朊细胞(hEGF-MHK),对正常培养的角朊细胞(NHK)增殖的影响;探讨转hEGF基因HK对创面愈合的生物学效应及作用机理。方法:收集含真核表达质粒pcDNA3-hEGF的hEGF-MHK细胞培养上清,采用放射免疫分析法测定收集的上清液中hEGF含量;以10%的浓度加入由正常人皮肤组织分离培养的NHK细胞培养基内;MTT法测定NHK细胞培养15 d内的增殖速率并绘制细胞生长曲线;3H-TdR掺入法测定细胞培养72 h内的DNA合成速率。结果:转基因HK细胞培养上清内含有高水平的免疫活性hEGF,培养7~9 d的测定值为每天约(37.89±4.13~35.79±4.33)μg.L-1, 而正常HK培养上清、转染空载体的HK培养上清内均低于5 μg.L-1;加10%的转基因HK细胞培养上清的NHK增殖明显加快, 较对照组提前4 d以上融合达到生长平台期;转基因HK细胞培养上清作用24 h后可使NHK细胞DNA合成率明显提高。结论:含hEGF基因真核表达质粒的hEGF-MHK细胞具有表达分泌hEGF的功能, 分泌的hEGF可促进NHK细胞生长增殖, 其机理为启动NHK细胞DNA合成;说明hEGF-MHK细胞可借助旁分泌途径刺激正常角朊细胞增生, 提示其活体移植后促进创面利用残余角朊细胞再生修复的潜在应用价值。观察含外源性人表皮细胞生长因子(hEGF)基因改造的角朊细胞(hEGF-MHK),对正常培养的角朊细胞(NHK)增殖的影响;探讨转hEGF基因HK对创面愈合的生物学效应及作用机理。方法:收集含真核表达质粒pcDNA3-hEGF的hEGF-MHK细胞培养上清,采用放射免疫分析法测定收集的上清液中hEGF含量;以10%的浓度加入由正常人皮肤组织分离培养的NHK细胞培养基内;MTT法测定NHK细胞培养15 d内的增殖速率并绘制细胞生长曲线;3H-TdR掺入法测定细胞培养72 h内的DNA合成速率。结果:转基因HK细胞培养上清内含有高水平的免疫活性hEGF,培养7~9 d的测定值为每天约(37.89±4.13~35.79±4.33)μg.L-1, 而正常HK培养上清、转染空载体的HK培养上清内均低于5 μg.L-1;加10%的转基因HK细胞培养上清的NHK增殖明显加快, 较对照组提前4 d以上融合达到生长平台期;转基因HK细胞培养上清作用24 h后可使NHK细胞DNA合成率明显提高。结论:含hEGF基因真核表达质粒的hEGF-MHK细胞具有表达分泌hEGF的功能, 分泌的hEGF可促进NHK细胞生长增殖, 其机理为启动NHK细胞DNA合成;说明hEGF-MHK细胞可借助旁分泌途径刺激正常角朊细胞增生, 提示其活体移植后促进创面利用残余角朊细胞再生修复的潜在应用价值。
, 百拇医药
中图分类号:Q 782 文献标识码:A 文章编号:1007-8622(2000)02-0083-04
Enhancement effects of pcDNA3-hEGF modified human keratinocytes on the proliferation of normal human keratinocytes in vitro
HU Da-hai, CHEN Bi, TANG Chao-wu,et al. (Department of Burn Surgery, Xijing Hospital,The 4th Military Medical University, 710032)
Abstract: Objective: By observation of effects produced by pcDNA3-hEGF modified human keratinocytes (hEGF-MHK) on the proliferation of normal human keratinocytes (NHK), to investigate the biological effects of hEGF-MHK on wound healing.Methods: The supernatants were collected from normal human keratinocytes, pcDNA3-neo and pcDNA3-hEGF modified human keratinocytes cultures and the concentrations of hEGF in the supernatants were measured by radioactive immunoassay. Then 10% of the supernatants were added into the cultivated normal human keratinocytes respectively.Cell proliferation and DNA synthesis rate were determined by MTT assay and 3 H-TdR incorporation.Results: hEGF were about 37.89±4.13 μg.L-1 to 35.79±4.33 μg.L-1 per day in supernatants of hEGF-MHK from day 7 to day 9 after culture. At the same time, less than 5 μg.L-1 per day were detectable in supernatants of NHK and pcDNA3-neo modified human keratinocytes. NHK proliferation was enhanced observably by the addition of 10% of hEGF-MHK supernatant, which could stimulate the DNA synthesis of NHK.Conclusion:hEGF-MHK could secrete active hEGF to enhance NHK proliferation and DNA synthesis. These results demonstrate that hEGF-MHK might promote the wound healing processin vivo.
, http://www.100md.com
Key words: Human epidermal growth factor; Gene; Eukaryotic expression plasmid; Human keratinocyte; Proliferation
自从Rheinwald和Green[1]建立了人角朊细胞(human keratinocyte, HK)体外分离培养方法以来, 人们对角朊细胞进行了大量的基础及临床研究, 实验表明异体移植培养的角朊细胞只能暂时替代性覆盖创面,而自体移植则只适用于有一定真皮尚存的创面,否则将难获得理想的结果[2]。生长因子如EGF、bFGF、TGF、PDGF等参与损伤后组织细胞的增殖、分化、以及基质形成等再生过程,并在某些组织的再生过程中起关键性作用。因此,近年来成为组织修复领域的研究热点之一[3]。临床实验发现,应用生长因子促进创面愈合的效果与能否达到有效的用药浓度及维持药物作用时间具有直接关系,迄今为止,人们尚不能找出理想的办法来解决这些问题,因而阻碍了其临床应用[4]。本研究拟在我们已成功地应用真核表达质粒pcDNA3-hEGF转染体外培养的人角朊细胞,并对其进行纯化及扩大培养,获得了具有分泌hEGF功能的人角朊细胞的基础上,进一步观察该转基因细胞对体外培养的NHK细胞生长增殖的影响,探讨其对创面上皮化可能发挥的生物学效应及作用机理, 为探索hEGF-MHK活体创面移植奠定基础。
, http://www.100md.com
1 材料和方法
1.1 HK细胞培养上清的收集:①复苏冻存的正常HK、转染pcDNA3-noe, pcDNA3-hbFGF的HK细胞(本实验室组织库保存);②以3×105cells/瓶接种于3.5 cm×6.5 cm大小的培养瓶, 每种HK细胞各接种3瓶,用K-SFM/PBE(30 mg.L-1)+ rEGF (0.2 μg.L-1) (Gibco) 4 ml/瓶, 培养24 h;③用不含BPE及rEGF的K-SFM换液,3 d一次,连续培养;④于第6 天换液后, 分别收集第7、8、9天时换液上清,置于-40℃保存待用。
1.2 放射免疫分析测定: 取部分收集冻存的HK培养上清, 按hEGF放射免疫分析测定Kit(北京北方生物技术研究所)的操作说明, 对HK培养上清内hEGF含量进行测定。
, 百拇医药
1.3 NHK增殖实验: NHK来源同前, 扩大培养至细胞达到95%融合时应用。①胰酶消化传代, 调整细胞悬液浓度为1.5×104cells.ml-1,以100 μl/孔接种于96孔板, K-SFM完全培养基培养24 h换液, 用不含添加成分的K-SFM再培养48 h;②用K-SFM(不含BPE及rEGF)配制含10%不同HK培养上清的培养基;③吸弃96孔板内培养基,加入②配制的培养基,每种培养基重复8孔、100 μl/孔,置CO2孵箱内培养, 隔日换液, 各孔所用换液培养基成分保持不变;④于培养后1, 3, 5, 7, 9, 11, 13, 15天分别采用MTT比色法测定NHK细胞的增殖量, 并绘制细胞生长曲线。
1.4 MTT比色测定方法:于不同测定时间点,向待测的96孔板内的培养细胞加0.5%MTT(Sigma)溶液, 每孔20 μl,37℃孵育4 h后,吸弃培养基; 每孔加100 μl纯二甲基亚砜, 彻底溶解细胞内的蓝色甲
 (formazan),于570 nm波长下测定吸光值A,并用A值代表细胞增殖量。
(formazan),于570 nm波长下测定吸光值A,并用A值代表细胞增殖量。, 百拇医药
1.5 NHK的DNA合成率测定:①细胞准备及所加HK培养上清方法均同前;②于加入HK培养上清后12, 24, 48 h分别测定3H-TdR掺入量。 相应各处理组的NHK培养细胞, 每孔加18.5 kBq(体积20 μl)的3H-TdR(北京中国原子能科学研究所),继续培养12 h吸去培养基,胰酶消化,收集细胞于999型纤维膜上,红外线烤干后加闪烁液,LS-6500型闪烁仪(Beckman)计数cpm值。
1.6 统计学方法:数据处理采用第四军医大学统计学教研室开发的SPLM医用统计软件包进行方差分析。
2 结果
2.1 HK培养上清hEGF含量:放射免疫分析结果显示, 转基因hEGF-MHK培养上清 (HKPES) 组,可于细胞培养后的第7、8、9天检测到高水平的hEGF,分别为37.89±4.13,36.89±2.61,35.79±4.33 μg.L-1;正常HK培养上清(NHKS)组及转染空载体HK培养上清(HKPOS)组检测到的hEGF均低于5 μg.L-1(图1)。

, http://www.100md.com
图1 HK培养上清hEGF含量放射免疫测定
2.2 转基因hEGF-MHK培养上清对NHK生长曲线的影响:与加10%NHKS组、10% HKPOS组相比,加10%HKPES组的NHK培养3天后, 生长速度明显加快, 且于培养后11天时达到生长平台期;在15天的实验观察时间内加NHKS及HKPOS的NHK培养生长均未达到生长平台期(图2)。在应用MTT法测定NHK增殖量的过程中,采用以往报道过的方法[5], 对细胞形态进行了观察;具体观察结果为:加入5%MTT后20 min,镜下可见细胞内由线粒体脱氢酶还原后蓝色甲月 赞形成,因而细胞形态更易于观察,可见加HKPES培养3天后的NHK密度增加较加NHKS及HKPOS迅速;至11天时HKPES组的NHK细胞已完全融合,细胞形态良好, 外观呈典型的鹅卵石状角朊细胞紧密排列,而相同观察点加NHKS及HKPOS组的NHK细胞大小相差较大,示分化程度不均,细胞仅部分散在融合, 融合区细胞之间存在比较大的空隙(图3,4)。

, 百拇医药
图2 HK培养上清对NHK生长曲线的影响(MTT测定法)

图3 加正常HK细胞培养上清的NHK培养11天后
生长情况,MTT染色 (×200)

图4 加转基因hEGF-MHK细胞培养上清的NHK培养
11天后生长情况,MTT染色 (×200)
2.3 转基因hEGF-MHK培养上清对NHK细胞DNA合成的影响:加入10% 的NHKS、 HKPOS和HKPES的NHK培养12 h时, 各组之间NHK细胞DNA合成速度相互比较无显著性差别(P>0.05); 培养24及48 h时HKPES组与NHKS组、HKPOS组相比,NHK细胞DNA合成率分别增加了(54.96±8.80)%、(52.98±9.76)%及(35.94±6.66)%、(54.32±5.89)%, 统计学比较均为P<0.01(图5)。说明转基因hEGF-MHK细胞培养上清作用24 h后,可以启动并促进NHK细胞的DNA合成。

, 百拇医药
图5 HK培养上清对NHK DNA合成的影响
注:P<0.01, 与NHKS或HKPOS组相比
3 讨论
本项研究首先经放射免疫测定表明hEGF-MHK培养上清中含有高水平的免疫活性hEGF, 其含量与我们另外实验获得的测定值相类似[6]。实验进一步显示应用这种基因改造过的细胞培养上清尚可明显刺激NHK增殖, 提示其分泌的hEGF具有生物活性, 同时说明hEGF-MHK移植创面后潜在的旁分泌功能。
现代医学的进步使复苏技术及其它全身支持治疗达到了相当高的水平,因此,在病程的早期挽救了很多大面积严重烧伤患者的生命,同时使烧伤临床治疗的进一步提高面临着新的疑难问题有待解决,其中最重要的问题之一是如何尽快有效地覆盖修复皮肤广泛缺损的创面,这对保证早期全身生命支持治疗的巩固及提高烧伤患者创面愈合后功能和外形的恢复起决定性作用[9]。综合分析严重烧伤皮肤创面存在面积大、自体可供移植的皮源受限的特点,以及近年来创面愈合领域有关的细胞生物学、分子生物学、再生生物学、组织工程学、多肽生长因子的研究进展及部分临床应用所面临的问题,我们认为利用少量的人表皮最主要的修复细胞角朊细胞,于体外经改造导入与创面再生修复关系密切的生长因子基因,使细胞获得主动分泌目的基因蛋白的功能,再将细胞扩大培养后以适当的形式移植于创面的治疗策略为一条非常值得探索的途径,希望由此达到既覆盖创面,同时依靠移植后的细胞分泌特定的目的蛋白发挥启动促进创面潜在的皮肤再生修复过程的作用。
, 百拇医药
本实验应用MTT比色法观察到加入10% 的hEGF-MHK培养上清后, 与对照组相比NHK可提前至少4 d达到生长平台期, 此时镜下观察NHK已完全融合。角朊细胞的生长融合为皮肤创面修复过程中上皮化所必须的。细胞及分子水平的研究表明, 皮肤创面愈合过程中修复细胞的行为受到细胞内外的各种信号的调控, 同时每一种细胞又以一定的信号调节方式影响着其它细胞的变化。同强调尽早促进创面上皮化, 以减少瘢痕形成提高皮肤修复质量的临床治疗经验原则相一致, 有实验显示角朊细胞可抑制成纤维细胞胶原蛋白的合成, 因此发挥控制瘢痕过度形成保证皮肤修复趋于正常化的作用[7] 。我们在该实验中观察到hEGF-MHK体外具有促进正常角朊细胞增殖的生物学效应, 这对进一步探讨其应用于包括深二度烧伤创面切痂后等活体移植, 从而获得覆盖创面并促进残余角朊细胞再生修复, 同时减少瘢痕形成的治疗途径奠定了基础。
大面积深度烧伤的另一个难题是三度创面的修复。皮肤组织工程为解决该课题提供了新的探索途径。Eming等[8]将经逆转录病毒载体MFG-PDGF-A(含人血小板源性生长因子-A基因序列)改造的人角朊细胞用于皮肤组织工程研究。其方法为把改造的角朊细胞种植于去细胞的真皮表面制成复合皮,然后移植于动物全层皮肤缺损创面,发现这种复合皮在移植后早期的关键几天内迅速出现纤维血管细胞并伴随有新生基质形成,其覆盖的皮肤创面修复质量较对照组明显提高;放射免疫测定显示复合皮内含有高水平的PDGF-AA。Sheridan等[9]最近在分析未来复合皮的研制发展方向中指出, 对体外经生长因子基因改造的细胞的研究与应用为一条富有希望的探索方向。我们正在积极进行hEGF-MHK应用于复合皮研制方面的相关工作, 大量的研究探讨尚待深入。
, 百拇医药
本研究中, 在观察到hEGF-MHK培养上清对NHK细胞整体数量增殖呈现明显促进的基础上, 应用 3 H-TdR掺入法进一步观察了启动NHK的DNA合成代谢的作用。可见hEGF-MHK培养上清对NHK作用24 h后, 使NHK的DNA合成明显加快; 提示hEGF-MHK具有启动NHK的DNA合成效应, 并由此发挥促进角朊细胞再生加速上皮化作用。
总之, 本研究测定分析了导入hEGF基因的角朊细胞对正常皮肤角朊细胞的生物学效应, 体外实验肯定了hEGF基因改造的角朊细胞具有分泌hEGF及促进正常皮肤角朊细胞生长增殖的作用。理论上推断,该基因改造的细胞在活体创面上移植生长后,具有潜在的持续释放hEGF的功能; 这将非常有助于创面间质内维持较高浓度的hEGF,从而达到有效地激活启动受体角朊细胞等靶细胞的增殖。本项研究结果为确定进一步活体创面实验观察提供了依据。
基金项目:国家自然科学基金资助项目(39600153)
, 百拇医药
作者简介:胡大海(1963—),男,博士,主治医师
惠宏襄(第四军医大学基础部:全军基因技术诊断研究所,生物化学教研室)
参考文献:
[1]Rheinwald JG, Green H. Serial cultivation of strains of human epidermal keratinocytes: the formation of keratinizing colonies from single cells[J]. Cell, 1975,6.(Nov):331-344.
[2]Phillips TJ. Keratinocyte grafts for wound healing[J]. Clin Dermatol, 1994,12(2):171-181.
, 百拇医药
[3]Lawrence WT,Diegelmann RF. Growth factors in wound healing[J].Clin Dermatol, 1994,12(2):157-169.
[4]Tchorzewski MT, Duncan MD, Nass P, et al. Characterization of an aFGF gene expression vector with therapeutic potential[J]. J Surg Res, 1998,77(2):99-103.
[5]胡大海, Hughes MA, 陈 璧, 等. 应用MTT法观察人皮肤培养细胞的形态学特征[J]. 第四军医大学学报, 1999, 20(11):1009-1012.
[6]胡大海, 陈 璧, 陈 军, 等. hEGF cDNA导入培养的人角朊细胞及其表达[J]. 第四军医大学学报, 2000; 21(待刊出)
, http://www.100md.com
[7]Garner WL. Epidermal regulation of dermal fibroblast activity[J]. Plast Reconstr Surg, 1998,102(1):135-139.
[8]Eming SA, Medalie DA, Tompkins RG,et al. Genetically modified human keratinocytes overexpressing PDGF-A enhance the performance of a composite skin graft[J]. Hum Gene Ther, 1998,9(4):529-539.
[9]Sheridan RL, Tompkins RG. Skin substitutes in Burns[J]. Burns, 1999,25(2): 97-103.
收稿日期:2000-01-26, http://www.100md.com