表皮生长因子对类风湿关节炎滑膜细胞的作用
作者:燕太强 吕厚山 药立波 孙铁铮
单位:燕太强(100044 北京大学人民医院关节病研究所);吕厚山(100044 北京大学人民医院关节病研究所);药立波(第四军医大学生化及分子生物学教研室);孙铁铮(100044 北京大学人民医院关节病研究所)
关键词:表皮生长因子尿抑胃素;关节炎,类风湿;滑膜;成纤维细胞;有丝分裂原;蛋白激酶类
中华风湿病学杂志000504 【摘 要】 目的 观察表皮生长因子(EGF)对类风湿关节炎(RA)滑膜细胞的作用和细胞中有丝分裂素激活的蛋白激酶(MAPK)的激活情况。方法 3~5代体外培养的RA滑膜细胞,3H-TdR掺入检测EGF对细胞DNA合成的影响;EGF刺激后裂解细胞,收获蛋白,Western blot检测MAPK的活化。结果 EGF刺激组和对照组每分钟计数值差异有显著性(P<0.001)。EGF能引起细胞内明显MAPK活化。结论 MAPK可能是EGF刺激RA滑膜细胞增生的信号传导通路中的重要介质。
, http://www.100md.com
Effect of epidermal growth factor on rheumatoid synovial fibroblasts
YAN Taiqiang,LÜ Houshan,YAO Libo,et al.
(Arthritis Research Center,People′s,Hospital,Beijing University,Beijiing 100044,China.)
【Abstract】 Objective To determine whether EGF affects DNA synthesis and activates intracellular MAPK in rheumatoid synovial fibroblasts.Methods Cultured rheumatoid synovial fibroblasts were stimulated with exogenous EGF,then investigated 3H-TdR incorporation;and Western blot analysis of cell lysates.Results The incorporation of 3H-TdR was significantly increased upon EGF treatment,meanwhile,immunoblotting revealed that MAPK phosphorylation was greatly increased.Conclusion MAPK is likely to recepter an important component in the cascade of signals that link EGF receptor to EGF eliciting the cellular proliferative response in rheumatoid synovial fibroblasts.
, 百拇医药
【Key words】 Epidermal growth factor-urogastone; Arthritis,rheumatoid; Synovial membrane; Fibroblasts; Mitogen; Protein kinases
表皮生长因子(EGF)能刺激多种组织和细胞类型的分裂、增生或分化[1],在RA滑膜组织中EGF高表达[2]。但是,有关EGF作用于RA滑膜细胞后,细胞中的信号传导途径以及相关信号传导分子的活性变化未见有报道。
1 材料与方法
1.1 材料
1.1.1 主要试剂:DMEM培养基(Gibco公司产品),EGF(300 μg/ml,北京经科生物制品公司),3H-TdR(中国科学院原子能研究所),去污剂蛋白定量试剂盒(Bio-Rad)、ECL Western bolt发光试剂(Amersham公司产品)。
, 百拇医药
1.1.2 抗体:三种抗活化型MAPK(ERK、JNK、p38)多克隆抗体(Promega,USA)、三种抗非活化型MAPK、CERK、JNK、p38)多克隆抗体(Promega,USA)、辣根过氧化物酶偶联驴或羊抗兔lgG。
1.2 方法
1.2.1 RA滑膜细胞的体外培养:20例RA病人均符合1987年美国风湿病协会(ARA)诊断标准[3]。其中男4例,女16例,年龄平均46.5岁(20~75岁),病程平均17.5年(3~47年)。滑膜切除5例,全膝关节置换15例。无菌获取滑膜组织,尽量剔除脂肪及纤维组织,PBS清洗两遍,剪成约1 mm3的碎块,置于无菌瓶内,用0.5 mg/ml的胶原酶Ⅰ消化4~5 h,200目纱网过滤后,离心2次,去除脂肪及杂质。加入DMEM培养液(含20%胎牛血清,20 mmol/L HEPES,2 mmol/L L-谷氨酰胺,100 U/ml青霉素,100 μg/ml链霉素),分装于培养瓶内,置于37 ℃、5%CO2孵箱内培养24 h时后,弃除非贴壁细胞,更换培养液,待滑膜细胞基本长满后,消化传代,实验用3~5代细胞。
, 百拇医药
1.2.2 3H-TdR掺入法检测RA滑膜细胞中DNA的合成:3~5代细胞以每孔1×104种植于96孔板内。培养24 h后,更换无血清DMEM培养液静息24 h。然后换为实验培养液(对照及EGF 0.01~1 000 ng/ml 6个浓度梯度,各设4个复孔),继续培养48 h。细胞收集前18 h加入37 kBq/L 3H-TdR,培养结束后吸出孔内培养液,用PBS洗3遍,加入胰蛋白酶消化液终止。用多头细胞收集器将细胞收集于玻璃纤维滤膜上,晾干后,将装有玻璃纤维滤膜的闪烁瓶中加入闪烁液,用1410液体闪烁计数器测定每份样品每分钟计数。
1.2.3 EGF刺激RA滑膜细胞后蛋白的收集:直径为60 mm的培养皿中3~5代的滑膜细胞约90%长满时,吸除培养液,换用5 ml无血清DMEM培养液静息24 h,EGF(10 ng/ml)刺激滑膜细胞5 min后,预冷PBS冲洗3遍,加入单去污剂裂解液(50 mmol/L Tris*Cl pH 8.0,150 mmol/L NaCl,0.02%叠氮钠,100 μg/ml PMSF,5 μg/ml aprotinin,10 mmol/L矾酸钠,2 mmol/L EDTA,1% Triton X-100)100 μl,置于冰盒上20 min后,细胞刮仔细收集裂解的细胞,置于0.5 ml的EP管中,涡旋2次,置于冰盒中静止15 min,离心15 000 r/min,10 min,将上清移至新EP管中。
, http://www.100md.com
1.2.4 蛋白浓度的测定:参照去污剂蛋白定量试剂盒的说明,首先绘制蛋白定量标准曲线。BSA(牛血清白蛋白)配成原液浓度为45 mg/ml,用裂解液依次稀释为0~1.5 mg/ml的浓度梯度。12.5 μl各浓度梯度标准液及10 μl待测蛋白溶液,依次加入A′液(A液+S液)62.5 μl,混匀后加入500 μl B液,静止15 min后,于分光光度计750 nm下测定A值。待测蛋白通过其A值于标准曲线上定出蛋白浓度。
1.2.5 Western blot分析:根据蛋白浓度,每条泳道上样25 μg蛋白,加入等体积的1×SDS凝胶加样缓冲液(50 mmol/L Tris.Cl pH 6.8,100 mmol/L二硫苏糖醇,2%SDS,0.1%溴酚蓝,10%甘油),100 ℃加热5 min使样品中蛋白变性,30%的聚丙烯酰胺凝胶电泳后,将凝胶中蛋白电转移至硝酸纤维素滤膜上,5%脱脂奶粉封闭4 ℃过夜或室温下2 h,PBS-T(PBS+0.1%Tween 20)洗膜15 min×1次,室温下摇床上一抗孵育2~3 h,PBS-T洗膜15 min×3次,二抗孵育1~1.5 h,PBS-T洗膜15 min×3次,于暗室中加入ECL发光试剂约1 min,X线片曝光,分析结果。
, http://www.100md.com
2 结 果
2.1 3H-TdR掺入检测EGF对RA滑膜细胞DNA合成的影响:见图1。可以看出,EGF 0.01~10 ng/ml,随着剂量的增加,显著增加每分钟计数值,但剂量再增加100~1 000 ng/ml,每分钟计数值差异无显著性,采用两样本均数间配对t检验,EGF 1 ng/ml刺激组和对照组有差别,P<0.05,EGF 10~1 000 ng/ml刺激组和对照组差异有显著性(P<0.001)。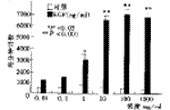
图1 EGF对RA滑膜细胞DNA合成的影响
2.2 蛋白定量测定:测定的A值与蛋白浓度成直线相关,直线方程为y=2.77x-0.017,相关系数为0.994。说明该测定方法的可靠性。通过测定待测蛋白的A值,计算出其蛋白浓度。
, 百拇医药
2.3 MAPK的检测:一抗为避免抗活化形式的多克隆抗体ERK(1∶20 000)、JNK(1∶5 000)、p38(1∶2 000);二抗为辣根过氧化物酶偶联驴或羊抗兔IgG(1∶10 000),结果表明ERK明显活化(图2),JNK和P38均未见活化。
将上述硝酸纤维素滤膜用洗脱液(100 mmol/L β巯基乙醇,2%SDS,62.5 mmol/L Tris*Cl pH 6.8)洗脱抗活化形式ERK多克隆抗体;然后用抗非活化形式的ERK抗体(1∶100)进行检测,对照组和EGF刺激组蛋白条带ERK1和ERK2的信号强度几乎完全相同(图3),表明本实验中检测到的ERK活性的变化并非由于ERK的表达量及上样量的差异所致。因两图是在同一张硝酸纤维素滤膜上用不同的抗体检测得出的,综合两图结果,证明滑膜细胞中ERK在EGF的作用下明显活化。
3 讨 论
RA对人类健康和生活质量造成极大的威胁。目前病因及发病机制尚不完全明确,除抗炎治疗外,缺乏特效药物控制关节早期病变;晚期需借助于人工关节来最大限度的恢复功能。因此,150多年来人们一直努力探讨RA的发病机制以早期控制病变。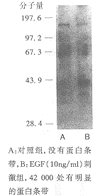
, http://www.100md.com
图2 活性型MAPK的检测
图3 非活化MAPK的检测
现在对于RA主要集中于滑膜细胞的类肿瘤性研究。人们注意到RA滑膜中存在过量的细胞因子、受体和与其有同源性的癌基因产物,它们可能作用于滑膜细胞信号传导途径的不同部位,导致持续的信号传导,从而引起RA滑膜细胞的无限制增生[4]。
EGF是1959年在神经生长因子的研究过程中偶然发现的。由53个氨基酸组成,分子量为6 000,是强有力的促细胞分裂因子,能刺激体内或体外培养的多种组织和细胞的分裂、增生、分化[1]。EGF与RA的发病密切相关,Shiozawa等[2]1989年用免疫组织化学的方法证明RA滑膜衬里层细胞EGF及受体的表达量同衬里层的厚度及新生血管的程度成正比,明显高于骨关节炎(osteoarthritis,OA)及创伤性关节炎。RA的关节液及滑膜组织中EGF的含量高于OA[5]。我们在本实验中首次应用体外培养RA滑膜细胞,加入外源性EGF刺激,观察对细胞增生的影响,实验结果表明,EGF能显著诱导细胞的增生。从而证明了EGF在RA的发病中可能主要起刺激RA滑膜细胞过度增生的效应。但对于EGF刺激滑膜细胞后,细胞内信号传导途径及相关信号传导分子的活性变化未见报道。
, 百拇医药
EGF受体是酪氨酸激酶受体家族中的代表,在其他细胞的研究中,受体酪氨酸激酶激活可激活磷脂酶C(PLC-γ),磷脂酰肌醇3激酶(PI-3K),ras和src家族成员。同时启动细胞内多条信号传导通路,最终通过MAPK使核中一些转录因子如c-fos、c-jun磷酸化,导致细胞的增生反应[4,6]。
MAPK为一族蛋白激酶,负责将由特异细胞外刺激信号诱发的蛋白激酶酪氨酸磷酸化转变为蛋白激酶丝氨酸/苏氨酸磷酸化,从而使信号向下游传导。因此它位于许多细胞因子信号传导途径中重要的中介位置。在未受刺激的细胞内,MAPK表现为脱磷酸型,只有当它的苏氨酸和酪氨酸残基都被磷酸化后,MAPK才被激活。ERK、JNK和p38都属于MAPK的亚型,ERK主要与细胞的增生通路有关,而JNK和p38主要在热休克、渗透压改变和紫外线照射诱导细胞凋亡的信号传导途径中起作用。三种亚型可以独立或同时被激活[7]。已证明MAPK途径是EGF诱导表皮成纤维细胞[8]、角质细胞[9]、小肠癌细胞lEC-6[10]等细胞增生的主要细胞内信号传导通路。我们首次应用3H-TdR掺入法证明EGF能显著诱导体外培养的RA滑膜细胞的增生,那么EGF诱导RA滑膜细胞增生是否通过活化MAPK来实现呢?我们用Western blot方法,用最新出现的抗活化形式的抗体直接标记磷酸化的苏氨酸和酪氨酸残基,来检测MAPK的活化,使实验步骤简单易行。因既往检测MAPK的活化,需要用同位素标记、免疫沉淀,观察MAPK对其特异底物MAP-2(microtuble-associated protein 2)或MBP(myelin basic protein)的催化等繁琐步骤[11]。我们的实验证明ERK明显活化,JNK和p38未见活化,从而说明EGF刺激RA滑膜细胞增生的细胞内信号传导通路可能以ERK通路为主。
, http://www.100md.com
本实验初步研究了EGF对RA滑膜细胞的生物学效应及对细胞中MAPK的激活,但引起MAPK激活的上、下游激酶及核内转录因子等详细的信号传导途径,尚需进一步实验证实。
基金项目:国家自然科学基金重点项目资助(39730430)
参 考 文 献
1,赵尽,施产甫.表皮生长因子.国外医学分子生物学分册,1984,6:160-163.
2,Shiozawa S,Shiozawa K,Tanaka Y,et al.Human epidermal growth factor for the stratification of synovial lining layer and neovascularisation in rheumatoid arthritis.Ann Rheum Dis,1989,48:820-828.
, 百拇医药
3,Arnett FC,Edworthy SM,Bloch DA,et al.The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis.Arthritis Rheum,1988,31:315-324.
4,燕太强,吕厚山,药立波.类风湿关节炎滑膜细胞酪氨酸激酶信号传导系统,中华风湿病学杂志,1999,3:121-123.
5,Farahat MN,Yanni G,Poston R,et al.Cytokine expression in synovial membranes of patients with rheumatoid arthritis and osteoarthritis.Ann Rheum Dis,1993,52:870-875.
, 百拇医药
6,Ullrich A,Schlessinger J.Signal transduction by receptors with tyrosine kinase activity.Cell,1990,61:203-212.
7,Cano E ,Mahadevan LC.Parallel signal processing among mammalian mitogen-activated protein kinases.Trends Biochem Sci,1995,20:117-122.
8,Pages G,Lenormand P,L′Allemain,et al.Mitogen-activated protein kinases p42 mapk and p44 mapk are required for fibroblast proliferation.Proc Natl Acad Sci USA,1993,90:8319-8323.
, 百拇医药
9,Mitev V,Le-Panse R,Coulomb B,et al.Epidermal growth factor stimulates mitogen-activated protein kinase by a PKC-dependent pathway in human keratinocytes.Biochem Biophys Res Commun,1995,208:245-252.
10,Dionne S,D′Agata ID,Ruemmele FM,et al.Tyrosine kinase and MAPK inhibition of TNF-α and EGF-stimulated IEC-6 cell growth.Biochem Biophy Res Commun,1998,242:146-150.
11,Ahn NG,Seger R,Bratlein RL,et al.Multiple components in an epidermal-growth factor-stimulated protein kinase cascade in vitro activation of a myelin basic protein/microtubule-associated protein 2 kinase.J Biol Chem,1991,266:4220-4227.
(收稿日期:1999-08-23), 百拇医药
单位:燕太强(100044 北京大学人民医院关节病研究所);吕厚山(100044 北京大学人民医院关节病研究所);药立波(第四军医大学生化及分子生物学教研室);孙铁铮(100044 北京大学人民医院关节病研究所)
关键词:表皮生长因子尿抑胃素;关节炎,类风湿;滑膜;成纤维细胞;有丝分裂原;蛋白激酶类
中华风湿病学杂志000504 【摘 要】 目的 观察表皮生长因子(EGF)对类风湿关节炎(RA)滑膜细胞的作用和细胞中有丝分裂素激活的蛋白激酶(MAPK)的激活情况。方法 3~5代体外培养的RA滑膜细胞,3H-TdR掺入检测EGF对细胞DNA合成的影响;EGF刺激后裂解细胞,收获蛋白,Western blot检测MAPK的活化。结果 EGF刺激组和对照组每分钟计数值差异有显著性(P<0.001)。EGF能引起细胞内明显MAPK活化。结论 MAPK可能是EGF刺激RA滑膜细胞增生的信号传导通路中的重要介质。
, http://www.100md.com
Effect of epidermal growth factor on rheumatoid synovial fibroblasts
YAN Taiqiang,LÜ Houshan,YAO Libo,et al.
(Arthritis Research Center,People′s,Hospital,Beijing University,Beijiing 100044,China.)
【Abstract】 Objective To determine whether EGF affects DNA synthesis and activates intracellular MAPK in rheumatoid synovial fibroblasts.Methods Cultured rheumatoid synovial fibroblasts were stimulated with exogenous EGF,then investigated 3H-TdR incorporation;and Western blot analysis of cell lysates.Results The incorporation of 3H-TdR was significantly increased upon EGF treatment,meanwhile,immunoblotting revealed that MAPK phosphorylation was greatly increased.Conclusion MAPK is likely to recepter an important component in the cascade of signals that link EGF receptor to EGF eliciting the cellular proliferative response in rheumatoid synovial fibroblasts.
, 百拇医药
【Key words】 Epidermal growth factor-urogastone; Arthritis,rheumatoid; Synovial membrane; Fibroblasts; Mitogen; Protein kinases
表皮生长因子(EGF)能刺激多种组织和细胞类型的分裂、增生或分化[1],在RA滑膜组织中EGF高表达[2]。但是,有关EGF作用于RA滑膜细胞后,细胞中的信号传导途径以及相关信号传导分子的活性变化未见有报道。
1 材料与方法
1.1 材料
1.1.1 主要试剂:DMEM培养基(Gibco公司产品),EGF(300 μg/ml,北京经科生物制品公司),3H-TdR(中国科学院原子能研究所),去污剂蛋白定量试剂盒(Bio-Rad)、ECL Western bolt发光试剂(Amersham公司产品)。
, 百拇医药
1.1.2 抗体:三种抗活化型MAPK(ERK、JNK、p38)多克隆抗体(Promega,USA)、三种抗非活化型MAPK、CERK、JNK、p38)多克隆抗体(Promega,USA)、辣根过氧化物酶偶联驴或羊抗兔lgG。
1.2 方法
1.2.1 RA滑膜细胞的体外培养:20例RA病人均符合1987年美国风湿病协会(ARA)诊断标准[3]。其中男4例,女16例,年龄平均46.5岁(20~75岁),病程平均17.5年(3~47年)。滑膜切除5例,全膝关节置换15例。无菌获取滑膜组织,尽量剔除脂肪及纤维组织,PBS清洗两遍,剪成约1 mm3的碎块,置于无菌瓶内,用0.5 mg/ml的胶原酶Ⅰ消化4~5 h,200目纱网过滤后,离心2次,去除脂肪及杂质。加入DMEM培养液(含20%胎牛血清,20 mmol/L HEPES,2 mmol/L L-谷氨酰胺,100 U/ml青霉素,100 μg/ml链霉素),分装于培养瓶内,置于37 ℃、5%CO2孵箱内培养24 h时后,弃除非贴壁细胞,更换培养液,待滑膜细胞基本长满后,消化传代,实验用3~5代细胞。
, 百拇医药
1.2.2 3H-TdR掺入法检测RA滑膜细胞中DNA的合成:3~5代细胞以每孔1×104种植于96孔板内。培养24 h后,更换无血清DMEM培养液静息24 h。然后换为实验培养液(对照及EGF 0.01~1 000 ng/ml 6个浓度梯度,各设4个复孔),继续培养48 h。细胞收集前18 h加入37 kBq/L 3H-TdR,培养结束后吸出孔内培养液,用PBS洗3遍,加入胰蛋白酶消化液终止。用多头细胞收集器将细胞收集于玻璃纤维滤膜上,晾干后,将装有玻璃纤维滤膜的闪烁瓶中加入闪烁液,用1410液体闪烁计数器测定每份样品每分钟计数。
1.2.3 EGF刺激RA滑膜细胞后蛋白的收集:直径为60 mm的培养皿中3~5代的滑膜细胞约90%长满时,吸除培养液,换用5 ml无血清DMEM培养液静息24 h,EGF(10 ng/ml)刺激滑膜细胞5 min后,预冷PBS冲洗3遍,加入单去污剂裂解液(50 mmol/L Tris*Cl pH 8.0,150 mmol/L NaCl,0.02%叠氮钠,100 μg/ml PMSF,5 μg/ml aprotinin,10 mmol/L矾酸钠,2 mmol/L EDTA,1% Triton X-100)100 μl,置于冰盒上20 min后,细胞刮仔细收集裂解的细胞,置于0.5 ml的EP管中,涡旋2次,置于冰盒中静止15 min,离心15 000 r/min,10 min,将上清移至新EP管中。
, http://www.100md.com
1.2.4 蛋白浓度的测定:参照去污剂蛋白定量试剂盒的说明,首先绘制蛋白定量标准曲线。BSA(牛血清白蛋白)配成原液浓度为45 mg/ml,用裂解液依次稀释为0~1.5 mg/ml的浓度梯度。12.5 μl各浓度梯度标准液及10 μl待测蛋白溶液,依次加入A′液(A液+S液)62.5 μl,混匀后加入500 μl B液,静止15 min后,于分光光度计750 nm下测定A值。待测蛋白通过其A值于标准曲线上定出蛋白浓度。
1.2.5 Western blot分析:根据蛋白浓度,每条泳道上样25 μg蛋白,加入等体积的1×SDS凝胶加样缓冲液(50 mmol/L Tris.Cl pH 6.8,100 mmol/L二硫苏糖醇,2%SDS,0.1%溴酚蓝,10%甘油),100 ℃加热5 min使样品中蛋白变性,30%的聚丙烯酰胺凝胶电泳后,将凝胶中蛋白电转移至硝酸纤维素滤膜上,5%脱脂奶粉封闭4 ℃过夜或室温下2 h,PBS-T(PBS+0.1%Tween 20)洗膜15 min×1次,室温下摇床上一抗孵育2~3 h,PBS-T洗膜15 min×3次,二抗孵育1~1.5 h,PBS-T洗膜15 min×3次,于暗室中加入ECL发光试剂约1 min,X线片曝光,分析结果。
, http://www.100md.com
2 结 果
2.1 3H-TdR掺入检测EGF对RA滑膜细胞DNA合成的影响:见图1。可以看出,EGF 0.01~10 ng/ml,随着剂量的增加,显著增加每分钟计数值,但剂量再增加100~1 000 ng/ml,每分钟计数值差异无显著性,采用两样本均数间配对t检验,EGF 1 ng/ml刺激组和对照组有差别,P<0.05,EGF 10~1 000 ng/ml刺激组和对照组差异有显著性(P<0.001)。

图1 EGF对RA滑膜细胞DNA合成的影响
2.2 蛋白定量测定:测定的A值与蛋白浓度成直线相关,直线方程为y=2.77x-0.017,相关系数为0.994。说明该测定方法的可靠性。通过测定待测蛋白的A值,计算出其蛋白浓度。
, 百拇医药
2.3 MAPK的检测:一抗为避免抗活化形式的多克隆抗体ERK(1∶20 000)、JNK(1∶5 000)、p38(1∶2 000);二抗为辣根过氧化物酶偶联驴或羊抗兔IgG(1∶10 000),结果表明ERK明显活化(图2),JNK和P38均未见活化。
将上述硝酸纤维素滤膜用洗脱液(100 mmol/L β巯基乙醇,2%SDS,62.5 mmol/L Tris*Cl pH 6.8)洗脱抗活化形式ERK多克隆抗体;然后用抗非活化形式的ERK抗体(1∶100)进行检测,对照组和EGF刺激组蛋白条带ERK1和ERK2的信号强度几乎完全相同(图3),表明本实验中检测到的ERK活性的变化并非由于ERK的表达量及上样量的差异所致。因两图是在同一张硝酸纤维素滤膜上用不同的抗体检测得出的,综合两图结果,证明滑膜细胞中ERK在EGF的作用下明显活化。
3 讨 论
RA对人类健康和生活质量造成极大的威胁。目前病因及发病机制尚不完全明确,除抗炎治疗外,缺乏特效药物控制关节早期病变;晚期需借助于人工关节来最大限度的恢复功能。因此,150多年来人们一直努力探讨RA的发病机制以早期控制病变。

, http://www.100md.com
图2 活性型MAPK的检测

图3 非活化MAPK的检测
现在对于RA主要集中于滑膜细胞的类肿瘤性研究。人们注意到RA滑膜中存在过量的细胞因子、受体和与其有同源性的癌基因产物,它们可能作用于滑膜细胞信号传导途径的不同部位,导致持续的信号传导,从而引起RA滑膜细胞的无限制增生[4]。
EGF是1959年在神经生长因子的研究过程中偶然发现的。由53个氨基酸组成,分子量为6 000,是强有力的促细胞分裂因子,能刺激体内或体外培养的多种组织和细胞的分裂、增生、分化[1]。EGF与RA的发病密切相关,Shiozawa等[2]1989年用免疫组织化学的方法证明RA滑膜衬里层细胞EGF及受体的表达量同衬里层的厚度及新生血管的程度成正比,明显高于骨关节炎(osteoarthritis,OA)及创伤性关节炎。RA的关节液及滑膜组织中EGF的含量高于OA[5]。我们在本实验中首次应用体外培养RA滑膜细胞,加入外源性EGF刺激,观察对细胞增生的影响,实验结果表明,EGF能显著诱导细胞的增生。从而证明了EGF在RA的发病中可能主要起刺激RA滑膜细胞过度增生的效应。但对于EGF刺激滑膜细胞后,细胞内信号传导途径及相关信号传导分子的活性变化未见报道。
, 百拇医药
EGF受体是酪氨酸激酶受体家族中的代表,在其他细胞的研究中,受体酪氨酸激酶激活可激活磷脂酶C(PLC-γ),磷脂酰肌醇3激酶(PI-3K),ras和src家族成员。同时启动细胞内多条信号传导通路,最终通过MAPK使核中一些转录因子如c-fos、c-jun磷酸化,导致细胞的增生反应[4,6]。
MAPK为一族蛋白激酶,负责将由特异细胞外刺激信号诱发的蛋白激酶酪氨酸磷酸化转变为蛋白激酶丝氨酸/苏氨酸磷酸化,从而使信号向下游传导。因此它位于许多细胞因子信号传导途径中重要的中介位置。在未受刺激的细胞内,MAPK表现为脱磷酸型,只有当它的苏氨酸和酪氨酸残基都被磷酸化后,MAPK才被激活。ERK、JNK和p38都属于MAPK的亚型,ERK主要与细胞的增生通路有关,而JNK和p38主要在热休克、渗透压改变和紫外线照射诱导细胞凋亡的信号传导途径中起作用。三种亚型可以独立或同时被激活[7]。已证明MAPK途径是EGF诱导表皮成纤维细胞[8]、角质细胞[9]、小肠癌细胞lEC-6[10]等细胞增生的主要细胞内信号传导通路。我们首次应用3H-TdR掺入法证明EGF能显著诱导体外培养的RA滑膜细胞的增生,那么EGF诱导RA滑膜细胞增生是否通过活化MAPK来实现呢?我们用Western blot方法,用最新出现的抗活化形式的抗体直接标记磷酸化的苏氨酸和酪氨酸残基,来检测MAPK的活化,使实验步骤简单易行。因既往检测MAPK的活化,需要用同位素标记、免疫沉淀,观察MAPK对其特异底物MAP-2(microtuble-associated protein 2)或MBP(myelin basic protein)的催化等繁琐步骤[11]。我们的实验证明ERK明显活化,JNK和p38未见活化,从而说明EGF刺激RA滑膜细胞增生的细胞内信号传导通路可能以ERK通路为主。
, http://www.100md.com
本实验初步研究了EGF对RA滑膜细胞的生物学效应及对细胞中MAPK的激活,但引起MAPK激活的上、下游激酶及核内转录因子等详细的信号传导途径,尚需进一步实验证实。
基金项目:国家自然科学基金重点项目资助(39730430)
参 考 文 献
1,赵尽,施产甫.表皮生长因子.国外医学分子生物学分册,1984,6:160-163.
2,Shiozawa S,Shiozawa K,Tanaka Y,et al.Human epidermal growth factor for the stratification of synovial lining layer and neovascularisation in rheumatoid arthritis.Ann Rheum Dis,1989,48:820-828.
, 百拇医药
3,Arnett FC,Edworthy SM,Bloch DA,et al.The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis.Arthritis Rheum,1988,31:315-324.
4,燕太强,吕厚山,药立波.类风湿关节炎滑膜细胞酪氨酸激酶信号传导系统,中华风湿病学杂志,1999,3:121-123.
5,Farahat MN,Yanni G,Poston R,et al.Cytokine expression in synovial membranes of patients with rheumatoid arthritis and osteoarthritis.Ann Rheum Dis,1993,52:870-875.
, 百拇医药
6,Ullrich A,Schlessinger J.Signal transduction by receptors with tyrosine kinase activity.Cell,1990,61:203-212.
7,Cano E ,Mahadevan LC.Parallel signal processing among mammalian mitogen-activated protein kinases.Trends Biochem Sci,1995,20:117-122.
8,Pages G,Lenormand P,L′Allemain,et al.Mitogen-activated protein kinases p42 mapk and p44 mapk are required for fibroblast proliferation.Proc Natl Acad Sci USA,1993,90:8319-8323.
, 百拇医药
9,Mitev V,Le-Panse R,Coulomb B,et al.Epidermal growth factor stimulates mitogen-activated protein kinase by a PKC-dependent pathway in human keratinocytes.Biochem Biophys Res Commun,1995,208:245-252.
10,Dionne S,D′Agata ID,Ruemmele FM,et al.Tyrosine kinase and MAPK inhibition of TNF-α and EGF-stimulated IEC-6 cell growth.Biochem Biophy Res Commun,1998,242:146-150.
11,Ahn NG,Seger R,Bratlein RL,et al.Multiple components in an epidermal-growth factor-stimulated protein kinase cascade in vitro activation of a myelin basic protein/microtubule-associated protein 2 kinase.J Biol Chem,1991,266:4220-4227.
(收稿日期:1999-08-23), 百拇医药