小鼠下颌下腺条件培养上清对造血祖细胞增殖的影响
作者:吴宏 祝彼得 王亚平
单位:吴宏(重庆医科大学组织学胚胎学教研室,重庆 400016);祝彼得(成都中医药大学,成都 610075);王亚平(重庆医科大学组织学胚胎学教研室,重庆 400016)
关键词:下颌下腺组织培养上清;造血祖细胞;造血生长因子;血细胞发生;小鼠
解剖学报000317 【摘要】 目的 研究下颌下腺与血细胞发生的关系,探讨下颌下腺对造血功能的调节作用。 方法 采用造血祖细胞体外培养及造血生长因子(HGF)活性检测法。 结果 正常雄性和雌性小鼠下颌下腺组织培养上清(SGCM)对粒单系祖细胞(CFU-GM)、红系祖细胞(BFU-E、CFU-E)和巨核系祖细胞(CFU-Meg)的增殖有明显促进作用;正常雄性小鼠SGCM对CFU-E和CFU-Meg的刺激活性明显高于正常雌性小鼠SGCM。贫血模型雌、雄小鼠的SGCM能提高BFU-E、CFU-E的产率;雌性贫血模型小鼠的SGCM亦能提高CFU-Meg的产率。IL-3能促进SGCM对BFU-E、CFU-E的增殖。 结论 小鼠下颌下腺可能通过分泌造血生长因子样物质促进造血祖细胞增生,从而发挥造血调控功能。
, http://www.100md.com
研究下颌下腺与血细胞发生的关系,探讨下颌下腺对造血功能的调节作用。 方法 采用造血祖细胞体外培养及造血生长因子(HGF)活性检测法。 结果 正常雄性和雌性小鼠下颌下腺组织培养上清(SGCM)对粒单系祖细胞(CFU-GM)、红系祖细胞(BFU-E、CFU-E)和巨核系祖细胞(CFU-Meg)的增殖有明显促进作用;正常雄性小鼠SGCM对CFU-E和CFU-Meg的刺激活性明显高于正常雌性小鼠SGCM。贫血模型雌、雄小鼠的SGCM能提高BFU-E、CFU-E的产率;雌性贫血模型小鼠的SGCM亦能提高CFU-Meg的产率。IL-3能促进SGCM对BFU-E、CFU-E的增殖。 结论 小鼠下颌下腺可能通过分泌造血生长因子样物质促进造血祖细胞增生,从而发挥造血调控功能。
【中图分类号】 R331.2 【文献标识码】 A 【文章编号】 0529-1356(2000)03-261
THE EFFECT OF MURINE SUBMANDIBULAR GLAND
, 百拇医药
CONDITIONED MEDIA ON PROLIFERATION OF
HEMATOPOIETIC PROGENITOR CELLS
WU Hong ZHU Bi-de WANG Ya-ping
Department of Histology and Embryology,Chongqing University of Medical Sciences,Chongqing 400016,China
Chengdu University of Traditional Chinese Medicine,Chengdu 610075,China
【Abstract】 Objective Clarifying the relationship between submandibular glands and hematopoiesis and providing the theoretical and experimental evidences for hematopoietic regulation of submandibular glands.Methods Hematopoietic progenitor cell culture(CFU-GM,BFU-E,CFU-E and CFU-Meg)in vitro,and bioassay of hematopoietic growth factor(HGF)were used.Results Within the range of 5%-20%(V/V%)concentration of male or female murine submandibular gland conditioned media(SGCM),the growth of hematopoietic progenitor cells is obviously promoted(without any exogenous HGF).The promoting activity of male SGCM is higher than that of female SGCM in augmenting colony formation of CFU-E and CFU-Meg.The proliferation of BFU-E and CFU-E can be enhanced by anemic male or female SGCM.Anemic female murine SGCM can also stimulate the development of CFU-Meg.IL-3 can collaborate with SGCM to promote proliferation of BFU-E and CFU-E.Conclusion Murine submandibular glands can stimulate the proliferation of hematopoietic progenitor cells by secreting hematopoietic growth factors-liked substance.There may be the function of hematopoietic regulation in murine submandibular glands.
, 百拇医药
【Key words】 Submandibular gland conditioned medium;Hematopoietic progenitor cell; Hematopoietic growth factors;Hematopoiesis;Mouse
70年代初,国外学者发现小鼠与大鼠下颌下腺含有骨髓集落刺激因子(CSF)和红细胞生成素(EPO)[1,2],提示下颌下腺与造血调控有关。迄今为止,有关下颌下腺参与造血的文献报道甚少,且存在较大差异[3~7]。本实验采用造血祖细胞体外培养及造血生长因子(HGF)活性检测等实验血液学技术,较系统地观察了小鼠下颌下腺组织培养上清对髓系造血祖细胞增殖分化的影响,旨在探讨下颌下腺与血细胞发生的关系,为认识下颌下腺对造血功能的调节提供实验依据。
材料和方法
1. 实验动物
, 百拇医药
8~12周BALB/c纯系小鼠,体重18~25g。重庆医科大学实验动物中心提供。
2. 主要试剂
RPMI-1640培养基、DMEM培养基、甲基纤维素(美国GIBCO公司产品);马血清(HS)和EPO(中国军事医学科学院产品);重组人白细胞介素-3(rhIL-3)(第三军医大学分子生物学教研室提供);琼脂(日本进口分装);盐酸苯肼(北京化工厂产品),生理盐水配成16g/L。
3. 小鼠下颌下腺组织培养上清(SGCM)的制备
3.1 贫血小鼠模型复制:小鼠经腹腔1次性注射盐酸苯肼水溶液(80mg/kg)后,检测红细胞和血红蛋白值均显著低于正常鼠为模型复制成功标准[8,9]。
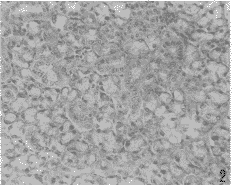
3.2 正常或贫血雄、雌性小鼠下颌下腺组织培养上清(雄性SGCM、雌性SGCM、雄性A-SGCM和雌性A-SGCM)的制备:取雄性和雌性正常或贫血小鼠(模型复制成功后第3d)下颌下腺(图1,2),RPMI-1640培养液清洗3次,剪成约2mm3大小,浸泡2h,分别按1∶2∶7比例将下颌下腺组织块(g),马血清(ml)和RPMI-1640培养液(ml)加入培养瓶内。培养5d,收集上清。同时将含有20%HS的RPMI-1640培养液(无下颌下腺组织块)加入培养瓶内,孵育5d,收集,作为阴性对照备用。
, 百拇医药
4. 小鼠造血祖细胞体外培养
粒单系祖细胞(CFU-GM)、红系祖细胞(BFU-E,CFU-E)和巨核系祖细胞(CFU-Meg)培养、集落染色鉴定与计数方法均为本室常规方法[9~11]。在造血祖细胞培养体系中分别加入不同条件下制备的SGCM,根据祖细胞形成的集落数和性质评价SGCM中所含造血生长因子的活性与种类。同时设加入已知HGF的阳性对照组和无外源性HGF的阴性对照组。
结果
1. SGCM对粒单系祖细胞(CFU-GM)的影响
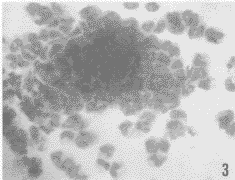
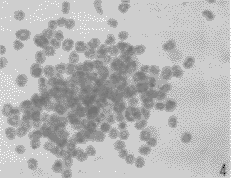
无已知的外源性粒细胞-巨噬细胞集落刺激因子(GM-CSF)存在时,10%(V/V%)的雄性SGCM或雌性SGCM对CFU-GM增殖均有明显的刺激作用(图3,4),两者的集落产率无显著性差异,但显著低于阳性对照组;而阴性对照组的集落产率为零(附表)。
, 百拇医药
附表 SGCM对小鼠骨髓造血祖细胞的影响
Table Effect of SGCM on development of bone marrow's hematopoietic progenitor cells in mice 组 别groups
阳性对照组
positive control group
阴性对照组
negative control group
雄性 SGCM组
male SGCM group
雌性SGCM组
, http://www.100md.com
female SGCM group
n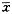 ±s
±s
n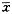 ±s
±s
n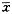 ±s
±s
n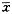 ±s
±s
CFU-GM
14
117.14±20.40
, http://www.100md.com
14
0
14
71.64±17.01
14
81.79±14.69
BFU-E
20
28.05± 4.56
20
0
20
31.40± 8.40
, 百拇医药
20
27.70± 9.08
CFU-E
20
106.80± 7.51
20
8.90±3.16
20
69.05± 7.13
20
36.25± 5.87
CFU-Meg
, http://www.100md.com
10
24.10± 3.18
10
6.80±2.57
10
24.20± 5.14
10
18.20± 3.12
示与阳性对照组比较,P<0.05;示与雄性SGCM组比较,P<0.05;单位:CFU-GM,集落数/5×104BMC;其余,集落数/4×104BMC。 ,P<0.05,Compared with positive control group;,P<0.05,Compared with male SGCM group;Unit:CFU-GM,colonies/5×104BMC;Others,colonies/4×104BMC.
, 百拇医药
2. SGCM对红系祖细胞(BFU-E、CFU-E)的影响
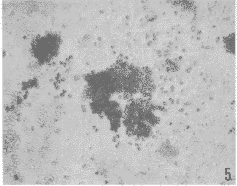
无已知的外源性EPO和爆式集落刺激活性(BPA)存在时,15%(V/V%)的雄性 SGCM或雌性 SGCM对BFU-E的形成均有明显刺激作用(图5),与阳性对照组相比无显著性差异;而阴性对照组则无集落形成(附表)。无已知的外源性EPO存在时,15%(V/V%)的雄性 SGCM和雌性SGCM对CFU-E的形成有刺激作用(图6),但雌性SGCM组的集落产率显著低于雄性SGCM组;而雄性 SGCM组和雌性SGCM组的CFU-E产率明显高于阴性对照组,但显著低于阳性对照组(附表)。
在含有雄性 SGCM或雌性SGCM的BFU-E、CFU-E培养体系中加入BPO(2IU),未见能提高BFU-E、CFU-E的产率(图7,8)。而加入rhIL-3(20μl)对BFU-E的产率有明显促进作用(图7);在含有雄性SGCM的CFU-E培养体系中加入rhIL-3(20μl),可提高CFU-E的产率,而加入rhIL-3到含有雌性SGCM的CFU-E培养体系中,其CFU-E的产率无明显提高(图8)。无已知的外源性HGF存在时,15%(V/V%)的雄性A-SGCM或雌性A-SGCM对BFU-E、CFU-E均有明显刺激作用,其集落产率分别显著高于雄性SGCM组和雌性SGCM组(图7,8)。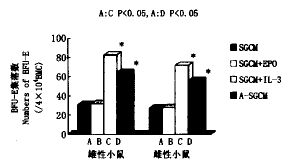
, 百拇医药
图7 SGCM,EPO,IL-3和A-SGCM对BFU-E形成的影响
Fig.7 The effects of SGCM,EPO,IL-3 and A-SGCM on BFU-E formation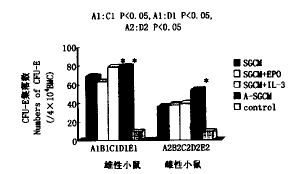
图8 SGCM,EPO,IL-3和A-SGCM对CFU-E形成的影响
Fig.8 The effects of SGCM,EPO,IL-3 and A-SGCM on CFU-E formation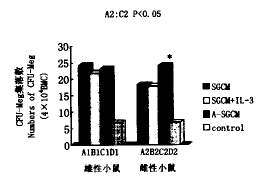
图9 SGCM,IL-3和A-SGCM对CFU-Meg形成的影响
, 百拇医药 Fig.9 The effects of SGCM,IL-3 and A-SGCMon CFU-Meg formation
3. SGCM对巨核系祖细胞(CFU-Meg)的影响
无已知的外源性HGF存在时,15%(V/V%)的雄性SGCM或雌性SGCM均对CFU-Meg的形成有明显刺激作用,其中雄性SGCM组的CFU-Meg集落产率与阳性对照组相比无显著性差异;而雌性SGCM组的CFU-Meg集落产率显著低于雄性SGCM组,但高于阴性对照组(附表)。
将rhIL-3(20μl)加入含有雄性SGCM或雌性SGCM的CFU-Meg培养体系中,均未见能提高CFU-Meg的集落产率(图9)。无已知的外源性HGF存在时,15%(V/V%)的雌性A-SGCM对CFU-Meg的形成有明显刺激作用,其集落产率显著高于雌性SGCM组(图9)。
, 百拇医药 讨论
血细胞生成的调控是十分复杂的细胞及生化过程,从造血干细胞到造血祖细胞的增殖分化、直至成熟血细胞的形成,每一环节都受着多种具有刺激活性或抑制活性的造血调控因子的调节。造血生长因子(HGF)包括集落刺激因子(CSF)、白细胞介素类(IL)及某些激素(EPO、TPO)等正调控因子和一些负调控因子,如干扰素(IFN)和肿瘤坏死因子(TNF)等,机体很多组织细胞尤其是造血基质细胞和淋巴细胞能分泌上述调控因子,正是这些正、负调控因子的协调才构成了血细胞发生的微妙调节网络;造血祖细胞膜表面有与HGF(CSF、EPO等)相结合的受体,机体的造血调控主要在此阶段进行[12,13]。造血祖细胞在体外增殖分化形成集落必须依赖HGF的存在,根据祖细胞形成的集落数和性质可检测HGF的活性和种类。因此,造血祖细胞体外培养对于检测样品中HGF生物学活性及性质仍是一种敏感的细胞生物学方法。
本研究结果表明:无外源性HGF存在时,正常雄性SGCM或雌性SGCM均能明显促进CFU-GM、BFU-E、CFU-E和CFU-Meg的形成,雄性SGCM对CFU-E和CFU-Meg增殖的刺激活性高于雌性SGCM。这提示在小鼠下颌下腺组织培养上清中存在有GM-CSF、BPA和EPO样物质,且雄鼠分泌上述因子的活性可能高于雌鼠。骨髓基质细胞不仅作为造血细胞生长的支架,而且还通过细胞间的直接接触和分泌某些生长因子来调节血细胞的发生。近年研究报道,骨髓基质细胞能生成多种细胞因子,如白细胞介素、CSF、SCF和其他活性物质,这些细胞因子可直接作用于造血细胞[14]。而基质细胞的生长和分泌功能还受到其他因子的调控。我们在实验中观察到:无外源性HGF存在时,在小鼠骨髓红系或巨核系祖细胞体外半固体培养中,无论是加入SGCM或A-SGCM,培养皿内有大量基质细胞的生长,可能是小鼠下颌下腺中所含生长因子刺激的结果;大量的基质细胞及可能由基质细胞分泌的细胞因子又对红系和巨核系祖细胞的生长有促进作用[14]。
, 百拇医药
外源性EPO与SGCM共同作用似乎对红系造血调控无明显协同作用。而外源性IL-3与SGCM共同作用对BFU-E、CFU-E的增殖似有叠加或协同作用。A-SGCM能提高BFU-E、CFU-E的产率。雌性A-SGCM亦能提高CFU-Meg的产率。根据本研究结果可推测:无论是雄性或雌性小鼠,在贫血状态下,其下颌下腺所含HGF样物质将增多或活性将增高。
综上所述,小鼠下颌下腺可能通过分泌造血生长因子样物质来促进造血祖细胞增殖,也可能通过促进骨髓基质细胞生长等间接途径发挥造血调控功能;在贫血状态下,其下颌下腺所含HGF样物质可能将增多或活性将增高。但下颌下腺组织培养上清中所含的造血调控物质的本质是什么仍不清楚。作为传统消化腺的下颌下腺,其中含有数10种生物活性多肽[15],尤其是下颌下腺可能作为肾外EPO的来源之一,通过内、外分泌两种方式影响机体功能,这使得我们必须重新认识下颌下腺,尤其是下颌下腺与造血的关系,是具有挑战性的研究课题,有待深入研讨。
, 百拇医药
图1 正常雄性小鼠下颌下腺HE 染色×200
图2 正常雌性小鼠下颌下腺HE 染色×200
图3 小鼠CFU-GM 瑞氏染色×400
图4 小鼠CFU-GM HE染色×400
图5 小鼠BFU-E联苯胺染色×400
图6 小鼠CFU-E联苯胺染色×400
Fig.1 Submandibular gland of the male mouse HE stain×200
Fig.2 Submandibular gland of the mouse mouse HE stain×200
, 百拇医药
Fig. 3 Murine CFU-GM .wright's stain×400
Fig. 4 MurineCFU-GM.HE stain×400
Fig.5 Murine BFU-E.benzidine stain×400
Fig.6 Murine CFU-E.benzidine stain×400
【作者简介】吴宏(1963年—),女(汉族),浙江省义乌市人,讲师
通讯作者(To whom correspondence should be addressed)
参考文献
[1]Sheridan JW,Stanley ER.Tissue sources of bone marrow colony stimulating factor[J].J Cell Physiol,1971,78(3):451-460.
, 百拇医药
[2]Zangheri EO,Lopez OI,Honorato LE,et al.The role of submandibular glands on extrarenal erythropoietin production in mice[J].Exp Hematol,1977,5(4):237-240.
[3]Clemons GK,De Manicor D,Fitzsimmons SL,et al.Immunoreactive erythropoietin studies in hypoxic rats and the role of the salivary glands[J].Exp Hematol,1987,15(1):18-23.
[4]Clemons GK,Elverdin JC,Allippi RM,et al.Exocrine secretion of immunoreactive erythropoietin from the rat submaxillary gland[J].Exp Hematol,1988,16(2):122-124.
, http://www.100md.com
[5]Tam RC,Beawell J,Cotes PM,et al.Sexual dimorphism of erythropoietin-degrading activity in mouse submaxillary gland extracts[J].Exp Hematol,1989,17(2):160-163.
[6]Vidal A,Carcagno M,Criscuolo M,et al.Damage of tracer erythropoietin results in erroneous estimation of concentration in mouse submaxillary gland[J].Exp Hematol,1993,21(2):299-302.
[7]Hamilton DL,Cotes PM.The effect of the submandibular salivary gland on the erythropoietin response to hypoxia in mice with chronic renal failure[J].Exp Hematol,1994,22(3):256-260.
, 百拇医药
[8]苗明三主编.实验动物和动物实验技术[M].北京:中国中医药出版社,1997.244.
[9]黄干,祝彼得,张淑慎.人参总皂甙对小鼠血细胞发生的影响[J].中华血液学杂志,1990,11(1):66~68.
[10]刘秀珍.造血祖细胞培养技术实验手册[M].北京:北京出版社,1993:100,112~114.
[11]王亚平,祝彼得.当归多糖对小鼠巨核细胞-血小板发生的影响[J].中药药理与临床.1992,8(4):13~15.
[12]Clark SC,Kamen R.The human hematopoietic colony-stimulating factor[J].Science,1987,236(4806):1229-1237.
[13]Axeirad AA.Some hemopoietic negative regulators[J].Exp Hematol,1990,18(2):143-150.
[14]陈文杰主编.血液分子细胞生物学[M].北京:中国医药科技出版社,1993.44~51.
[15]成令忠主编.组织学[M].第2版,北京:人民卫生出版社,1994:1055~1059.
【收稿日期】1999-04-13 【修稿日期】1999-09-10, 百拇医药
单位:吴宏(重庆医科大学组织学胚胎学教研室,重庆 400016);祝彼得(成都中医药大学,成都 610075);王亚平(重庆医科大学组织学胚胎学教研室,重庆 400016)
关键词:下颌下腺组织培养上清;造血祖细胞;造血生长因子;血细胞发生;小鼠
解剖学报000317 【摘要】 目的 研究下颌下腺与血细胞发生的关系,探讨下颌下腺对造血功能的调节作用。 方法 采用造血祖细胞体外培养及造血生长因子(HGF)活性检测法。 结果 正常雄性和雌性小鼠下颌下腺组织培养上清(SGCM)对粒单系祖细胞(CFU-GM)、红系祖细胞(BFU-E、CFU-E)和巨核系祖细胞(CFU-Meg)的增殖有明显促进作用;正常雄性小鼠SGCM对CFU-E和CFU-Meg的刺激活性明显高于正常雌性小鼠SGCM。贫血模型雌、雄小鼠的SGCM能提高BFU-E、CFU-E的产率;雌性贫血模型小鼠的SGCM亦能提高CFU-Meg的产率。IL-3能促进SGCM对BFU-E、CFU-E的增殖。 结论 小鼠下颌下腺可能通过分泌造血生长因子样物质促进造血祖细胞增生,从而发挥造血调控功能。
, http://www.100md.com
研究下颌下腺与血细胞发生的关系,探讨下颌下腺对造血功能的调节作用。 方法 采用造血祖细胞体外培养及造血生长因子(HGF)活性检测法。 结果 正常雄性和雌性小鼠下颌下腺组织培养上清(SGCM)对粒单系祖细胞(CFU-GM)、红系祖细胞(BFU-E、CFU-E)和巨核系祖细胞(CFU-Meg)的增殖有明显促进作用;正常雄性小鼠SGCM对CFU-E和CFU-Meg的刺激活性明显高于正常雌性小鼠SGCM。贫血模型雌、雄小鼠的SGCM能提高BFU-E、CFU-E的产率;雌性贫血模型小鼠的SGCM亦能提高CFU-Meg的产率。IL-3能促进SGCM对BFU-E、CFU-E的增殖。 结论 小鼠下颌下腺可能通过分泌造血生长因子样物质促进造血祖细胞增生,从而发挥造血调控功能。
【中图分类号】 R331.2 【文献标识码】 A 【文章编号】 0529-1356(2000)03-261
THE EFFECT OF MURINE SUBMANDIBULAR GLAND
, 百拇医药
CONDITIONED MEDIA ON PROLIFERATION OF
HEMATOPOIETIC PROGENITOR CELLS
WU Hong ZHU Bi-de WANG Ya-ping
Department of Histology and Embryology,Chongqing University of Medical Sciences,Chongqing 400016,China
Chengdu University of Traditional Chinese Medicine,Chengdu 610075,China
【Abstract】 Objective Clarifying the relationship between submandibular glands and hematopoiesis and providing the theoretical and experimental evidences for hematopoietic regulation of submandibular glands.Methods Hematopoietic progenitor cell culture(CFU-GM,BFU-E,CFU-E and CFU-Meg)in vitro,and bioassay of hematopoietic growth factor(HGF)were used.Results Within the range of 5%-20%(V/V%)concentration of male or female murine submandibular gland conditioned media(SGCM),the growth of hematopoietic progenitor cells is obviously promoted(without any exogenous HGF).The promoting activity of male SGCM is higher than that of female SGCM in augmenting colony formation of CFU-E and CFU-Meg.The proliferation of BFU-E and CFU-E can be enhanced by anemic male or female SGCM.Anemic female murine SGCM can also stimulate the development of CFU-Meg.IL-3 can collaborate with SGCM to promote proliferation of BFU-E and CFU-E.Conclusion Murine submandibular glands can stimulate the proliferation of hematopoietic progenitor cells by secreting hematopoietic growth factors-liked substance.There may be the function of hematopoietic regulation in murine submandibular glands.
, 百拇医药
【Key words】 Submandibular gland conditioned medium;Hematopoietic progenitor cell; Hematopoietic growth factors;Hematopoiesis;Mouse
70年代初,国外学者发现小鼠与大鼠下颌下腺含有骨髓集落刺激因子(CSF)和红细胞生成素(EPO)[1,2],提示下颌下腺与造血调控有关。迄今为止,有关下颌下腺参与造血的文献报道甚少,且存在较大差异[3~7]。本实验采用造血祖细胞体外培养及造血生长因子(HGF)活性检测等实验血液学技术,较系统地观察了小鼠下颌下腺组织培养上清对髓系造血祖细胞增殖分化的影响,旨在探讨下颌下腺与血细胞发生的关系,为认识下颌下腺对造血功能的调节提供实验依据。
材料和方法
1. 实验动物
, 百拇医药
8~12周BALB/c纯系小鼠,体重18~25g。重庆医科大学实验动物中心提供。
2. 主要试剂
RPMI-1640培养基、DMEM培养基、甲基纤维素(美国GIBCO公司产品);马血清(HS)和EPO(中国军事医学科学院产品);重组人白细胞介素-3(rhIL-3)(第三军医大学分子生物学教研室提供);琼脂(日本进口分装);盐酸苯肼(北京化工厂产品),生理盐水配成16g/L。
3. 小鼠下颌下腺组织培养上清(SGCM)的制备
3.1 贫血小鼠模型复制:小鼠经腹腔1次性注射盐酸苯肼水溶液(80mg/kg)后,检测红细胞和血红蛋白值均显著低于正常鼠为模型复制成功标准[8,9]。
3.2 正常或贫血雄、雌性小鼠下颌下腺组织培养上清(雄性SGCM、雌性SGCM、雄性A-SGCM和雌性A-SGCM)的制备:取雄性和雌性正常或贫血小鼠(模型复制成功后第3d)下颌下腺(图1,2),RPMI-1640培养液清洗3次,剪成约2mm3大小,浸泡2h,分别按1∶2∶7比例将下颌下腺组织块(g),马血清(ml)和RPMI-1640培养液(ml)加入培养瓶内。培养5d,收集上清。同时将含有20%HS的RPMI-1640培养液(无下颌下腺组织块)加入培养瓶内,孵育5d,收集,作为阴性对照备用。
, 百拇医药
4. 小鼠造血祖细胞体外培养
粒单系祖细胞(CFU-GM)、红系祖细胞(BFU-E,CFU-E)和巨核系祖细胞(CFU-Meg)培养、集落染色鉴定与计数方法均为本室常规方法[9~11]。在造血祖细胞培养体系中分别加入不同条件下制备的SGCM,根据祖细胞形成的集落数和性质评价SGCM中所含造血生长因子的活性与种类。同时设加入已知HGF的阳性对照组和无外源性HGF的阴性对照组。
结果
1. SGCM对粒单系祖细胞(CFU-GM)的影响
无已知的外源性粒细胞-巨噬细胞集落刺激因子(GM-CSF)存在时,10%(V/V%)的雄性SGCM或雌性SGCM对CFU-GM增殖均有明显的刺激作用(图3,4),两者的集落产率无显著性差异,但显著低于阳性对照组;而阴性对照组的集落产率为零(附表)。
, 百拇医药
附表 SGCM对小鼠骨髓造血祖细胞的影响
Table Effect of SGCM on development of bone marrow's hematopoietic progenitor cells in mice 组 别groups
阳性对照组
positive control group
阴性对照组
negative control group
雄性 SGCM组
male SGCM group
雌性SGCM组
, http://www.100md.com
female SGCM group
n
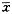 ±s
±sn
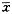 ±s
±sn
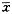 ±s
±sn
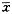 ±s
±sCFU-GM
14
117.14±20.40
, http://www.100md.com
14
0
14
71.64±17.01
14
81.79±14.69
BFU-E
20
28.05± 4.56
20
0
20
31.40± 8.40
, 百拇医药
20
27.70± 9.08
CFU-E
20
106.80± 7.51
20
8.90±3.16
20
69.05± 7.13
20
36.25± 5.87
CFU-Meg
, http://www.100md.com
10
24.10± 3.18
10
6.80±2.57
10
24.20± 5.14
10
18.20± 3.12
示与阳性对照组比较,P<0.05;示与雄性SGCM组比较,P<0.05;单位:CFU-GM,集落数/5×104BMC;其余,集落数/4×104BMC。 ,P<0.05,Compared with positive control group;,P<0.05,Compared with male SGCM group;Unit:CFU-GM,colonies/5×104BMC;Others,colonies/4×104BMC.
, 百拇医药
2. SGCM对红系祖细胞(BFU-E、CFU-E)的影响
无已知的外源性EPO和爆式集落刺激活性(BPA)存在时,15%(V/V%)的雄性 SGCM或雌性 SGCM对BFU-E的形成均有明显刺激作用(图5),与阳性对照组相比无显著性差异;而阴性对照组则无集落形成(附表)。无已知的外源性EPO存在时,15%(V/V%)的雄性 SGCM和雌性SGCM对CFU-E的形成有刺激作用(图6),但雌性SGCM组的集落产率显著低于雄性SGCM组;而雄性 SGCM组和雌性SGCM组的CFU-E产率明显高于阴性对照组,但显著低于阳性对照组(附表)。
在含有雄性 SGCM或雌性SGCM的BFU-E、CFU-E培养体系中加入BPO(2IU),未见能提高BFU-E、CFU-E的产率(图7,8)。而加入rhIL-3(20μl)对BFU-E的产率有明显促进作用(图7);在含有雄性SGCM的CFU-E培养体系中加入rhIL-3(20μl),可提高CFU-E的产率,而加入rhIL-3到含有雌性SGCM的CFU-E培养体系中,其CFU-E的产率无明显提高(图8)。无已知的外源性HGF存在时,15%(V/V%)的雄性A-SGCM或雌性A-SGCM对BFU-E、CFU-E均有明显刺激作用,其集落产率分别显著高于雄性SGCM组和雌性SGCM组(图7,8)。

, 百拇医药
图7 SGCM,EPO,IL-3和A-SGCM对BFU-E形成的影响
Fig.7 The effects of SGCM,EPO,IL-3 and A-SGCM on BFU-E formation

图8 SGCM,EPO,IL-3和A-SGCM对CFU-E形成的影响
Fig.8 The effects of SGCM,EPO,IL-3 and A-SGCM on CFU-E formation

图9 SGCM,IL-3和A-SGCM对CFU-Meg形成的影响
, 百拇医药 Fig.9 The effects of SGCM,IL-3 and A-SGCMon CFU-Meg formation
3. SGCM对巨核系祖细胞(CFU-Meg)的影响
无已知的外源性HGF存在时,15%(V/V%)的雄性SGCM或雌性SGCM均对CFU-Meg的形成有明显刺激作用,其中雄性SGCM组的CFU-Meg集落产率与阳性对照组相比无显著性差异;而雌性SGCM组的CFU-Meg集落产率显著低于雄性SGCM组,但高于阴性对照组(附表)。
将rhIL-3(20μl)加入含有雄性SGCM或雌性SGCM的CFU-Meg培养体系中,均未见能提高CFU-Meg的集落产率(图9)。无已知的外源性HGF存在时,15%(V/V%)的雌性A-SGCM对CFU-Meg的形成有明显刺激作用,其集落产率显著高于雌性SGCM组(图9)。
, 百拇医药 讨论
血细胞生成的调控是十分复杂的细胞及生化过程,从造血干细胞到造血祖细胞的增殖分化、直至成熟血细胞的形成,每一环节都受着多种具有刺激活性或抑制活性的造血调控因子的调节。造血生长因子(HGF)包括集落刺激因子(CSF)、白细胞介素类(IL)及某些激素(EPO、TPO)等正调控因子和一些负调控因子,如干扰素(IFN)和肿瘤坏死因子(TNF)等,机体很多组织细胞尤其是造血基质细胞和淋巴细胞能分泌上述调控因子,正是这些正、负调控因子的协调才构成了血细胞发生的微妙调节网络;造血祖细胞膜表面有与HGF(CSF、EPO等)相结合的受体,机体的造血调控主要在此阶段进行[12,13]。造血祖细胞在体外增殖分化形成集落必须依赖HGF的存在,根据祖细胞形成的集落数和性质可检测HGF的活性和种类。因此,造血祖细胞体外培养对于检测样品中HGF生物学活性及性质仍是一种敏感的细胞生物学方法。
本研究结果表明:无外源性HGF存在时,正常雄性SGCM或雌性SGCM均能明显促进CFU-GM、BFU-E、CFU-E和CFU-Meg的形成,雄性SGCM对CFU-E和CFU-Meg增殖的刺激活性高于雌性SGCM。这提示在小鼠下颌下腺组织培养上清中存在有GM-CSF、BPA和EPO样物质,且雄鼠分泌上述因子的活性可能高于雌鼠。骨髓基质细胞不仅作为造血细胞生长的支架,而且还通过细胞间的直接接触和分泌某些生长因子来调节血细胞的发生。近年研究报道,骨髓基质细胞能生成多种细胞因子,如白细胞介素、CSF、SCF和其他活性物质,这些细胞因子可直接作用于造血细胞[14]。而基质细胞的生长和分泌功能还受到其他因子的调控。我们在实验中观察到:无外源性HGF存在时,在小鼠骨髓红系或巨核系祖细胞体外半固体培养中,无论是加入SGCM或A-SGCM,培养皿内有大量基质细胞的生长,可能是小鼠下颌下腺中所含生长因子刺激的结果;大量的基质细胞及可能由基质细胞分泌的细胞因子又对红系和巨核系祖细胞的生长有促进作用[14]。
, 百拇医药
外源性EPO与SGCM共同作用似乎对红系造血调控无明显协同作用。而外源性IL-3与SGCM共同作用对BFU-E、CFU-E的增殖似有叠加或协同作用。A-SGCM能提高BFU-E、CFU-E的产率。雌性A-SGCM亦能提高CFU-Meg的产率。根据本研究结果可推测:无论是雄性或雌性小鼠,在贫血状态下,其下颌下腺所含HGF样物质将增多或活性将增高。
综上所述,小鼠下颌下腺可能通过分泌造血生长因子样物质来促进造血祖细胞增殖,也可能通过促进骨髓基质细胞生长等间接途径发挥造血调控功能;在贫血状态下,其下颌下腺所含HGF样物质可能将增多或活性将增高。但下颌下腺组织培养上清中所含的造血调控物质的本质是什么仍不清楚。作为传统消化腺的下颌下腺,其中含有数10种生物活性多肽[15],尤其是下颌下腺可能作为肾外EPO的来源之一,通过内、外分泌两种方式影响机体功能,这使得我们必须重新认识下颌下腺,尤其是下颌下腺与造血的关系,是具有挑战性的研究课题,有待深入研讨。






, 百拇医药
图1 正常雄性小鼠下颌下腺HE 染色×200
图2 正常雌性小鼠下颌下腺HE 染色×200
图3 小鼠CFU-GM 瑞氏染色×400
图4 小鼠CFU-GM HE染色×400
图5 小鼠BFU-E联苯胺染色×400
图6 小鼠CFU-E联苯胺染色×400
Fig.1 Submandibular gland of the male mouse HE stain×200
Fig.2 Submandibular gland of the mouse mouse HE stain×200
, 百拇医药
Fig. 3 Murine CFU-GM .wright's stain×400
Fig. 4 MurineCFU-GM.HE stain×400
Fig.5 Murine BFU-E.benzidine stain×400
Fig.6 Murine CFU-E.benzidine stain×400
【作者简介】吴宏(1963年—),女(汉族),浙江省义乌市人,讲师
通讯作者(To whom correspondence should be addressed)
参考文献
[1]Sheridan JW,Stanley ER.Tissue sources of bone marrow colony stimulating factor[J].J Cell Physiol,1971,78(3):451-460.
, 百拇医药
[2]Zangheri EO,Lopez OI,Honorato LE,et al.The role of submandibular glands on extrarenal erythropoietin production in mice[J].Exp Hematol,1977,5(4):237-240.
[3]Clemons GK,De Manicor D,Fitzsimmons SL,et al.Immunoreactive erythropoietin studies in hypoxic rats and the role of the salivary glands[J].Exp Hematol,1987,15(1):18-23.
[4]Clemons GK,Elverdin JC,Allippi RM,et al.Exocrine secretion of immunoreactive erythropoietin from the rat submaxillary gland[J].Exp Hematol,1988,16(2):122-124.
, http://www.100md.com
[5]Tam RC,Beawell J,Cotes PM,et al.Sexual dimorphism of erythropoietin-degrading activity in mouse submaxillary gland extracts[J].Exp Hematol,1989,17(2):160-163.
[6]Vidal A,Carcagno M,Criscuolo M,et al.Damage of tracer erythropoietin results in erroneous estimation of concentration in mouse submaxillary gland[J].Exp Hematol,1993,21(2):299-302.
[7]Hamilton DL,Cotes PM.The effect of the submandibular salivary gland on the erythropoietin response to hypoxia in mice with chronic renal failure[J].Exp Hematol,1994,22(3):256-260.
, 百拇医药
[8]苗明三主编.实验动物和动物实验技术[M].北京:中国中医药出版社,1997.244.
[9]黄干,祝彼得,张淑慎.人参总皂甙对小鼠血细胞发生的影响[J].中华血液学杂志,1990,11(1):66~68.
[10]刘秀珍.造血祖细胞培养技术实验手册[M].北京:北京出版社,1993:100,112~114.
[11]王亚平,祝彼得.当归多糖对小鼠巨核细胞-血小板发生的影响[J].中药药理与临床.1992,8(4):13~15.
[12]Clark SC,Kamen R.The human hematopoietic colony-stimulating factor[J].Science,1987,236(4806):1229-1237.
[13]Axeirad AA.Some hemopoietic negative regulators[J].Exp Hematol,1990,18(2):143-150.
[14]陈文杰主编.血液分子细胞生物学[M].北京:中国医药科技出版社,1993.44~51.
[15]成令忠主编.组织学[M].第2版,北京:人民卫生出版社,1994:1055~1059.
【收稿日期】1999-04-13 【修稿日期】1999-09-10, 百拇医药