机械牵张作用对UMR-106细胞骨桥蛋白mRNA和TGF-β1 mRNA表达的影响
作者:刘大为 傅民魁 李盛琳 章魁华 吴燕婉
单位:北京医科大学口腔医学院颌面外科 100081
关键词:原位杂交;牙移动;成骨细胞
中华口腔医学杂志000109 摘 要:目的:探讨机械牵张作用对骨桥蛋白(osteopontin,OPN)mRNA和转化生长因子β1(transforming growth factor beta 1,TGF β1) mRNA表达的影响,说明正畸性骨改建的分子生物学机制。方法:建立体外培养细胞牵张施力模型,利用地高辛标记探针进行原位杂交,结合图象分析技术定量化研究基因表达的相对强度。结果:不同牵张强度和频率作用对OPNmRNA和TGF-β1 mRNA表达影响的差别具有显著性。低强度-低频率作用的影响最为显著,24 h时OPNmRNA的表达强度从0.161 3降低到0.126 1(P<0.05);48 h时TGF-β1 mRNA的表达强度从0.0899增加到0.175 6(P<0.01)。OPN mRNA和TGF-β1 mRNA的表达变化趋势相反。结论:机械牵张作用可显著影响成骨细胞OPNmRNA和TGF-β1 mRNA的表达水平。低强度-低频率刺激对TGF-β1 mRNA表达的影响最显著,支持正畸临床所证明和提倡的持续轻力移动牙齿的原则。
, 百拇医药
Expression of transforming growth factor-β1 mRNA and osteopontin mRNA in UMR-106 cells under mechanical stimulation
LIU Dawei
(Department of Orthodontics,School of Stomatology)
FU Minkui
(Beijing Medical University,Beijing 100081,China)
LI Shenglin
(Beijing Medical University,Beijing 100081,China)
, http://www.100md.com
Abstract:Objective:To investigate the effects of the mechanical stretching on the expression of osteopontin(OPN) mRNA and transforming growth factor-β1 (TGF β1) mRNA in a rat osteosarcoma cell line (UMR-106),and to unveil the cellular mechanism of mechanical force-induced bone remodeling.Methods::An apparatus was designed and fabricated by which force was loaded onto the cultured cells in vitro.Digoxin-labeled cDNA probes were used for in situ hybridization in combination with image analysis technique to relatively quantify the intensities of the hybridization signals.Results::Various magnitudes and durations of the mechanical stretching did exert different influences on the intensities of the mRNAs' expression.Of all the combinations,the low tension/frequency group showed the most remarkable alteration of TGF-β1,as increased from 0.0899 to 0.1756(P<0.01).Some putative relations lay between the expressions of the OPN mRNA and the TGF-β1mRNA.Conclusion::The mechanical stretching can inevitably influence the expression of OPN mRNA and TGF-β1 mRNA.The beneficial alteration obtained in using low tension/frequency action mode suggests and verifies the use of relatively constant and light force to move teeth in clinical orthodontics.
, http://www.100md.com
Key words:In situ hybridization; Tooth movement;Osteoblasts▲
正畸牙移动的实质是机械力诱导的牙周支持组织的塑型与改建过程;其细胞学机制是机械力诱导的包括成骨细胞在内的骨代谢细胞形态与功能的变化。多年来,国内外学者对此进行了广泛研究,提出了各种假说和理论。但到目前为止,研究内容大多限于细胞形态及蛋白质合成方面;尚未见到有关机械牵张作用对骨细胞基因表达影响的报道。为了研究机械力作用对成骨细胞mRNA表达的影响,我们设计并研制了培养细胞牵张施力装置,采用原位杂交技术结合图象分析,对不同机械牵张刺激条件下UMR-106细胞中骨桥蛋白(osteopontin OPN) mRNA和转化生长因子β1(transforming growth factor beta1,TGFβ1) mRNA的表达进行了相对定量化研究,探讨了机械牵张作用对成骨细胞基因表达的影响。
材料与方法
, 百拇医药
1.材料:UMR-106成骨肉瘤细胞株。含10% NBS 的极限必需培养基(α-MEM)。TGF-β1和OPN 2种互补DNA(cDNA)探针由施松涛博士(美国南加州大学)惠赠,片段长度在0.5~1.2 kb之间。地高辛DNA标记与检测试剂盒系德国Boehringer Mannheim公司产品。德国产IBIS-II型多功能图像分析仪。
2.方法:
(1) 培养细胞牵张施力装置的设计与研制:作者设计制作的培养细胞牵张施力装置由3部分组成:①Petriperm弹力膜培养皿;② 机械支持与力量传递系统;③动力系统和变频调节器[频率范围为(10~24)周/min](图1)。工作原理:生长于培养皿内表面的细胞在培养皿底面与倒置凸透镜保持接触的情况下,依弹力膜的弹性形变而被牵拉。牵张作用的幅度与频率通过调整调节丝和预置频率选择而确定。本装置中培养皿可以方便地卸装。施力装置在二氧化碳恒温培养箱中,使细胞的生存环境接近生理状态。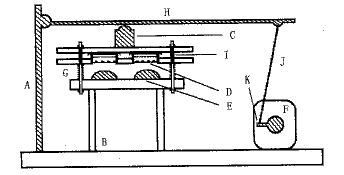
, http://www.100md.com
A 立柱 B 基台 C固定盘
D Petriperm弹力培养皿 E 倒置的透镜
F 电机 G 顶簧 H 横杆
I 竖杆 J 调节丝 K 曲柄
图1 Petriperm弹力膜牵张施力装置结构示意图
为了研究不同幅值和频率条件下机械牵张作用对UMR-106细胞基因表达的影响,本项研究设计了3组不同幅度和频率组合对细胞进行牵张刺激。3组条件分别以[Petriperm弹力膜培养皿中心点垂直位移量(表面面积变化率)+作用频率]表示:A组:5.0 mm (21 %) +24周/min;B组:3.4 mm(14%)+16周/min;C组:1.7 mm(7%)+10周/min。实验中,每个实验组为6个培养皿同时受力。另设等量对照。分别在第12 h、24 h和48 h 3个时间点固定处理细胞,通过原位杂交观察UMR-106细胞中OPN mRNA和TGF-β1 mRNA的表达情况。每个实验观察点取2个培养皿。
, 百拇医药
(2)培养细胞机械牵张作用的施加: 当生长于Petriperm弹力膜培养皿上的细胞密度接近80%(长满状态)时,将培养液换为5 ml含 2%NBS 的α-MEM,培养6 h,以使细胞相对同步化。更换一次5 ml 2% NBS α-MEM培养液;随机选出6个培养皿作为施力组并安装到施力装置上。确定施力幅度和频率,设定后开始施力。对照组培养皿在同一培养箱内培养。在每个观测时间点上,细胞用4%多聚甲醛固定,置于-20℃冰箱中保存。
(3)原位杂交检测mRNA的表达:探针标记以TGF-β1、OPN 2种cDNA片段,按试剂盒说明进行标准标记反应。前期处理:细胞于室温复温后,以0.1 mol PBS洗3次;0.2 mol HCl,室温洗2次;乙醇逐级加水,最后用含有5 mmol氯化镁的PBS漂洗10 min。湿盒中,杂交区用1.0 ng/L蛋白酶K,37℃恒温作用30 min。室温下预杂交液孵育1 h。杂交:将标记后的cDNA探针5 μl,加到500 μl的预杂交液中,配成杂交液。煮沸解链后加入杂交区,每个杂交区30 μl,42℃杂交过夜,反应15~20 h。以缓冲液杂交、洗脱后进行免疫反应检测,显色充分时终止反应;以明胶甘油盖片封固。
, 百拇医药
(4)结果观察与分析: 杂交后48 h内,采用德国产IBIS-II型多功能图像分析仪分别测量杂交区对应于培养皿半径的外1/3、中1/2和内1/3处杂交信号的吸光度(A)值并照相记录;每个区域随机选取3个部位各测量3次,取平均值。采用SPSS 6.0统计分析软件对所得吸光度值进行统计分析,进行组间配对t检验。
结果
1.原位杂交结果的判定: 镜下观察:反应区内杂交信号分布不均。胞浆内、细胞相邻区及胞膜区有弥散分布的细沙样紫兰色点状颗粒。胞核占据大部分细胞面积,呈空亮状(核未复染);杂交信号偶出现于胞核,可能是蛋白酶K浓度过大或作用时间过长,使核膜通透性增加,而形成cDNA探针与基因组DNA间的杂交体(图2)。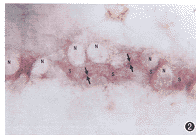
图2 杂交信号的光镜下特征,N 细胞核 ↑ 杂交信号集中的部位 S 杂交信号( ×256)
, 百拇医药
2.不同牵张强度与频率作用下UMR-106细胞mRNA的表达:高强-高频牵张作用[5.0 mm (21%)+24周/min]下,受限于Petriperm弹力膜培养皿本身的机械强度,培养皿经12 h作用后即破裂。结果见表1。但12 h作用后,TGF-β1 mRNA的表达强度从0.008 4增加到0.138 4(P<0.05)。
表1 5.0 mm (21%) + 24周/min条件下
mRNAs的表达强度( ) 组别
) 组别
OPN
TGF-β1*
实验组
0.102157±0.011724
, http://www.100md.com
0.138367±0.008864
对照组
0.096840±0.001234
0.084027±0.005566
注:*P<0.05;OPN:骨桥蛋白,TGF-β1:转化生长因子β1,表内数值均为吸光度值,下表同
中强-中频牵张作用[3.4 mm (14%)+ 16周/min]结果见表2。12和24 h时,OPNmRNA的表达强度分别从0.179 1和0.129 5降低到0.110 0和0.096 1(P<0.05),而12 h时TGF-β1 mRNA的表达强度从0.171 4增加到0.199 9(P<0.05)。
表2 3.4 mm (14%)+16周/min条件下
, http://www.100md.com
mRNAs表达强度( ) 作用时间
) 作用时间
OPN
TGP-β1
12 h
0.110033*
0.199900*
±0.001354
±0.014116
(对照组0.179100
(对照组0.171400
, 百拇医药
±0.011036)
±0.021136)
24 h
0.096110*
0.153633
±0.002876
±0.008801
(对照组0.129500
(对照组0.141400
±0.006136)
±0.020036)
, 百拇医药
注:*P<0.05
低强-低频牵张作用[1.7 mm (7%) + 10周/min]下,两种mRNA的表达情况见表3和图3,4。24 h时OPN mRNA的表达强度从0.161 33降低到0.126 13(P<0.05);而48 h时,TGF-β1 mRNA的表达强度从0.089 9增加到0.175 6(P<0.01)。
表3 1.7 mm (7%) + 10周/min条件下
mRNAs的表达强度(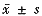 ) 作用时间
) 作用时间
OPN
TGP-β1
12 h
, 百拇医药
0.132567
0.155500
±0.007611
±0.001664
(对照组0.141400
(对照组0.145140
±0.021136)
±0.008216)
24 h
0.126133*
0.160900
, 百拇医药
±0.001089
±0.001555
(对照组0.161332
(对照组0.173311
±0.020536)
±0.020036)
48 h
0.049653
0.089887**
±0.006617
±0.001645
, http://www.100md.com
(对照组0.067400
(对照组0.175633
±0.001360)
±0.004136)
注:*P<0.05,**P<0.01
图3 实验组加力48h后,UMR-106细胞中TGF-β1 mRNA的表达( ×160)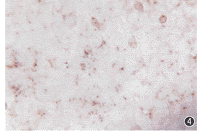
图4 对照组加力48h,UMR-106细胞中TGF-β1 mRNA的表达( ×160)
, http://www.100md.com
讨论
研究细胞受力反应,要求有特定的细胞施力装置。我们采用Petriperm 弹力膜培养皿制成的细胞加力装置,结构简便、施力幅值和频率可灵活选择,充分满足了实验要求。经使用证明是一种有效的培养细胞施力装置。
UMR-106成骨肉瘤细胞系由于具有稳定的成骨细胞表型特征[1],被常规用于实验。作者的研究已证实,其连续传代25次后蛋白及基因表型特征仍很稳定,适合于检测mRNA表达等探索性实验。
到目前为止,借助于各种施力装置,学者们对牵张状态下成骨细胞的形态变化、增殖特点及信号传导途径进行了广泛研究[2-4]。结论认为,机械牵张作用可引起细胞骨架蛋白,尤其是Integrin(结合素)生成量和构象的变化,而这些变化最终可能与基因表达有关[5]。机械刺激对于基因表达影响的研究仅见于Komuro(1991)[6]提出的“应变敏感基因”概念,但未进行深入研究。鉴于体外单层培养细胞杂交反应背景低,原位杂交技术高效敏感,这样就为相对定量化研究机械牵张作用对成骨细胞mRNA表达的影响提供了可能。
, http://www.100md.com
OPN是一种含RGD结构的酸性糖蛋白,存在于骨的活跃沉积和矿化区,是一种能够诱导成熟成骨细胞表型表达并与矿化骨基质密切相关的活性蛋白[7,8] 。Midura[9](1990)报道UMR-106细胞可以合成高硫态骨桥蛋白。但对于OPN mRNA在UMR-106细胞内的表达以往尚未见报道。激素与各种生物活性因子可明显影响OPN的合成与表达[10]。机械力作用对OPN合成的影响尚不清楚。OPN的另一功能为促进细胞的粘附和伸展[11]。有文献报道称OPN定位于细胞膜上,并证明OPN在信号传导和细胞附着中具有一定作用[12]。本项研究结果显示,对于中频-中强施力组,机械牵张可使OPN mRNA表达明显降低。在12 h和24 h,分别从0.179 1和0.129 5降低到0.110 0和0.096 1(P值分别小于0.05和0.01)。而且这种变化随作用时间延长,其显著性逐渐加大。而在低频-低强组中,只有24 h实验点上OPN mRNA的表达出现显著降低,估计与刺激作用较弱有关。我们推测,这可能同牵张刺激造成UMR-106细胞间及细胞与弹力膜表面之间粘附结构的紊乱和破坏有关。由于细胞存在着对刺激的适应和反馈,延长观察时间OPN mRNA表达的减弱可否停止或恢复到原有水平,还有待进一步证实。
, 百拇医药
TGF-β1是一种分子量为25 000的同源二聚体多肽,具有能诱导间充质细胞发生表型转化的重要生物活性[13]。近年研究证明,TGF-β1在许多不同类型细胞中广泛存在并发挥作用[4]。本项实验中,3个牵张施力组的TGF-β1 mRNA表达均有显著性增强。高强-高频组12 h TGF-β1 mRNA表达强度由0.084 0增加到0.138 4(P<0.05);中强-中频组12 h TGF-β1 mRNA表达强度由0.171 4增加到0.199 9(P<0.05);低强-低频组48 h TGF-β1 mRNA表达强度由0.089 9增加到0.175 6(P<0.01)。以低强-低频组48 h的效应最大。这一结果提示,低频率、小力值牵张刺激可最大程度地促进TGF-β1 mRNA的表达,从而促进骨代谢过程。
另外,以往研究发现,对原代及转化成骨细胞而言,TGF-β1不仅可促进骨基质蛋白合成,且对非胶原基质蛋白OPN的合成也有影响,可见在蛋白水平调节上二者具有相关作用。从本项实验结果可见,中强-中频组TGF-β1 mRNA表达增强与OPN mRNA表达减弱同时出现于作用后12 h,而OPNmRNA的变化持续到24 h。对于低强-低频组,TGF-β1 mRNA表达增强出现于48 h,而OPN mRNA表达减弱出现于24 h。提示机械牵张作用下,TGF-β1 mRNA与OPN mRNA的表达变化之间具有一定相关性。
, http://www.100md.com
参考文献:
[1]Nicola CP,Daine Alcorn,Valdo PM,et al.Morphological,biochemical chacterization of four clonol osteogenic sarcoma cell lines of rat origin.Cancer Research,1983,43:4308-4314.
[2]Saito S,Ngan P,Rosol T.Involvement of PGE synthesis in the effect of intermittent pressure and interleukin-1 beta on bone resorption.J Dent Res,1991,70:27-33.
[3]Jorathan RS.DNA changes in mechnically deformed osteoblasts:a new hypothesis.Br J Orthod,1993,20:1-11.
, 百拇医药
[4]Carvalho RS,Scott JE,Suga DM,et al.Stimulation of signal transduction pathways in osteoblasts by mechanical strain potentiated by parathyroid hormone.J Bone Miner Res,1994,9:999-1011.
[5]Carvalho RS,Scott JE,Yen EHK.Cytoskeletal changes in human osteoblastic-like cells induced by mechanical strain in the biological mechanism of tooth eruption,resorption and replacement by implants.edited by Davidovith Z,1994.135-146.
[6]Komuro I,Katoh Y,Kaida T,et al.Mechanical loading stimulates cell hypertrophy and specific gene expression in cultured rat cardiac myocytes.J Biol Chem,1991,266:1265-1268.
, http://www.100md.com
[7]Bulter WT.The nature and significance of osteopontin.Connec Tissue Res,1989,23:123-126.
[8]Weinreb M,Shinar D,Rodan CA.Different pattern of alkaline phosphotase,osteopontin,and osteocalcin expression in developing rat bone visualized by in situ hybridization.J Bone Miner Res,1990,5:831-842.
[9]Midura RJ,McQuillan DJ,Benham KJ.A rat osteogenic cell line(UMR 106-01) synthesizes a highly sulfated form of bone sialoprotein.J Biol Chem,1990,265 :5285-5291.
, 百拇医药
[10]Owen TA,Aronow MS,Barone LM,et al.Pleiotropic effects of vitamine D on osteoblast gene expression are related to the proliferative and differentiated state of the bone cell phynotype:dependency upon basal levels of gene expression ,duration of exposure,and bone matrix competency in normal rat osteoblast cultures.Endocrinology,1991.128:1496-1504.
[11]Rouslahti E,Pierschbacher MD.New perspectives in cell adhesion:RGD and integrins.Science,1987,238:491-496.
, 百拇医药
[12]Owen TA,Aronow M,Shalhoub V,et al.Progressive development of the rat osteoblast phenotype in vitro:reciprocal relationships in expression of genes associated with osteoblast proliferation and differentiation during formation of the bone extracellular matrix.J Cell Physiol,1990,143:420-430.
[13]Van Obberghen SE,Roche NS,Flanders KC,et al.Transforming growth factor-β1 positively regulates its own expression in normal and transformed cells.J Biol Chem,1988,263:7741-7746.
收稿日期:1999-02-30, http://www.100md.com
单位:北京医科大学口腔医学院颌面外科 100081
关键词:原位杂交;牙移动;成骨细胞
中华口腔医学杂志000109 摘 要:目的:探讨机械牵张作用对骨桥蛋白(osteopontin,OPN)mRNA和转化生长因子β1(transforming growth factor beta 1,TGF β1) mRNA表达的影响,说明正畸性骨改建的分子生物学机制。方法:建立体外培养细胞牵张施力模型,利用地高辛标记探针进行原位杂交,结合图象分析技术定量化研究基因表达的相对强度。结果:不同牵张强度和频率作用对OPNmRNA和TGF-β1 mRNA表达影响的差别具有显著性。低强度-低频率作用的影响最为显著,24 h时OPNmRNA的表达强度从0.161 3降低到0.126 1(P<0.05);48 h时TGF-β1 mRNA的表达强度从0.0899增加到0.175 6(P<0.01)。OPN mRNA和TGF-β1 mRNA的表达变化趋势相反。结论:机械牵张作用可显著影响成骨细胞OPNmRNA和TGF-β1 mRNA的表达水平。低强度-低频率刺激对TGF-β1 mRNA表达的影响最显著,支持正畸临床所证明和提倡的持续轻力移动牙齿的原则。
, 百拇医药
Expression of transforming growth factor-β1 mRNA and osteopontin mRNA in UMR-106 cells under mechanical stimulation
LIU Dawei
(Department of Orthodontics,School of Stomatology)
FU Minkui
(Beijing Medical University,Beijing 100081,China)
LI Shenglin
(Beijing Medical University,Beijing 100081,China)
, http://www.100md.com
Abstract:Objective:To investigate the effects of the mechanical stretching on the expression of osteopontin(OPN) mRNA and transforming growth factor-β1 (TGF β1) mRNA in a rat osteosarcoma cell line (UMR-106),and to unveil the cellular mechanism of mechanical force-induced bone remodeling.Methods::An apparatus was designed and fabricated by which force was loaded onto the cultured cells in vitro.Digoxin-labeled cDNA probes were used for in situ hybridization in combination with image analysis technique to relatively quantify the intensities of the hybridization signals.Results::Various magnitudes and durations of the mechanical stretching did exert different influences on the intensities of the mRNAs' expression.Of all the combinations,the low tension/frequency group showed the most remarkable alteration of TGF-β1,as increased from 0.0899 to 0.1756(P<0.01).Some putative relations lay between the expressions of the OPN mRNA and the TGF-β1mRNA.Conclusion::The mechanical stretching can inevitably influence the expression of OPN mRNA and TGF-β1 mRNA.The beneficial alteration obtained in using low tension/frequency action mode suggests and verifies the use of relatively constant and light force to move teeth in clinical orthodontics.
, http://www.100md.com
Key words:In situ hybridization; Tooth movement;Osteoblasts▲
正畸牙移动的实质是机械力诱导的牙周支持组织的塑型与改建过程;其细胞学机制是机械力诱导的包括成骨细胞在内的骨代谢细胞形态与功能的变化。多年来,国内外学者对此进行了广泛研究,提出了各种假说和理论。但到目前为止,研究内容大多限于细胞形态及蛋白质合成方面;尚未见到有关机械牵张作用对骨细胞基因表达影响的报道。为了研究机械力作用对成骨细胞mRNA表达的影响,我们设计并研制了培养细胞牵张施力装置,采用原位杂交技术结合图象分析,对不同机械牵张刺激条件下UMR-106细胞中骨桥蛋白(osteopontin OPN) mRNA和转化生长因子β1(transforming growth factor beta1,TGFβ1) mRNA的表达进行了相对定量化研究,探讨了机械牵张作用对成骨细胞基因表达的影响。
材料与方法
, 百拇医药
1.材料:UMR-106成骨肉瘤细胞株。含10% NBS 的极限必需培养基(α-MEM)。TGF-β1和OPN 2种互补DNA(cDNA)探针由施松涛博士(美国南加州大学)惠赠,片段长度在0.5~1.2 kb之间。地高辛DNA标记与检测试剂盒系德国Boehringer Mannheim公司产品。德国产IBIS-II型多功能图像分析仪。
2.方法:
(1) 培养细胞牵张施力装置的设计与研制:作者设计制作的培养细胞牵张施力装置由3部分组成:①Petriperm弹力膜培养皿;② 机械支持与力量传递系统;③动力系统和变频调节器[频率范围为(10~24)周/min](图1)。工作原理:生长于培养皿内表面的细胞在培养皿底面与倒置凸透镜保持接触的情况下,依弹力膜的弹性形变而被牵拉。牵张作用的幅度与频率通过调整调节丝和预置频率选择而确定。本装置中培养皿可以方便地卸装。施力装置在二氧化碳恒温培养箱中,使细胞的生存环境接近生理状态。

, http://www.100md.com
A 立柱 B 基台 C固定盘
D Petriperm弹力培养皿 E 倒置的透镜
F 电机 G 顶簧 H 横杆
I 竖杆 J 调节丝 K 曲柄
图1 Petriperm弹力膜牵张施力装置结构示意图
为了研究不同幅值和频率条件下机械牵张作用对UMR-106细胞基因表达的影响,本项研究设计了3组不同幅度和频率组合对细胞进行牵张刺激。3组条件分别以[Petriperm弹力膜培养皿中心点垂直位移量(表面面积变化率)+作用频率]表示:A组:5.0 mm (21 %) +24周/min;B组:3.4 mm(14%)+16周/min;C组:1.7 mm(7%)+10周/min。实验中,每个实验组为6个培养皿同时受力。另设等量对照。分别在第12 h、24 h和48 h 3个时间点固定处理细胞,通过原位杂交观察UMR-106细胞中OPN mRNA和TGF-β1 mRNA的表达情况。每个实验观察点取2个培养皿。
, 百拇医药
(2)培养细胞机械牵张作用的施加: 当生长于Petriperm弹力膜培养皿上的细胞密度接近80%(长满状态)时,将培养液换为5 ml含 2%NBS 的α-MEM,培养6 h,以使细胞相对同步化。更换一次5 ml 2% NBS α-MEM培养液;随机选出6个培养皿作为施力组并安装到施力装置上。确定施力幅度和频率,设定后开始施力。对照组培养皿在同一培养箱内培养。在每个观测时间点上,细胞用4%多聚甲醛固定,置于-20℃冰箱中保存。
(3)原位杂交检测mRNA的表达:探针标记以TGF-β1、OPN 2种cDNA片段,按试剂盒说明进行标准标记反应。前期处理:细胞于室温复温后,以0.1 mol PBS洗3次;0.2 mol HCl,室温洗2次;乙醇逐级加水,最后用含有5 mmol氯化镁的PBS漂洗10 min。湿盒中,杂交区用1.0 ng/L蛋白酶K,37℃恒温作用30 min。室温下预杂交液孵育1 h。杂交:将标记后的cDNA探针5 μl,加到500 μl的预杂交液中,配成杂交液。煮沸解链后加入杂交区,每个杂交区30 μl,42℃杂交过夜,反应15~20 h。以缓冲液杂交、洗脱后进行免疫反应检测,显色充分时终止反应;以明胶甘油盖片封固。
, 百拇医药
(4)结果观察与分析: 杂交后48 h内,采用德国产IBIS-II型多功能图像分析仪分别测量杂交区对应于培养皿半径的外1/3、中1/2和内1/3处杂交信号的吸光度(A)值并照相记录;每个区域随机选取3个部位各测量3次,取平均值。采用SPSS 6.0统计分析软件对所得吸光度值进行统计分析,进行组间配对t检验。
结果
1.原位杂交结果的判定: 镜下观察:反应区内杂交信号分布不均。胞浆内、细胞相邻区及胞膜区有弥散分布的细沙样紫兰色点状颗粒。胞核占据大部分细胞面积,呈空亮状(核未复染);杂交信号偶出现于胞核,可能是蛋白酶K浓度过大或作用时间过长,使核膜通透性增加,而形成cDNA探针与基因组DNA间的杂交体(图2)。

图2 杂交信号的光镜下特征,N 细胞核 ↑ 杂交信号集中的部位 S 杂交信号( ×256)
, 百拇医药
2.不同牵张强度与频率作用下UMR-106细胞mRNA的表达:高强-高频牵张作用[5.0 mm (21%)+24周/min]下,受限于Petriperm弹力膜培养皿本身的机械强度,培养皿经12 h作用后即破裂。结果见表1。但12 h作用后,TGF-β1 mRNA的表达强度从0.008 4增加到0.138 4(P<0.05)。
表1 5.0 mm (21%) + 24周/min条件下
mRNAs的表达强度(
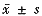 ) 组别
) 组别OPN
TGF-β1*
实验组
0.102157±0.011724
, http://www.100md.com
0.138367±0.008864
对照组
0.096840±0.001234
0.084027±0.005566
注:*P<0.05;OPN:骨桥蛋白,TGF-β1:转化生长因子β1,表内数值均为吸光度值,下表同
中强-中频牵张作用[3.4 mm (14%)+ 16周/min]结果见表2。12和24 h时,OPNmRNA的表达强度分别从0.179 1和0.129 5降低到0.110 0和0.096 1(P<0.05),而12 h时TGF-β1 mRNA的表达强度从0.171 4增加到0.199 9(P<0.05)。
表2 3.4 mm (14%)+16周/min条件下
, http://www.100md.com
mRNAs表达强度(
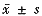 ) 作用时间
) 作用时间OPN
TGP-β1
12 h
0.110033*
0.199900*
±0.001354
±0.014116
(对照组0.179100
(对照组0.171400
, 百拇医药
±0.011036)
±0.021136)
24 h
0.096110*
0.153633
±0.002876
±0.008801
(对照组0.129500
(对照组0.141400
±0.006136)
±0.020036)
, 百拇医药
注:*P<0.05
低强-低频牵张作用[1.7 mm (7%) + 10周/min]下,两种mRNA的表达情况见表3和图3,4。24 h时OPN mRNA的表达强度从0.161 33降低到0.126 13(P<0.05);而48 h时,TGF-β1 mRNA的表达强度从0.089 9增加到0.175 6(P<0.01)。
表3 1.7 mm (7%) + 10周/min条件下
mRNAs的表达强度(
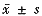 ) 作用时间
) 作用时间OPN
TGP-β1
12 h
, 百拇医药
0.132567
0.155500
±0.007611
±0.001664
(对照组0.141400
(对照组0.145140
±0.021136)
±0.008216)
24 h
0.126133*
0.160900
, 百拇医药
±0.001089
±0.001555
(对照组0.161332
(对照组0.173311
±0.020536)
±0.020036)
48 h
0.049653
0.089887**
±0.006617
±0.001645
, http://www.100md.com
(对照组0.067400
(对照组0.175633
±0.001360)
±0.004136)
注:*P<0.05,**P<0.01

图3 实验组加力48h后,UMR-106细胞中TGF-β1 mRNA的表达( ×160)

图4 对照组加力48h,UMR-106细胞中TGF-β1 mRNA的表达( ×160)
, http://www.100md.com
讨论
研究细胞受力反应,要求有特定的细胞施力装置。我们采用Petriperm 弹力膜培养皿制成的细胞加力装置,结构简便、施力幅值和频率可灵活选择,充分满足了实验要求。经使用证明是一种有效的培养细胞施力装置。
UMR-106成骨肉瘤细胞系由于具有稳定的成骨细胞表型特征[1],被常规用于实验。作者的研究已证实,其连续传代25次后蛋白及基因表型特征仍很稳定,适合于检测mRNA表达等探索性实验。
到目前为止,借助于各种施力装置,学者们对牵张状态下成骨细胞的形态变化、增殖特点及信号传导途径进行了广泛研究[2-4]。结论认为,机械牵张作用可引起细胞骨架蛋白,尤其是Integrin(结合素)生成量和构象的变化,而这些变化最终可能与基因表达有关[5]。机械刺激对于基因表达影响的研究仅见于Komuro(1991)[6]提出的“应变敏感基因”概念,但未进行深入研究。鉴于体外单层培养细胞杂交反应背景低,原位杂交技术高效敏感,这样就为相对定量化研究机械牵张作用对成骨细胞mRNA表达的影响提供了可能。
, http://www.100md.com
OPN是一种含RGD结构的酸性糖蛋白,存在于骨的活跃沉积和矿化区,是一种能够诱导成熟成骨细胞表型表达并与矿化骨基质密切相关的活性蛋白[7,8] 。Midura[9](1990)报道UMR-106细胞可以合成高硫态骨桥蛋白。但对于OPN mRNA在UMR-106细胞内的表达以往尚未见报道。激素与各种生物活性因子可明显影响OPN的合成与表达[10]。机械力作用对OPN合成的影响尚不清楚。OPN的另一功能为促进细胞的粘附和伸展[11]。有文献报道称OPN定位于细胞膜上,并证明OPN在信号传导和细胞附着中具有一定作用[12]。本项研究结果显示,对于中频-中强施力组,机械牵张可使OPN mRNA表达明显降低。在12 h和24 h,分别从0.179 1和0.129 5降低到0.110 0和0.096 1(P值分别小于0.05和0.01)。而且这种变化随作用时间延长,其显著性逐渐加大。而在低频-低强组中,只有24 h实验点上OPN mRNA的表达出现显著降低,估计与刺激作用较弱有关。我们推测,这可能同牵张刺激造成UMR-106细胞间及细胞与弹力膜表面之间粘附结构的紊乱和破坏有关。由于细胞存在着对刺激的适应和反馈,延长观察时间OPN mRNA表达的减弱可否停止或恢复到原有水平,还有待进一步证实。
, 百拇医药
TGF-β1是一种分子量为25 000的同源二聚体多肽,具有能诱导间充质细胞发生表型转化的重要生物活性[13]。近年研究证明,TGF-β1在许多不同类型细胞中广泛存在并发挥作用[4]。本项实验中,3个牵张施力组的TGF-β1 mRNA表达均有显著性增强。高强-高频组12 h TGF-β1 mRNA表达强度由0.084 0增加到0.138 4(P<0.05);中强-中频组12 h TGF-β1 mRNA表达强度由0.171 4增加到0.199 9(P<0.05);低强-低频组48 h TGF-β1 mRNA表达强度由0.089 9增加到0.175 6(P<0.01)。以低强-低频组48 h的效应最大。这一结果提示,低频率、小力值牵张刺激可最大程度地促进TGF-β1 mRNA的表达,从而促进骨代谢过程。
另外,以往研究发现,对原代及转化成骨细胞而言,TGF-β1不仅可促进骨基质蛋白合成,且对非胶原基质蛋白OPN的合成也有影响,可见在蛋白水平调节上二者具有相关作用。从本项实验结果可见,中强-中频组TGF-β1 mRNA表达增强与OPN mRNA表达减弱同时出现于作用后12 h,而OPNmRNA的变化持续到24 h。对于低强-低频组,TGF-β1 mRNA表达增强出现于48 h,而OPN mRNA表达减弱出现于24 h。提示机械牵张作用下,TGF-β1 mRNA与OPN mRNA的表达变化之间具有一定相关性。
, http://www.100md.com
参考文献:
[1]Nicola CP,Daine Alcorn,Valdo PM,et al.Morphological,biochemical chacterization of four clonol osteogenic sarcoma cell lines of rat origin.Cancer Research,1983,43:4308-4314.
[2]Saito S,Ngan P,Rosol T.Involvement of PGE synthesis in the effect of intermittent pressure and interleukin-1 beta on bone resorption.J Dent Res,1991,70:27-33.
[3]Jorathan RS.DNA changes in mechnically deformed osteoblasts:a new hypothesis.Br J Orthod,1993,20:1-11.
, 百拇医药
[4]Carvalho RS,Scott JE,Suga DM,et al.Stimulation of signal transduction pathways in osteoblasts by mechanical strain potentiated by parathyroid hormone.J Bone Miner Res,1994,9:999-1011.
[5]Carvalho RS,Scott JE,Yen EHK.Cytoskeletal changes in human osteoblastic-like cells induced by mechanical strain in the biological mechanism of tooth eruption,resorption and replacement by implants.edited by Davidovith Z,1994.135-146.
[6]Komuro I,Katoh Y,Kaida T,et al.Mechanical loading stimulates cell hypertrophy and specific gene expression in cultured rat cardiac myocytes.J Biol Chem,1991,266:1265-1268.
, http://www.100md.com
[7]Bulter WT.The nature and significance of osteopontin.Connec Tissue Res,1989,23:123-126.
[8]Weinreb M,Shinar D,Rodan CA.Different pattern of alkaline phosphotase,osteopontin,and osteocalcin expression in developing rat bone visualized by in situ hybridization.J Bone Miner Res,1990,5:831-842.
[9]Midura RJ,McQuillan DJ,Benham KJ.A rat osteogenic cell line(UMR 106-01) synthesizes a highly sulfated form of bone sialoprotein.J Biol Chem,1990,265 :5285-5291.
, 百拇医药
[10]Owen TA,Aronow MS,Barone LM,et al.Pleiotropic effects of vitamine D on osteoblast gene expression are related to the proliferative and differentiated state of the bone cell phynotype:dependency upon basal levels of gene expression ,duration of exposure,and bone matrix competency in normal rat osteoblast cultures.Endocrinology,1991.128:1496-1504.
[11]Rouslahti E,Pierschbacher MD.New perspectives in cell adhesion:RGD and integrins.Science,1987,238:491-496.
, 百拇医药
[12]Owen TA,Aronow M,Shalhoub V,et al.Progressive development of the rat osteoblast phenotype in vitro:reciprocal relationships in expression of genes associated with osteoblast proliferation and differentiation during formation of the bone extracellular matrix.J Cell Physiol,1990,143:420-430.
[13]Van Obberghen SE,Roche NS,Flanders KC,et al.Transforming growth factor-β1 positively regulates its own expression in normal and transformed cells.J Biol Chem,1988,263:7741-7746.
收稿日期:1999-02-30, http://www.100md.com