云南省葡萄糖-6-磷酸脱氢酶基因突变型的初步研究
作者:杨昭庆 褚嘉佑 许绍斌 林克勤 陶玉芬 史磊
单位:650118 昆明,中国医学科学院、中国协和医科大学医学生物学研究所遗传室
关键词:葡萄糖磷酸脱氢酶缺乏;基因型;聚合酶链反应
中华血液学杂志001001
【摘要】 目的 分析云南人群中葡萄糖-6-磷酸脱氢酶(G6PD)缺乏症患者的基因突变类型及分布特点。方法 应用自然或错配引物介导的聚合酶链反应/限制性酶切分析方法,检测60例云南籍G6PD缺乏症患者中G1388A、G1376T、C1024T、G392T 、C592T、A95G 6种G6PD基因突变类型。结果 60例G6PD缺乏症患者中,共检出6种G6PD基因突变类型,其中G1388A突变17例(28.3%)、G1376T突变7例(11.7%)、C1024T突变4例(6.7%)、G392T突变1例(1.7%)、C592T突变1例(1.7%)、A95G突变1例(1.7%)、未定型29例(48.3%)。首次发现在云南人群中有C592T突变类型。结论 云南省G6PD基因具有明显异质性。G6PD基因突变类型的研究,为该病的诊断和预防以及人类遗传学研究提供更多的资料和手段。
, 百拇医药
The preliminary study on the gene mutations of sixty patients with G6PD deficiency in Yunnan province
YANG Zhaoqing CHU Jiayou XU Shaobin
(Institute of Medical Biology, CAMS & PUMC, Kunming 650118,China)
【Abstract】 Objective To analyze the types and distribution of glucose-6-phosphate dehydrogenase(G6PD) gene mutations in Yunnan province. Methods By using the natural primers or mis-matched primers mediated polymerase chain reaction (PCR) followed by endonuclease digestion methods, six types of G6PD gene mutations, G1388A, G1376T, C1024T, G392T, C592T and A95G were in sixty patients with G6PD deficiency. Result Six types of mutation were revealed: 28.3% (17 of 60 ) were G1388A, 11.7%(7 of 60) G1376T, 6.7%(4 of 60) C1024T, 1.7%(1 of 60) G392T, 1.7%(1 of 60) C592T, 1.7%(1 of 60) A95G and 48.3% (29 of 60) unidentified. C592T mutation is the first report in Yunnan people. Conclusions The G6PD gene in Yunnan people is heterogeneous. Research of G6PD gene mutation types may provide some useful data for clinical diagnosis and prevention of G6PD deficiency , and for human genetic study.
, 百拇医药
【Key words】 Glucose-6-phosphate dehydrogenase deficiency; Gene; Polymerase chain reaction
葡萄糖-6-磷酸脱氢酶(Glucose-6-phosphate dehydrogenase, G6PD)存在于多种生物细胞中,是催化糖代谢中磷酸戊糖途径第一步反应的看家(house-keeping)酶[1]。由G6PD基因突变所引起的红细胞G6PD缺乏症是最常见的一种X连锁遗传性酶病,临床上表现为药物性溶血、新生儿黄疸等一系列溶血性疾病。该病是我国南方各省最常见的遗传病之一,在云南部分少数民族地区发生率达16.3%[2]。目前已发现G6PD基因突变类型122种[3,4],在中国人中发现了14种[4,5]。我们采用自然引物或错配引物介导的聚合酶链反应(PCR)/限制性酶切分析法,在云南省病例中检测我国所见的6种G6PD基因突变类型,现将结果报道如下。
, 百拇医药
病例和方法
1 研究对象 收集60例无亲缘关系患者,被检者分别来源于云南省西双版纳傣族自治州人民医院、德宏傣族景颇族自治州人民医院、昆明市儿童医院和玉溪地区人民医院,其中男43例,女17例;傣族14例,汉族46例。均经酶活性检测或四氮唑蓝定量法分析,临床诊断为G6PD缺乏症。
2 基因组DNA制备 取外周静脉血3ml,常规分离白细胞,蛋白酶K消化后经酚、酚/氯仿、氯仿/异戊醇抽提,无水乙醇沉淀DNA,TE溶解保存。
3 聚合酶链反应
3.1 扩增引物:引物设计参照Chang等[6]和杨明等[7]的序列,详见表1。
表1 PCR/限制性内切酶分析的引物序列、扩增产物片段长度、限制性内切酶及酶切结果判断 点突变
, 百拇医药
引物序列
扩增片段
(bp)
限制性内切酶
酶切片段大小
(bp)
G1376T
5′-ACGTGAAGCTCCCTGACGC-3′
213
Xho I
N:213
*5′-TGAAAATACGCCAGGCCTCG-3′
, 百拇医药
M:192,21
G1388A
5′-GACCTGACCTACGGCAACAGATAC-3′
361
Nde I
N:361
*5′-GTGCAGCAGTGGGGTGAACATA-3′
M:339,22
A95G
5′-TGTCACCCTGGTGTGAGA-3′
234
, 百拇医药
Sph I
N:234
*5′-CACCGATGCACCCATGATGATGAATG-3′
M:209,25
C1024T
5′-GTCAAGGTGTTGAAATGCAT-3′
229
MboⅡ
N:229
5′-CATGCCCAGTTCTGCCTTGC-3′
M:149,80
, 百拇医药
C592T
5′-TGGAACCGCATCATCGTGGA-3′
123
Pst I
N:79,44
*5′-GCCCAGGTAGTGGTCGCTG-3′
M:62,44,17
G392T
5′-GGACTCAAAGAGAGGGGCTG-3′
202
BstEⅡ
, http://www.100md.com
N:182,20
*5′-AGAGGCGGTTGGCCGGTGAC-3′
M:202
注:N为正常;M为突变;*为错配引物,有下划线碱基为人工引入的错配碱基,其余为自然引物3.2 PCR体系:10×反应缓冲液(100mmol/L Tris-HCl,pH 8.8,500mmol/L KCl,体积分数为0.8%的乙基苯基聚乙二醇)2.5μl,2.5mmol/L dNTPs 2.0μl,25mmol/L MgCl2 2.0μl,上下游引物各12.5pmol/L,Taq DNA聚合酶2U,基因组DNA 100ng,加去离子水至总体积25μl。反应混合物经95℃ 5min变性后,以94℃变性 30s,退火45s,退火温度依据引物Tm值计算(58~61℃),72℃ 延伸1min,共35个循环,最后72℃延伸10min,4℃保存。
, 百拇医药
3.3 PCR产物分析: 取PCR产物5μl与1μl上样缓冲液(0.75mmol/L溴酚蓝,0.93mmol/L二甲苯蓝FF,体积分数为30%的甘油)混合上样,于20g/L琼脂糖凝胶中进行电泳。电泳后凝胶经0.5mg/L 溴化乙锭染色,于紫外透射仪上观察并摄影。
4 酶切与电泳 取PCR产物5μl,加限制性内切酶5U及相应缓冲液,反应总体积为20μl。分析各个突变型使用的限制性内切酶及相应的酶切结果判断见表1。酶切时间为2~5h。取酶切产物10μl与1μl上样缓冲液混合上样,用80g/L聚丙烯酰胺凝胶(29∶1)电泳,凝胶经11.8mmol/L硝酸银染色,显色后判断结果。
结果
经琼脂糖凝胶电泳分析,用自然引物或错配引物进行扩增均得到了预定的特异性片段。PCR产物经相应限制性酶切、聚丙稀酰胺凝胶电泳,经银染色后得到的的酶切图谱如图1所示。各突变型所产生的特异性DNA条带与表1所述相同。由于凝胶长度所限,小于30bp的DNA片段未能在图1中显示。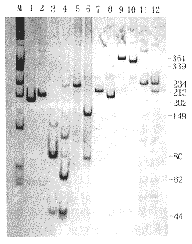
, 百拇医药
M:DNA 分子量标准 φX174/HaeⅢ; 1,3,5,7,9,11:
依次为G392T、C592T、C1024T、G1376T、G1388A、A95G突变型的阴性结果;
2,4,6,8,10,12:分别为上述各突变的阳性结果(12有酶切不完全现象)
图1 6种G6PD基因突变限制性酶切分析电泳图
60例G6PD缺乏症病例中,有31例(占51.7%)检出上述6种G6PD基因点突变中的1种,各突变类型的分布比例见表2。
表2 云南省G6PD基因突变型及分布比例 突变类型
氨基酸置换
例数
, 百拇医药
百分率
(%)
傣族
汉族
合计
G1388A
Arg→His
6
11
17
28.3
G1376T
Arg→Leu
, 百拇医药
3
4
7
11.7
C1024T
Leu→Phe
0
4
4
6.7
A95G
His→Arg
0
, 百拇医药
1
1
1.7
G392T
Gly→Val
0
1
1
1.7
C592T
Arg→Cys
0
1
, http://www.100md.com
1
1.7
未确定
5
14
29
48.3
讨论 我们研究的这组病例是云南省目前例数较多、地区分布较广的一组,采用自然或错配引物PCR/限制性酶切的方法进行分析,结果表明云南省存在G1388A、G1376T、C1024T、G392T 、C592T、A95G 6种G6PD基因突变类型。 除了蒋玮莹等[8]报道的5种突变类型外,我们证实在云南省人群中还存在C592T突变类型,这一结果目前尚未见国内外文献报道。
我国广东[9]、广西[10]、贵州[7]、台湾[6],以及新加坡[11]的资料表明,G1376T和G1388A是中国人G6PD缺乏症最常见的基因突变类型。国内其它地区均以G1376T所占比例最高,其次是G1388A和A95T。虽然有部分病例尚未确定突变类型,但从我们的结果仍可看出云南省的G6PD基因突变类型以G1388A(28.3%)较为多见,而A95G少见,这一结果与国内其他学者对少量云南病例的研究结果相似。不同地区G6PD基因突变型分布明显不同,表明G6PD基因突变具有较高的遗传多态性。
, http://www.100md.com
G6PD突变型与种族起源关系密切。G1376T、G1388A突变目前只在中国、老挝、越南、新加坡黄种人中发现,而未见于白种人及美洲黑人,提示这两种突变可能起源于共同祖先。中国人群,尤其是南方人群与东南亚人群关系密切。在中国人群中,汉族、傣族等多个民族群体中均存在G1376T、G1388A、C592T、G392T等突变,这可能是因为存在某些突变热点(尤其在G6P和NADP结合位点附近),或者这些民族群体间存在基因交流。 云南省具有较多的G1388A突变类型,可能是因为最早迁入该地区的居民较多具有该突变,加之云南山区多、交通不便,形成长期隔离繁殖,保留了较高频率的G1388A突变。G6PD基因突变与自然选择关系密切,尤其是对疟疾的抗性遗传[12]。云南是疟疾的高发区,高频率的G1388A突变也可能与早期偶然突变获得的对疟疾的抗性遗传优势有关。
G6PD缺乏症是我国南方各省常见的酶病,该病的根本原因是基因突变,对各种G6PD突变基因型的研究不仅从DNA水平揭示酶缺陷的原因,也为诊断、预防以及人类遗传研究提供更多的资料和手段。
, http://www.100md.com
志谢: 中山医科大学医学遗传学研究室杜传书教授对研究工作给予了技术支持,特此致谢
基金项目:国家自然科学基金重大项目基金资助项目(39993420);美国中华医学基金会资助项目(98-675)
参 考 文 献
1,Sanders S, Smith DP, Thomas GA, et al. A glucose-6-phosphate dehydrogenase (G6PD) splice site consensus sequence mutation associated with G6PD enzyme deficiency. Mutation Res, 1997, 374:79-87.
2,张铀,褚嘉佑,何勤,等. 应用G6PD/6PGD比值法检测云南勐腊县6-磷酸脱氢酶缺乏症的基因频率. 中国优生与遗传杂志,1995,3:25-26.
, 百拇医药
3, Beutler E, Vulliamy T, Luzzatto L. Hematologically important mutation: glucose-6-phosphate dehydrogenase. Blood Cells Mol Dis , 1996, 22:49-56.
4, Vulliamy T, Luzzatto L, Hirono A, et al. Hematologically important mutations:glucose-6-phosphate dehydrogenase. Blood Cells Mol Dis, 1997, 23:302-313.
5, 宋力. 中国人群葡萄糖-6-磷酸脱氢酶基因突变的分析与进展. 中国优生与遗传杂志,1998, 6:119-121.
6, Chang JG, Chious SS, Perng LI, et al. Molecular characterization of glucose-6-phosphate dehydrogenase(G6PD) deficiency by natural and amplification created restriction sites: five mutations account for most G6PD deficiency cases in Taiwan. Blood, 1992, 80:1079-1082.
, http://www.100md.com
7, 杨明,杜传书. 贵州省黔西县葡糖-6-磷酸脱氢酶基因突变型研究. 中华血液学杂志,1996,17:188-191.
8, 蒋玮莹,杜传书. 云南傣族中所见的G6PD突变型. 遗传,1997, 19:33-35.
9, 唐东江,马燮琴,宋诚燕,等. 干血纸片法用于广东人G6PD基因点突变筛查研究. 中华血液学杂志, 1998,19:189-191.
10, 谢建生,龙桂芳,唐智宁,等. 广西地区葡萄糖-6-磷酸脱氢酶缺乏症基因突变研究. 中华医学遗传学杂志,1998, 15:151-154.
11, Saha S, Saha N, Tay JSH, et al . Molecular characterization of red cell glucose-6-phosphate dehydrogenase deficiency in Singapore Chinese. Am J Hematol, 1994, 47:273-277.
12,Ruwende C, Hill A. Glucose-6-phosphate dehydrogenase deficiency and malaria. J Mol Med, 1998, 76:581-588.
(收稿日期:1999-10-08), 百拇医药
单位:650118 昆明,中国医学科学院、中国协和医科大学医学生物学研究所遗传室
关键词:葡萄糖磷酸脱氢酶缺乏;基因型;聚合酶链反应
中华血液学杂志001001
【摘要】 目的 分析云南人群中葡萄糖-6-磷酸脱氢酶(G6PD)缺乏症患者的基因突变类型及分布特点。方法 应用自然或错配引物介导的聚合酶链反应/限制性酶切分析方法,检测60例云南籍G6PD缺乏症患者中G1388A、G1376T、C1024T、G392T 、C592T、A95G 6种G6PD基因突变类型。结果 60例G6PD缺乏症患者中,共检出6种G6PD基因突变类型,其中G1388A突变17例(28.3%)、G1376T突变7例(11.7%)、C1024T突变4例(6.7%)、G392T突变1例(1.7%)、C592T突变1例(1.7%)、A95G突变1例(1.7%)、未定型29例(48.3%)。首次发现在云南人群中有C592T突变类型。结论 云南省G6PD基因具有明显异质性。G6PD基因突变类型的研究,为该病的诊断和预防以及人类遗传学研究提供更多的资料和手段。
, 百拇医药
The preliminary study on the gene mutations of sixty patients with G6PD deficiency in Yunnan province
YANG Zhaoqing CHU Jiayou XU Shaobin
(Institute of Medical Biology, CAMS & PUMC, Kunming 650118,China)
【Abstract】 Objective To analyze the types and distribution of glucose-6-phosphate dehydrogenase(G6PD) gene mutations in Yunnan province. Methods By using the natural primers or mis-matched primers mediated polymerase chain reaction (PCR) followed by endonuclease digestion methods, six types of G6PD gene mutations, G1388A, G1376T, C1024T, G392T, C592T and A95G were in sixty patients with G6PD deficiency. Result Six types of mutation were revealed: 28.3% (17 of 60 ) were G1388A, 11.7%(7 of 60) G1376T, 6.7%(4 of 60) C1024T, 1.7%(1 of 60) G392T, 1.7%(1 of 60) C592T, 1.7%(1 of 60) A95G and 48.3% (29 of 60) unidentified. C592T mutation is the first report in Yunnan people. Conclusions The G6PD gene in Yunnan people is heterogeneous. Research of G6PD gene mutation types may provide some useful data for clinical diagnosis and prevention of G6PD deficiency , and for human genetic study.
, 百拇医药
【Key words】 Glucose-6-phosphate dehydrogenase deficiency; Gene; Polymerase chain reaction
葡萄糖-6-磷酸脱氢酶(Glucose-6-phosphate dehydrogenase, G6PD)存在于多种生物细胞中,是催化糖代谢中磷酸戊糖途径第一步反应的看家(house-keeping)酶[1]。由G6PD基因突变所引起的红细胞G6PD缺乏症是最常见的一种X连锁遗传性酶病,临床上表现为药物性溶血、新生儿黄疸等一系列溶血性疾病。该病是我国南方各省最常见的遗传病之一,在云南部分少数民族地区发生率达16.3%[2]。目前已发现G6PD基因突变类型122种[3,4],在中国人中发现了14种[4,5]。我们采用自然引物或错配引物介导的聚合酶链反应(PCR)/限制性酶切分析法,在云南省病例中检测我国所见的6种G6PD基因突变类型,现将结果报道如下。
, 百拇医药
病例和方法
1 研究对象 收集60例无亲缘关系患者,被检者分别来源于云南省西双版纳傣族自治州人民医院、德宏傣族景颇族自治州人民医院、昆明市儿童医院和玉溪地区人民医院,其中男43例,女17例;傣族14例,汉族46例。均经酶活性检测或四氮唑蓝定量法分析,临床诊断为G6PD缺乏症。
2 基因组DNA制备 取外周静脉血3ml,常规分离白细胞,蛋白酶K消化后经酚、酚/氯仿、氯仿/异戊醇抽提,无水乙醇沉淀DNA,TE溶解保存。
3 聚合酶链反应
3.1 扩增引物:引物设计参照Chang等[6]和杨明等[7]的序列,详见表1。
表1 PCR/限制性内切酶分析的引物序列、扩增产物片段长度、限制性内切酶及酶切结果判断 点突变
, 百拇医药
引物序列
扩增片段
(bp)
限制性内切酶
酶切片段大小
(bp)
G1376T
5′-ACGTGAAGCTCCCTGACGC-3′
213
Xho I
N:213
*5′-TGAAAATACGCCAGGCCTCG-3′
, 百拇医药
M:192,21
G1388A
5′-GACCTGACCTACGGCAACAGATAC-3′
361
Nde I
N:361
*5′-GTGCAGCAGTGGGGTGAACATA-3′
M:339,22
A95G
5′-TGTCACCCTGGTGTGAGA-3′
234
, 百拇医药
Sph I
N:234
*5′-CACCGATGCACCCATGATGATGAATG-3′
M:209,25
C1024T
5′-GTCAAGGTGTTGAAATGCAT-3′
229
MboⅡ
N:229
5′-CATGCCCAGTTCTGCCTTGC-3′
M:149,80
, 百拇医药
C592T
5′-TGGAACCGCATCATCGTGGA-3′
123
Pst I
N:79,44
*5′-GCCCAGGTAGTGGTCGCTG-3′
M:62,44,17
G392T
5′-GGACTCAAAGAGAGGGGCTG-3′
202
BstEⅡ
, http://www.100md.com
N:182,20
*5′-AGAGGCGGTTGGCCGGTGAC-3′
M:202
注:N为正常;M为突变;*为错配引物,有下划线碱基为人工引入的错配碱基,其余为自然引物3.2 PCR体系:10×反应缓冲液(100mmol/L Tris-HCl,pH 8.8,500mmol/L KCl,体积分数为0.8%的乙基苯基聚乙二醇)2.5μl,2.5mmol/L dNTPs 2.0μl,25mmol/L MgCl2 2.0μl,上下游引物各12.5pmol/L,Taq DNA聚合酶2U,基因组DNA 100ng,加去离子水至总体积25μl。反应混合物经95℃ 5min变性后,以94℃变性 30s,退火45s,退火温度依据引物Tm值计算(58~61℃),72℃ 延伸1min,共35个循环,最后72℃延伸10min,4℃保存。
, 百拇医药
3.3 PCR产物分析: 取PCR产物5μl与1μl上样缓冲液(0.75mmol/L溴酚蓝,0.93mmol/L二甲苯蓝FF,体积分数为30%的甘油)混合上样,于20g/L琼脂糖凝胶中进行电泳。电泳后凝胶经0.5mg/L 溴化乙锭染色,于紫外透射仪上观察并摄影。
4 酶切与电泳 取PCR产物5μl,加限制性内切酶5U及相应缓冲液,反应总体积为20μl。分析各个突变型使用的限制性内切酶及相应的酶切结果判断见表1。酶切时间为2~5h。取酶切产物10μl与1μl上样缓冲液混合上样,用80g/L聚丙烯酰胺凝胶(29∶1)电泳,凝胶经11.8mmol/L硝酸银染色,显色后判断结果。
结果
经琼脂糖凝胶电泳分析,用自然引物或错配引物进行扩增均得到了预定的特异性片段。PCR产物经相应限制性酶切、聚丙稀酰胺凝胶电泳,经银染色后得到的的酶切图谱如图1所示。各突变型所产生的特异性DNA条带与表1所述相同。由于凝胶长度所限,小于30bp的DNA片段未能在图1中显示。

, 百拇医药
M:DNA 分子量标准 φX174/HaeⅢ; 1,3,5,7,9,11:
依次为G392T、C592T、C1024T、G1376T、G1388A、A95G突变型的阴性结果;
2,4,6,8,10,12:分别为上述各突变的阳性结果(12有酶切不完全现象)
图1 6种G6PD基因突变限制性酶切分析电泳图
60例G6PD缺乏症病例中,有31例(占51.7%)检出上述6种G6PD基因点突变中的1种,各突变类型的分布比例见表2。
表2 云南省G6PD基因突变型及分布比例 突变类型
氨基酸置换
例数
, 百拇医药
百分率
(%)
傣族
汉族
合计
G1388A
Arg→His
6
11
17
28.3
G1376T
Arg→Leu
, 百拇医药
3
4
7
11.7
C1024T
Leu→Phe
0
4
4
6.7
A95G
His→Arg
0
, 百拇医药
1
1
1.7
G392T
Gly→Val
0
1
1
1.7
C592T
Arg→Cys
0
1
, http://www.100md.com
1
1.7
未确定
5
14
29
48.3
讨论 我们研究的这组病例是云南省目前例数较多、地区分布较广的一组,采用自然或错配引物PCR/限制性酶切的方法进行分析,结果表明云南省存在G1388A、G1376T、C1024T、G392T 、C592T、A95G 6种G6PD基因突变类型。 除了蒋玮莹等[8]报道的5种突变类型外,我们证实在云南省人群中还存在C592T突变类型,这一结果目前尚未见国内外文献报道。
我国广东[9]、广西[10]、贵州[7]、台湾[6],以及新加坡[11]的资料表明,G1376T和G1388A是中国人G6PD缺乏症最常见的基因突变类型。国内其它地区均以G1376T所占比例最高,其次是G1388A和A95T。虽然有部分病例尚未确定突变类型,但从我们的结果仍可看出云南省的G6PD基因突变类型以G1388A(28.3%)较为多见,而A95G少见,这一结果与国内其他学者对少量云南病例的研究结果相似。不同地区G6PD基因突变型分布明显不同,表明G6PD基因突变具有较高的遗传多态性。
, http://www.100md.com
G6PD突变型与种族起源关系密切。G1376T、G1388A突变目前只在中国、老挝、越南、新加坡黄种人中发现,而未见于白种人及美洲黑人,提示这两种突变可能起源于共同祖先。中国人群,尤其是南方人群与东南亚人群关系密切。在中国人群中,汉族、傣族等多个民族群体中均存在G1376T、G1388A、C592T、G392T等突变,这可能是因为存在某些突变热点(尤其在G6P和NADP结合位点附近),或者这些民族群体间存在基因交流。 云南省具有较多的G1388A突变类型,可能是因为最早迁入该地区的居民较多具有该突变,加之云南山区多、交通不便,形成长期隔离繁殖,保留了较高频率的G1388A突变。G6PD基因突变与自然选择关系密切,尤其是对疟疾的抗性遗传[12]。云南是疟疾的高发区,高频率的G1388A突变也可能与早期偶然突变获得的对疟疾的抗性遗传优势有关。
G6PD缺乏症是我国南方各省常见的酶病,该病的根本原因是基因突变,对各种G6PD突变基因型的研究不仅从DNA水平揭示酶缺陷的原因,也为诊断、预防以及人类遗传研究提供更多的资料和手段。
, http://www.100md.com
志谢: 中山医科大学医学遗传学研究室杜传书教授对研究工作给予了技术支持,特此致谢
基金项目:国家自然科学基金重大项目基金资助项目(39993420);美国中华医学基金会资助项目(98-675)
参 考 文 献
1,Sanders S, Smith DP, Thomas GA, et al. A glucose-6-phosphate dehydrogenase (G6PD) splice site consensus sequence mutation associated with G6PD enzyme deficiency. Mutation Res, 1997, 374:79-87.
2,张铀,褚嘉佑,何勤,等. 应用G6PD/6PGD比值法检测云南勐腊县6-磷酸脱氢酶缺乏症的基因频率. 中国优生与遗传杂志,1995,3:25-26.
, 百拇医药
3, Beutler E, Vulliamy T, Luzzatto L. Hematologically important mutation: glucose-6-phosphate dehydrogenase. Blood Cells Mol Dis , 1996, 22:49-56.
4, Vulliamy T, Luzzatto L, Hirono A, et al. Hematologically important mutations:glucose-6-phosphate dehydrogenase. Blood Cells Mol Dis, 1997, 23:302-313.
5, 宋力. 中国人群葡萄糖-6-磷酸脱氢酶基因突变的分析与进展. 中国优生与遗传杂志,1998, 6:119-121.
6, Chang JG, Chious SS, Perng LI, et al. Molecular characterization of glucose-6-phosphate dehydrogenase(G6PD) deficiency by natural and amplification created restriction sites: five mutations account for most G6PD deficiency cases in Taiwan. Blood, 1992, 80:1079-1082.
, http://www.100md.com
7, 杨明,杜传书. 贵州省黔西县葡糖-6-磷酸脱氢酶基因突变型研究. 中华血液学杂志,1996,17:188-191.
8, 蒋玮莹,杜传书. 云南傣族中所见的G6PD突变型. 遗传,1997, 19:33-35.
9, 唐东江,马燮琴,宋诚燕,等. 干血纸片法用于广东人G6PD基因点突变筛查研究. 中华血液学杂志, 1998,19:189-191.
10, 谢建生,龙桂芳,唐智宁,等. 广西地区葡萄糖-6-磷酸脱氢酶缺乏症基因突变研究. 中华医学遗传学杂志,1998, 15:151-154.
11, Saha S, Saha N, Tay JSH, et al . Molecular characterization of red cell glucose-6-phosphate dehydrogenase deficiency in Singapore Chinese. Am J Hematol, 1994, 47:273-277.
12,Ruwende C, Hill A. Glucose-6-phosphate dehydrogenase deficiency and malaria. J Mol Med, 1998, 76:581-588.
(收稿日期:1999-10-08), 百拇医药