TGF-β1对人牙髓细胞内钙影响的激光共聚焦显微镜动态观察
作者:王景杰 牛忠英 倪龙兴 王春梅
单位:王景杰(第四军医大学口腔医学院口腔内科 710032);牛忠英(第四军医大学口腔医学院口腔内科 710032);倪龙兴(第四军医大学口腔医学院口腔内科 710032);王春梅(第四军医大学电镜中心)
关键词:转化生长因子β;牙髓细胞; 激光扫描共聚焦显微镜
实用口腔医学杂志000307〔摘要〕 目的:探讨TGF-β1信号转导过程与人牙髓细胞内钙〔(Ca2 + )i〕的关系。方法:体外培养人牙髓细胞经钙荧光指示剂Fluo-3负载后,用激光扫描共聚焦显微镜测定TGF-β1影响前后的人牙髓细胞内钙随时间变化情况。结果:TGF-β1(0.1 ng/L)使人牙髓细胞内钙先升高后降低,最后维持 在比加药前稍高的静息钙水平上。结论:通过TGF-β可引起牙髓细 胞内Ca2+水平的显著变化,证明Ca2+参与了人牙髓细胞TGF-β1信号转导过 程并参与将信号转入核内。
, 百拇医药
中图分类号:R781.3 文献标识码:A
文章编号:1001-3733(2000)03-0192-04
A dynamic observation of the effects of TGF-β1 on intracellular calcium in
cultured human pulp cells with laser scanning confocal microscopy
Wang Jingjie,Niu Zhongying, Ni Longxing.
(Stomatological College,Fourth Mili tary Medical University,Xi'an 710032)
, 百拇医药
〔Abstract〕Objective: To investigate the relationship between TGF- β1 message tr ansduction process and changes of intracellular calcium in human pulp cells. Methods: Human pulp cells were cultured with TGF -β1 and intracellular calcium level was measured with t he fluorescent Ca2+ indicator Fluo-3 and lase r scanning confocal microscopy. Results: After being treat ed with TGF-β1(0.1 ng/L), intracellular calcium in human pulp cell increased (P< 0.01) and then decreased (P<0.05). At last, it came to a higher level of res ting intracellular calcium. Conclusio n : Calcium participates in the process of TGF-β1 message transdu ction.
, 百拇医药
Key Words Transforming grouth facfor beta,Dental pulp;Cell; Las er scanning confocal microscopy(LSCM)▲
钙离子作为细胞内信号转导的第二信使参与诸如肌肉收缩、神经传导以及细胞增殖与分 化等多种重要生理活动,细胞内钙离子浓度变化是细胞重要的信息系统,细胞在外界或不同 生理、病理状态下胞内钙离子浓度都会发生相应变化。
牙髓细胞或部分牙髓细胞具有分化成成牙本质细胞及生成牙本质的潜能,牙髓细胞在其分化 、增殖及矿化过程中受包括多种生长因子在内的多因素的调节,各种因素引起的细胞内钙的 不同变化是牙髓细胞增殖、分化以及矿化的重要环节。转化生长因子β(Transforming gro wth factor-β,TGF-β)对人牙髓细胞增殖具有双向调节功能〔1,2〕,在牙本质 修复过程中 对牙髓细胞向成牙本质细胞分化有重要促进作用〔3〕。本研究采用体外培养牙 髓细胞, 利用激光共聚焦显微镜(Laser scanning confocal microscope,LSCM)动态观察TGFβ1 对牙 髓细胞内Ca2+浓度的影响,为进一步探明TGFβ1对牙髓细胞调节的信号转导机制提 供依据,为研究牙髓细胞分化及牙本质形成机制奠定基础。
, http://www.100md.com
1 材料和方法
1.1 试剂
D-Hank液(g/L):NaCl 8.00, KCl 0.40, Na2HPO·4.12H2O 0.12, KH2PO4 0.06 , D-Glucose 1.00,NaHCO3 0.35,采用国产分析纯试剂和超纯水(18.2 MΩcm)配制。Fluo -3/AM系美国BIO-RAD产品;胰蛋白酶由华美生物工程公司购得;小 牛 血清由杭州四季青生物工程材料研究所提供;DMEM培养基由美国GIBCO公司提供,TGF-β 1系美国PROMEGA公司产品。
1.2 牙髓细胞培养
选13~20岁因正畸或阻生拔除的完整新鲜恒牙(第一前磨牙及第三磨牙),劈冠取出牙髓组 织,剪成1 mm3碎块,铺于培养瓶底,以含体积分数(φ)为10%胎牛血清(FBS)的DMEM培 养液,φ(CO2为5%,φ(空气)=95%,饱和湿度,37 ℃孵育做原代培养,取生长良好的第 4代牙髓细胞接种在特制培养皿中 ,接种浓度2.5×108/L,细胞贴壁后进行实验。
, 百拇医药
1.3 实验分组(每组复种两个培养皿)
对照组:φ(FBS)=10%的DMEM
实验组:用φ(FBS)=10%的DMEM配制的质量浓度为0.1 ng/L的TGF-β1溶液
1.4 牙髓细胞内Ca2+测定
1.4.1 测定原理 Fluo-3能特异性地与钙离子结合,并在一定 波长激发光激发后产生荧光,且与钙离子结合后其荧光光谱发生变化,其荧光强度与Ca 2+浓 度成正比,因而可用于观察Ca2+动态变化〔4〕。但Fluo-3为极性大的酸性化 合物,难以进入 细胞,而当其结合上亲酯的乙酰羟甲基酯成为脂溶性的Fluo-3/AM,再与细胞孵育时,便很 容易透过细胞膜,胞浆内的非特异性酯酶将其脂解脱去脂基生成游离的Fluo-3。
, http://www.100md.com
1.4.2 D-Hank液(pH7.4)洗涤标本2次后,于37 ℃避光条件下用D-Hank液稀释的Fluo -3/AM(10 μmol/L)荷载,40 min后再用D-Hank液洗涤细胞3次,最后保留少许细胞外 D-Hank液平衡10 min〔5〕,LSCM下观察。
1.4.3 激光共聚焦图像 LSCM能对活细胞内部的离子分 布及随时间的变化进行成像及测量。本实验使用的是BIO-RAD公司的MRC-1024 LSCM。在 观察C a2+快速变化时,可选线扫方式,其采样频率为488 Hz,与Ca2+结合的Fluo-3 可以被488 nm的 氩离子激光激发,可在525 nm处探测到荧光发射,其荧光强度的变化可指示胞内游离钙浓度 的相对变化。
1.4.4 加药 在LSCM下选好细胞后,用微量加药器将实验条件要求的试剂滴加在培养皿 中,试剂扩散后进行观察
, http://www.100md.com
1.5 实验数据的处理
数据均用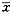 ±s 表示,数据分析软件为SPSS软件。
±s 表示,数据分析软件为SPSS软件。
2 结 果
2.1 加药前实验组(n=8)与对照组(n=6)牙髓细胞〔Ca2+〕i水平无明显 差异:Ca2+含量少、荧 光强度弱,分布较均匀(图1)。加药后实验组荧光强度随时间明显变化而对照组无明显变 化(图2,3)。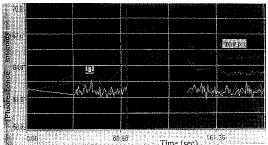
图1 实验组加药前牙髓细胞内钙含量(LSCM,×400)
2.2 实验组牙髓细胞加入TGFβ(0.1 ng/L)后10 s,胞内Ca2+开始上升,经18 s后达 最高峰,此时荧光最强且分布不均,其中核周荧光最强(图4)持续50 s后开始下降,经45 s后钙离子浓度趋于平稳,但其水平仍稍高于加药前静息钙水平(图5)。其中,实验组荧光 强度最大(4.6±0.02)时所代表的细胞内Ca2+水平与对照组(1.5±0.01)具有显著差异 (P<0.01),且实验组加药后静息荧光强度(2.8±0.01)所代表的胞内Ca2+水平 与对照组(1.5±0.01)Ca2+水平也差别显著(P<0.01)。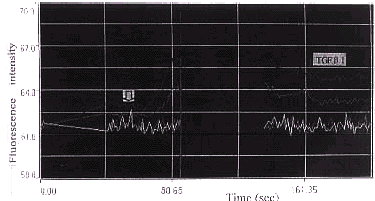
, http://www.100md.com
图2 TGF-β1对牙髓细胞内钙的影响( 为加药处)
为加药处)
图中下线为基线,上两条线是两个不同细胞的荧光强度变化线
图3 实验组和对照组牙髓细胞内钙随时间变化曲线(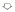 为加药处)
为加药处)
3 讨 论
钙离子既是细胞内信号转导的信使,又是骨、牙齿等硬组织的基本成分,其沉积引发的矿化是在严格的细胞控制下 完成的。研究表明,体外培养牙髓 细胞具有潜在的分化为成牙本质细胞及发生矿化的能力〔6〕,而牙髓细胞内Ca2 +水平能够反应出细胞的状态、药物、胞外环境对细胞的 影响〔7〕。因此,研究体 外培养牙髓细胞内Ca2+浓度变化对研究牙髓细胞分化的诱导及矿化具有重要意义。
, 百拇医药
图4 牙髓细胞加入TGF-β1 28 s后细胞内钙英光显示图(LSCM,×400)
图5 牙髓细胞加入TGFβ1 2min后〔Ca2+〕i水平
(LSCM,×400)
3.1 关于本研究的测量技术
目前测量细胞内钙的方法有:①钙离子选择微电极法,但该方法对于较小细胞内 的操作较难且微电极反应时间较长;②放射示踪法,该方法可定性定量分析细胞内外Ca 2+变化,主要 用于测定跨膜Ca2+流动及代谢动力学变化,但对细胞静息Ca2+浓度测定操作复 杂且效果不理想;③荧光标记示踪法,由于细胞内钙荧光指示剂的发现和其性能的不断完善 , 该方法日见其优越性。Fluo-3作为第3代荧光指示剂,是唯一在可见光区有激发峰的荧光 剂 ,可以避免紫外光对细胞的损害和激发自发荧光倾向,它与Ca2+结合后荧光强度增加 40倍,因此在观察Ca2+的空间分布和快速时间变化方面,Fluo-3的性能是目前最好 的 ,加之有激光共聚焦扫描技术配合,使细胞内甚至细胞器内Ca2+的空间和时间变化的 测定更加完善。
, http://www.100md.com
3.2 TGF-β1对牙髓细胞内Ca2+的影响
通常情况下,由于细胞内存在丰富的钙平衡系统,故可维持比细胞外低5000~10000倍的Ca 2+ 浓度〔9〕,但当细胞受到不同外界刺激时其细胞内钙会发生一定的变化。本实验结 果显示, TGF-β1可使牙髓细胞内Ca2+先升高后降低。一般来说,细胞内钙升高机 制 有以下三种:①通过IP3引起细胞内质网、线粒体中Ca2+释放入细胞浆;②神经冲 动使 电压依赖性钙通道开放,Ca2+内流;③通过cAMP激活APK使钙通道磷酸化而变构开放〔8〕。而TGF-β的3种受体都含有丝氨酸-苏氨酸序列,并且TGF-βRI和TGF-βRII 具有内在丝氨酸-苏氨酸激酶活性〔9〕。 因此,TGF-β作用的可能机制是TGF-β与其受体结合后,受体被激活,从而活化PLC,后 者可 催化PIP2分解为DG和IP3,IP3作为第二信使作用于细胞内钙库上的IP3受体,释放C a2+入细 胞浆。同时,内质网Ca2+枯竭后能激活细胞膜上的钙通道引发Ca2+持续内流而 使〔Ca2+〕i升高。
, http://www.100md.com
通常一过性的细胞内钙升高可以传递信息,并可引发一系列有重要生理意义的生物学 效应,而慢性持续性的细胞内钙升高则会使细胞产生钙毒性。因此,为了保持细胞内钙稳态 ,细胞会动用丰富的钙平衡系统调节细胞内钙水平。调节Ca2+平衡的相关蛋白有钙泵 (Ca2+ ATP酶)、Ca2+通道蛋白、Na+/Ca2+交换蛋白、Ca2+转导蛋白及众多 的钙结合蛋白。TGF-β可使牙髓细胞ALP活性升高〔9〕,促进 ALP水 解ATP为运输Ca2+、PO42-提供能量, 因胞内钙浓度升高而活化的Ca2+泵利用ATP水解产生的能量、Na+/Ca2+交换 蛋白活 化利用Na+顺浓度梯度入胞的能量将Ca2+逆浓度差泵出细胞外,从而使〔C a2+〕i降低。
, 百拇医药
本实验结果显示,TGF-β1使细胞内Ca2+波动后维持在比 加药前稍高 的细胞内Ca2+水平上(P<0.01),提示TGF-β作用于牙髓细胞后,细胞内C a2+经各种信号分 子调节而波动后,细胞可重新建立新的钙平衡,即在无细胞钙毒性前提下提高了细胞内静息 钙水平,而这种变化对于牙髓细胞分化具有重要意义。此外,本实验中还发现,Ca2+ 变化有空间特异性,静息状态下胞质内荧光强度高于核内,TGF-β1作用后细胞核周Ca 2+升高 幅度较大,在核周形成明显的不延续的周晕,这可能是由于核区存在某些钙结合物,或者有 Ca2+转导入细胞核内。详细机制还需进一步实验证实。
4 结 论
TGFβ能引起牙髓细胞内Ca2+水平的显著变化, TGF-β使胞浆及胞核 内的〔Ca2+〕i均经历先升高后降低的变化,并维持在比加药前稍高的静息Ca2 +水平上。证明Ca 2+参与了TGF-β1信号转导过程并参与将信号转入核内。■
, 百拇医药
本课题为国家自然科学基金资助项目 批准号 39870789
参考文献
[1]Nakashima M. The effects of growth factors on DNA synthesis,proteoglycan synthesis and alkaline phosphatase activity in bovine dental pulp cell. Arch Or al Biol,1992,37:231
[2]Shirakawa M, Shiba H, Nakanishi K, et al. Transforming growth factor-β1 r educe alkaline phosphatase mRNA and activity and stimulates cell proliferation i n cultures of human pulp cells. J Dent Res,1994,73:1509
, http://www.100md.com
[3]Toyono T, Nakashima M, Kuhara S.et al Temporal changes in expression of tr ansforming growth factor-beta superfamily members and their receptors during b ovine preo dontoblast differentiation in vitro. Arch Oral Biol,1997,42(7): 481
[4]Tsien RY. Fluorecence measurement and photochemical manipulation of cytosoli c calcium. TINS,1988,11(10):419
[5]Satoh H, Blatter LA, Bers DM. Effects of 〔Ca2+〕i SR Ca2+ load ,a nd rest on Ca2+ spark frequency in ventricular myocytes. Am J Physiol,1997 ,272(Heart Circ Physiol 41):H657
, http://www.100md.com
[6]Tsukamoto Y,Fukutani S,Shin-ike T,et al. Mineralized nodule formation by c ultures of human dental pulp-derived fibroblast. Arch Oral Biol,1992,37(12):104 5
[7]Mary BK. Regulation of neuronal function by calcium. TINS,1989,12(11):417
[8]顾天爵主编. 生物化学.第4版. 北京:人民卫生出版社,1996.321
[9]Takemi T, Moustakas A, Lin HY, et al. Molecular characterization of a type I serine-theronine kinase receptor for TGFβand activin in the rat pituitary tum or cell line GH3. Exp Cell Res,1995,216:208
收稿日期:2000-01-31
修稿日期:2000-02-28, 百拇医药
单位:王景杰(第四军医大学口腔医学院口腔内科 710032);牛忠英(第四军医大学口腔医学院口腔内科 710032);倪龙兴(第四军医大学口腔医学院口腔内科 710032);王春梅(第四军医大学电镜中心)
关键词:转化生长因子β;牙髓细胞; 激光扫描共聚焦显微镜
实用口腔医学杂志000307〔摘要〕 目的:探讨TGF-β1信号转导过程与人牙髓细胞内钙〔(Ca2 + )i〕的关系。方法:体外培养人牙髓细胞经钙荧光指示剂Fluo-3负载后,用激光扫描共聚焦显微镜测定TGF-β1影响前后的人牙髓细胞内钙随时间变化情况。结果:TGF-β1(0.1 ng/L)使人牙髓细胞内钙先升高后降低,最后维持 在比加药前稍高的静息钙水平上。结论:通过TGF-β可引起牙髓细 胞内Ca2+水平的显著变化,证明Ca2+参与了人牙髓细胞TGF-β1信号转导过 程并参与将信号转入核内。
, 百拇医药
中图分类号:R781.3 文献标识码:A
文章编号:1001-3733(2000)03-0192-04
A dynamic observation of the effects of TGF-β1 on intracellular calcium in
cultured human pulp cells with laser scanning confocal microscopy
Wang Jingjie,Niu Zhongying, Ni Longxing.
(Stomatological College,Fourth Mili tary Medical University,Xi'an 710032)
, 百拇医药
〔Abstract〕Objective: To investigate the relationship between TGF- β1 message tr ansduction process and changes of intracellular calcium in human pulp cells. Methods: Human pulp cells were cultured with TGF -β1 and intracellular calcium level was measured with t he fluorescent Ca2+ indicator Fluo-3 and lase r scanning confocal microscopy. Results: After being treat ed with TGF-β1(0.1 ng/L), intracellular calcium in human pulp cell increased (P< 0.01) and then decreased (P<0.05). At last, it came to a higher level of res ting intracellular calcium. Conclusio n : Calcium participates in the process of TGF-β1 message transdu ction.
, 百拇医药
Key Words Transforming grouth facfor beta,Dental pulp;Cell; Las er scanning confocal microscopy(LSCM)▲
钙离子作为细胞内信号转导的第二信使参与诸如肌肉收缩、神经传导以及细胞增殖与分 化等多种重要生理活动,细胞内钙离子浓度变化是细胞重要的信息系统,细胞在外界或不同 生理、病理状态下胞内钙离子浓度都会发生相应变化。
牙髓细胞或部分牙髓细胞具有分化成成牙本质细胞及生成牙本质的潜能,牙髓细胞在其分化 、增殖及矿化过程中受包括多种生长因子在内的多因素的调节,各种因素引起的细胞内钙的 不同变化是牙髓细胞增殖、分化以及矿化的重要环节。转化生长因子β(Transforming gro wth factor-β,TGF-β)对人牙髓细胞增殖具有双向调节功能〔1,2〕,在牙本质 修复过程中 对牙髓细胞向成牙本质细胞分化有重要促进作用〔3〕。本研究采用体外培养牙 髓细胞, 利用激光共聚焦显微镜(Laser scanning confocal microscope,LSCM)动态观察TGFβ1 对牙 髓细胞内Ca2+浓度的影响,为进一步探明TGFβ1对牙髓细胞调节的信号转导机制提 供依据,为研究牙髓细胞分化及牙本质形成机制奠定基础。
, http://www.100md.com
1 材料和方法
1.1 试剂
D-Hank液(g/L):NaCl 8.00, KCl 0.40, Na2HPO·4.12H2O 0.12, KH2PO4 0.06 , D-Glucose 1.00,NaHCO3 0.35,采用国产分析纯试剂和超纯水(18.2 MΩcm)配制。Fluo -3/AM系美国BIO-RAD产品;胰蛋白酶由华美生物工程公司购得;小 牛 血清由杭州四季青生物工程材料研究所提供;DMEM培养基由美国GIBCO公司提供,TGF-β 1系美国PROMEGA公司产品。
1.2 牙髓细胞培养
选13~20岁因正畸或阻生拔除的完整新鲜恒牙(第一前磨牙及第三磨牙),劈冠取出牙髓组 织,剪成1 mm3碎块,铺于培养瓶底,以含体积分数(φ)为10%胎牛血清(FBS)的DMEM培 养液,φ(CO2为5%,φ(空气)=95%,饱和湿度,37 ℃孵育做原代培养,取生长良好的第 4代牙髓细胞接种在特制培养皿中 ,接种浓度2.5×108/L,细胞贴壁后进行实验。
, 百拇医药
1.3 实验分组(每组复种两个培养皿)
对照组:φ(FBS)=10%的DMEM
实验组:用φ(FBS)=10%的DMEM配制的质量浓度为0.1 ng/L的TGF-β1溶液
1.4 牙髓细胞内Ca2+测定
1.4.1 测定原理 Fluo-3能特异性地与钙离子结合,并在一定 波长激发光激发后产生荧光,且与钙离子结合后其荧光光谱发生变化,其荧光强度与Ca 2+浓 度成正比,因而可用于观察Ca2+动态变化〔4〕。但Fluo-3为极性大的酸性化 合物,难以进入 细胞,而当其结合上亲酯的乙酰羟甲基酯成为脂溶性的Fluo-3/AM,再与细胞孵育时,便很 容易透过细胞膜,胞浆内的非特异性酯酶将其脂解脱去脂基生成游离的Fluo-3。
, http://www.100md.com
1.4.2 D-Hank液(pH7.4)洗涤标本2次后,于37 ℃避光条件下用D-Hank液稀释的Fluo -3/AM(10 μmol/L)荷载,40 min后再用D-Hank液洗涤细胞3次,最后保留少许细胞外 D-Hank液平衡10 min〔5〕,LSCM下观察。
1.4.3 激光共聚焦图像 LSCM能对活细胞内部的离子分 布及随时间的变化进行成像及测量。本实验使用的是BIO-RAD公司的MRC-1024 LSCM。在 观察C a2+快速变化时,可选线扫方式,其采样频率为488 Hz,与Ca2+结合的Fluo-3 可以被488 nm的 氩离子激光激发,可在525 nm处探测到荧光发射,其荧光强度的变化可指示胞内游离钙浓度 的相对变化。
1.4.4 加药 在LSCM下选好细胞后,用微量加药器将实验条件要求的试剂滴加在培养皿 中,试剂扩散后进行观察
, http://www.100md.com
1.5 实验数据的处理
数据均用
 ±s 表示,数据分析软件为SPSS软件。
±s 表示,数据分析软件为SPSS软件。2 结 果
2.1 加药前实验组(n=8)与对照组(n=6)牙髓细胞〔Ca2+〕i水平无明显 差异:Ca2+含量少、荧 光强度弱,分布较均匀(图1)。加药后实验组荧光强度随时间明显变化而对照组无明显变 化(图2,3)。

图1 实验组加药前牙髓细胞内钙含量(LSCM,×400)
2.2 实验组牙髓细胞加入TGFβ(0.1 ng/L)后10 s,胞内Ca2+开始上升,经18 s后达 最高峰,此时荧光最强且分布不均,其中核周荧光最强(图4)持续50 s后开始下降,经45 s后钙离子浓度趋于平稳,但其水平仍稍高于加药前静息钙水平(图5)。其中,实验组荧光 强度最大(4.6±0.02)时所代表的细胞内Ca2+水平与对照组(1.5±0.01)具有显著差异 (P<0.01),且实验组加药后静息荧光强度(2.8±0.01)所代表的胞内Ca2+水平 与对照组(1.5±0.01)Ca2+水平也差别显著(P<0.01)。

, http://www.100md.com
图2 TGF-β1对牙髓细胞内钙的影响(
 为加药处)
为加药处)图中下线为基线,上两条线是两个不同细胞的荧光强度变化线

图3 实验组和对照组牙髓细胞内钙随时间变化曲线(
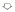 为加药处)
为加药处)3 讨 论
钙离子既是细胞内信号转导的信使,又是骨、牙齿等硬组织的基本成分,其沉积引发的矿化是在严格的细胞控制下 完成的。研究表明,体外培养牙髓 细胞具有潜在的分化为成牙本质细胞及发生矿化的能力〔6〕,而牙髓细胞内Ca2 +水平能够反应出细胞的状态、药物、胞外环境对细胞的 影响〔7〕。因此,研究体 外培养牙髓细胞内Ca2+浓度变化对研究牙髓细胞分化的诱导及矿化具有重要意义。

, 百拇医药
图4 牙髓细胞加入TGF-β1 28 s后细胞内钙英光显示图(LSCM,×400)

图5 牙髓细胞加入TGFβ1 2min后〔Ca2+〕i水平
(LSCM,×400)
3.1 关于本研究的测量技术
目前测量细胞内钙的方法有:①钙离子选择微电极法,但该方法对于较小细胞内 的操作较难且微电极反应时间较长;②放射示踪法,该方法可定性定量分析细胞内外Ca 2+变化,主要 用于测定跨膜Ca2+流动及代谢动力学变化,但对细胞静息Ca2+浓度测定操作复 杂且效果不理想;③荧光标记示踪法,由于细胞内钙荧光指示剂的发现和其性能的不断完善 , 该方法日见其优越性。Fluo-3作为第3代荧光指示剂,是唯一在可见光区有激发峰的荧光 剂 ,可以避免紫外光对细胞的损害和激发自发荧光倾向,它与Ca2+结合后荧光强度增加 40倍,因此在观察Ca2+的空间分布和快速时间变化方面,Fluo-3的性能是目前最好 的 ,加之有激光共聚焦扫描技术配合,使细胞内甚至细胞器内Ca2+的空间和时间变化的 测定更加完善。
, http://www.100md.com
3.2 TGF-β1对牙髓细胞内Ca2+的影响
通常情况下,由于细胞内存在丰富的钙平衡系统,故可维持比细胞外低5000~10000倍的Ca 2+ 浓度〔9〕,但当细胞受到不同外界刺激时其细胞内钙会发生一定的变化。本实验结 果显示, TGF-β1可使牙髓细胞内Ca2+先升高后降低。一般来说,细胞内钙升高机 制 有以下三种:①通过IP3引起细胞内质网、线粒体中Ca2+释放入细胞浆;②神经冲 动使 电压依赖性钙通道开放,Ca2+内流;③通过cAMP激活APK使钙通道磷酸化而变构开放〔8〕。而TGF-β的3种受体都含有丝氨酸-苏氨酸序列,并且TGF-βRI和TGF-βRII 具有内在丝氨酸-苏氨酸激酶活性〔9〕。 因此,TGF-β作用的可能机制是TGF-β与其受体结合后,受体被激活,从而活化PLC,后 者可 催化PIP2分解为DG和IP3,IP3作为第二信使作用于细胞内钙库上的IP3受体,释放C a2+入细 胞浆。同时,内质网Ca2+枯竭后能激活细胞膜上的钙通道引发Ca2+持续内流而 使〔Ca2+〕i升高。
, http://www.100md.com
通常一过性的细胞内钙升高可以传递信息,并可引发一系列有重要生理意义的生物学 效应,而慢性持续性的细胞内钙升高则会使细胞产生钙毒性。因此,为了保持细胞内钙稳态 ,细胞会动用丰富的钙平衡系统调节细胞内钙水平。调节Ca2+平衡的相关蛋白有钙泵 (Ca2+ ATP酶)、Ca2+通道蛋白、Na+/Ca2+交换蛋白、Ca2+转导蛋白及众多 的钙结合蛋白。TGF-β可使牙髓细胞ALP活性升高〔9〕,促进 ALP水 解ATP为运输Ca2+、PO42-提供能量, 因胞内钙浓度升高而活化的Ca2+泵利用ATP水解产生的能量、Na+/Ca2+交换 蛋白活 化利用Na+顺浓度梯度入胞的能量将Ca2+逆浓度差泵出细胞外,从而使〔C a2+〕i降低。
, 百拇医药
本实验结果显示,TGF-β1使细胞内Ca2+波动后维持在比 加药前稍高 的细胞内Ca2+水平上(P<0.01),提示TGF-β作用于牙髓细胞后,细胞内C a2+经各种信号分 子调节而波动后,细胞可重新建立新的钙平衡,即在无细胞钙毒性前提下提高了细胞内静息 钙水平,而这种变化对于牙髓细胞分化具有重要意义。此外,本实验中还发现,Ca2+ 变化有空间特异性,静息状态下胞质内荧光强度高于核内,TGF-β1作用后细胞核周Ca 2+升高 幅度较大,在核周形成明显的不延续的周晕,这可能是由于核区存在某些钙结合物,或者有 Ca2+转导入细胞核内。详细机制还需进一步实验证实。
4 结 论
TGFβ能引起牙髓细胞内Ca2+水平的显著变化, TGF-β使胞浆及胞核 内的〔Ca2+〕i均经历先升高后降低的变化,并维持在比加药前稍高的静息Ca2 +水平上。证明Ca 2+参与了TGF-β1信号转导过程并参与将信号转入核内。■
, 百拇医药
本课题为国家自然科学基金资助项目 批准号 39870789
参考文献
[1]Nakashima M. The effects of growth factors on DNA synthesis,proteoglycan synthesis and alkaline phosphatase activity in bovine dental pulp cell. Arch Or al Biol,1992,37:231
[2]Shirakawa M, Shiba H, Nakanishi K, et al. Transforming growth factor-β1 r educe alkaline phosphatase mRNA and activity and stimulates cell proliferation i n cultures of human pulp cells. J Dent Res,1994,73:1509
, http://www.100md.com
[3]Toyono T, Nakashima M, Kuhara S.et al Temporal changes in expression of tr ansforming growth factor-beta superfamily members and their receptors during b ovine preo dontoblast differentiation in vitro. Arch Oral Biol,1997,42(7): 481
[4]Tsien RY. Fluorecence measurement and photochemical manipulation of cytosoli c calcium. TINS,1988,11(10):419
[5]Satoh H, Blatter LA, Bers DM. Effects of 〔Ca2+〕i SR Ca2+ load ,a nd rest on Ca2+ spark frequency in ventricular myocytes. Am J Physiol,1997 ,272(Heart Circ Physiol 41):H657
, http://www.100md.com
[6]Tsukamoto Y,Fukutani S,Shin-ike T,et al. Mineralized nodule formation by c ultures of human dental pulp-derived fibroblast. Arch Oral Biol,1992,37(12):104 5
[7]Mary BK. Regulation of neuronal function by calcium. TINS,1989,12(11):417
[8]顾天爵主编. 生物化学.第4版. 北京:人民卫生出版社,1996.321
[9]Takemi T, Moustakas A, Lin HY, et al. Molecular characterization of a type I serine-theronine kinase receptor for TGFβand activin in the rat pituitary tum or cell line GH3. Exp Cell Res,1995,216:208
收稿日期:2000-01-31
修稿日期:2000-02-28, 百拇医药