慢性肝病患者血清TGF-β1与肝纤维化指标和肝组织病理的关系
作者:刘 芳 刘金星 曹治宸 李兵顺 赵彩彦 孔 丽 甄 真
单位:河北医科大学第三医院传染科 河北省石家庄市 050051
关键词:转化生长因子-β1;肝硬化;肝/病理学;Ⅲ型前胶原蛋白/分析;层粘连蛋白/分析;透明质酸/分析
世界华人消化杂志990619 摘 要
目的 观察慢性乙肝、肝硬变患者血清转化生长因子-β1(TGF-β1)与血清肝纤维化指标和肝组织病理的关系.
方法 采用酶联免疫吸附试验(ELISA)测定76例慢性乙肝、肝硬变患者(其中慢性轻度20例、中度20例、重度18例、肝硬变18例)血清TGF-β1. 同时检测血清PCⅢ,LN,HA. 29例作肝活检,行HE染色.
, 百拇医药 结果 慢性乙肝轻、中、重度及肝硬变患者血清TGF-β1水平(mg/L,144±57,350±108,508±133,579±225)明显高于对照组(mg/L,95±34,P<0.01),按慢乙肝轻、中、重度、肝硬变依次升高(P<0.01或P<0.05);TGF-β1与血清PCⅢ,LN,HA呈正相关(P<0.01或P<0.05);血清TGF-β1,PCⅢ, LN,HA水平随着肝组织纤维化程度的加重而增长(P<0.01或P<0.05).
结论 慢性乙型病毒性肝炎、肝硬变患者血清TGF-β1与肝纤维化的血清标志以及肝组织病理改变相一致.
中国图书馆分类号 R575.2
Relationship between TGF-β1, serum indexes of liver fibrosis and hepatic tissue pathology in patients with chronic liver diseases
, 百拇医药
LIU Fang, LIU Jin-Xing, CAO Zhi-Chen, LI Bing-Shun, ZHAO Cai-Yan, KONG Li and ZHEN Zhen
Department of Infectious Diseases, Third Hospital of Hebei Medical University, Shijiazhuang 050051, Hebei Province, China
Subject headings transforming growth factor-β1; liver cirrhosis; liver/pathology; type Ⅲ procollagen/analysis, hyaluronate acid/analysis; laminin/analysis
Abstract
, 百拇医药
AIM To observe the relationship between serum transforming growth factor-β1(TGF-β1), serum indexes of liver fibrosis and hepatic tissue pathology.
METHODS Serum TGF-β1 was detected by ELISA in 58 patients with chronic hepatitis B (CHB) and 18 patients with liver cirrhosis (LC). Twenty healthy persons served as normal controls (NC). Liver puncture was performed in 29 patients with CHB. Diagnoses of pathological histology were made.
, 百拇医药
RESULTS Serum TGF-β1 levels in mild, moderate, severe CHB and LC (mg/L, 144±57, 350±108, 508±133, 579±225) were notably higher than that in NC (mg/L, 95±34,P<0.01) and increased successively (P<0.01 or 0.05). TGF-β1 was correlated positively with serum levels of PCⅢ, LN and HA (P<0.01 or 0.05). Serum TGF-β1, PCⅢ, LN and HA increased successively (P<0.01/0.05) with aggravation of liver fibrosis.
CONCLUSION Serum TGF-β1 levels of patients with CHB and LC are consistent with serum indexes of liver fibrosis and hepatic tissue pathologic changes.
, 百拇医药
0 引言
肝纤维化是慢性肝病发展成肝硬变的必经阶段,其早期诊断对肝硬变的防治或逆转起重要作用. 因此对肝纤维化发病机制、诊断方法及治疗的研究成为目前慢性肝病研究的重点之一. 转化生长因子β1(transforming growth factor-β1,TGF-β1)具有促进肝脏间质细胞分化和增殖,增加肝细胞外基质(ECM)的沉积、抑制其降解的作用. 观察血清TGF-β1水平与血清肝纤维化指标和肝组织病理的关系,以确定TGF-β1在肝纤维化形成中的作用,对肝纤维化的早期诊断和抗肝纤维化药物的研究具有非常重要的意义.
1 材料和方法
1.1 材料 慢性乙型病毒性肝炎患者76例为1997-07/1998-05我科住院患者,诊断符合1995年北京第五次全国传染病与寄生虫病学术会议修订的诊断标准[1]. 其中慢性轻度20例(男12例,女8例,年龄40岁±12岁)、中度20例(男15例,女5例,年龄40岁±12岁)、重度18例(男16例,女2例,年龄44岁±13岁)、肝硬变18例(男14例,女4例,年龄51岁±11岁). 上述病例经血清检查均排除了甲、丙、丁、戊型肝炎病毒感染. 同时以20例体检正常人员(男15例,女5例,年龄43岁±11岁)做对照. 各组间性别和年龄分布无显著性差异(P>0.05).
, 百拇医药
1.2 方法 所有病例均于入院后次日抽取空腹不抗凝静脉血3mL,待血块收缩后,以2000r/min离心10min,取血清置-20℃冰箱保存,集中专人检测. 同时分别检测PCⅢ,LN,HA及甲、乙、丙、丁、戊型肝炎病毒标志物. 在76例中29例于住院1wk内做肝组织活检,采用经皮肝穿术,选用16号国产针头快速负压抽吸. 肝组织经生理盐水冲洗,100mL/L福尔马林固定后石蜡包埋,标本经连续切片行HE染色. 血清TGF-β1检测采用ELISA法,试剂由美国Genzyme公司提供. 血清PCⅢ、LN、HA检测采用放免法,试剂分别由重庆肿瘤研究所、上海海军医学研究所提供. 抗HAV-IgM(中国人民解放军302医院提供试剂)采用ELISA法. HBsAg,抗-HBs 抗-HBc抗-HBcIgM,HBeAg,抗-HBe(中国潍坊3V公司提供试剂)采用固相放射免疫法(SPRIA法),HBV DNA(洛阳华美生物工程公司提供试剂)采用PCR法. 抗HCV,抗HCV-IgM(上海科华生物工程公司提供试剂)采用ELISA法,HCV RNA(北京人民医院肝病研究所提供试剂)采用PCR法. HDVAg,抗HDV(北京佑安医院肝炎研究所提供试剂)采用ELISA法. 抗HEV,抗HEV-IgM(北京高达生物技术研究所提供试剂)采用ELISA法.
, 百拇医药
统计学处理组间资料比较采用方差分析,q检验,各指标间相关采用直线相关分析.
2 结果
2.1 慢性肝病患者血清TGF-β1,PCⅢ,HA水平 慢性乙型病毒性肝炎轻、中、重度及LC患者血清TGF-β1,PCⅢ,HA水平均高于对照组(P<0.01,表1). 重度、LC组LN高于对照组(P<0.01). TGF-β1,PCⅢ,LN,HA水平均以LC组最高,重度次之、中度较低、轻度最低.
表1 慢性肝病患者血清TGF-β1,PCⅢ,LN,HA水平 (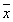 ±s) 分组
±s) 分组
n
TGF-β1
, 百拇医药
(mg/L)
PCⅢ
(μg/L)
LN
(μg/L)
HA
(μg/L)
对照
20
95±34
85±17
114±16
54±25
, 百拇医药
CH轻
20
144±57b
120±39b
101±33
124±63b
CH中
20
350±108ab
180±64ab
132±21
, http://www.100md.com
304±123ab
CH重
18
508±133bd
305±193bd
165±56bd
635±252bd
LC
18
579±225bd
414±96bd
, 百拇医药
208±98bd
663±156bd
bP<0.01,vs 对照;dP<0.01,vs 轻、中度;aP<0.05,vs 轻度.
2.2 慢性乙型肝炎患者血清TGF-β1与PCⅢ,LN,HA的关系 除慢性轻度组血清LN外,血清TGF-β1与PCⅢ,LN,HA呈明显正相关(P<0.05或0.01,表2).
表2 血清TGF-β1与PCⅢ,LN,HA的相关 (r) 分组
n
PCⅢ
LN
, 百拇医药
HA
CH轻
20
0.553b
0.390
0.479a
CH中
20
0.464a
0.456a
0.504a
CH重
, 百拇医药
18
0.609b
0.719b
0.581a
LC
18
0.511a
0.545a
0.651b
aP<0.05,bP<0.01.
, http://www.100md.com
2.3 肝纤维化各期血清TGF-β1,PCⅢ,HA水平变化 血清TGF-β1,PCⅢ,HA水平在肝纤维化Ⅳ期明显高于其他各期,Ⅲ期高于0,Ⅰ,Ⅱ期(P<0.01或0.05,表3). 血清LN水平Ⅳ期高于0,Ⅰ,Ⅱ期(P<0.05). 血清TGF-β1,PCⅢ,LN,HA水平随肝纤维化程度的加重而增长.
表3 肝组织纤维化分期与血清TGF-β1. PCⅢ,LN,HA对照 (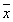 ±s) 纤维化分组
±s) 纤维化分组
n
TGF-β1
(mg/L)
PCⅢ
(μg/L)
, 百拇医药
LN
(μg/L)
HA
(μg/L)
0
4
93±41
84±19
114±17
56±18
Ⅰ
8
123±38
, 百拇医药
106±39
108±23
93±19
Ⅱ
7
160±42c
122±40
115±18
140±20c
Ⅲ
5
266±39a
, http://www.100md.com
194±40a
142±19
319±99a
Ⅳ
5
332±36ab
286±55ab
190±30a
590±105ab
aP<0.01,P<0.05,vs 0,Ⅰ,Ⅱ期;bP<0.01,vs Ⅲ期;cP<0.05,vs 0期.
, 百拇医药
3 讨论
1984年Tuker et al[2]首先发现,TGF-β1是与多种上皮性肿瘤生长有关的细胞生长负调控因子. 近年来许多研究[3-5]发现,TGF-β1对肝脏ECM的合成具有调节作用. 已经明确慢性乙型肝炎肝纤维化时,乙肝病毒的直接作用和其介导的免疫病理损伤首先诱导Kupffer细胞分泌TGF-β1,然后TGF-β1进一步激活贮脂细胞和其他的间质细胞导致TGF-β1的大量分泌[6]. 本结果表明,乙型病毒性肝炎慢性轻度、中度、 重度及肝硬变患者血清TGF-β1水平均高于对照组(P<0.01或0.05),其水平按慢性轻度、中度、重度、肝硬变顺序依次递增(P<0.01或0.05). 可见慢性乙型病毒性肝炎、肝硬变患者血清TGF-β1水平升高,且其升高与乙型病毒性肝炎的严重程度相一致.
肝纤维化过程是肝细胞反复受损、ECM逐渐增加的过程. ECM主要包括胶原蛋白(Ⅰ,Ⅲ,Ⅳ,Ⅴ和Ⅵ型胶原蛋白)、非胶原糖蛋白(如纤维连接素、层粘连蛋白等)和蛋白聚糖(如透明质酸、硫酸类肝素、硫酸软骨素等). 以上成分由肝间质和实质细胞合成并释放. 体外细胞培养和慢性肝炎肝组织的免疫组化染色证明TGF-β1可激活贮脂细胞并促进该细胞的增殖和对ECM的合成,抑制间质细胞分泌蛋白酶并促进间质细胞表达TGF-β1受体[4,5]. 因此,TGF-β1是最重要的致肝纤维化的细胞因子. 血清PCⅢ,LN,HA是反映肝纤维化较可靠指标,其升降与纤维化程度相一致[7],且指标联合检测可提高肝纤维化早期诊断的阳性率[8,9]. 本结果显示,慢性乙型病毒性肝炎轻、中、重度及LC患者血清PCⅢ,LN,HA水平均高于对照组,且以LC组最高、慢性重度次之,与文献报道结果相一致[7]. 相关分析结果表明血清TGF-β1水平与PCⅢ,LN,HA呈直线正相关(P<0.01或0.05),说明TGF-β1是促进ECM的合成与沉积的关键因子.
, 百拇医药
肝组织病理可直接反应肝纤维化程度,是诊断肝纤维化最经典的方法. 我们通过对29例肝穿所得的肝组织进行HE染色,按照组织病理学诊断标准[1]将其分为纤维化0,Ⅰ,Ⅱ,Ⅲ,Ⅳ五期,同时检测相应患者的血清TGF-β1,PCⅢ,LN,HA. 结果表明,血清TGF-β1,PCⅢ,LN,HA水平随着肝组织纤维化程度的加重而增长. 表明TGF-β1与肝脏纤维组织的增长有密切关系,从病理的角度进一步证实了TGF-β1对肝纤维化的促进作用.
总之,血清TGF-β1与血清肝纤维化指标和肝组织病理改变呈一致性. 因此,寻找拮抗TGF-β1的途径不失为抗肝纤维化的有效方法,临床通过检测血清TGF-β1水平可直接了解肝纤维化程度.
作者简介:刘芳,女,1964-11-17生,河北省晋州市人,汉族. 1987年河北医科大学医学系毕业,1998年河北医科大学传染病专业硕士,传染科主治医师,主要从事病毒性肝炎的研究,发表论文5篇.
, http://www.100md.com
通讯作者 刘芳,050051,河北省石家庄市维明街110号,河北医科大学第三医院传染科.
Correspondence to:LIU Fang, Department of Infectious Diseases, Third Hospital of Hebei Medical University, 110 Weiming Street, Shijiazhuang 050051, Hebei Province, China
Tel. +86.311.7027951 Ext. 3152
4 参考文献
1 The program of prevent and treat about viral hepatitis. Zhonghua Chuanranbing Zazhi, 1995;13:241-247
, 百拇医药
2 Tuker RF, Shipley GD, Moss HL. Growth inhibitor from BSC-1 cells is closely related to the platelet type tromforing growth factor. Science, 1984;226:706-716
3 Rieder H, Armbrust T, Karl-Hermann Meyer Zum Büschenfelde, Ramadori G. Contribution of sinusoidal endothelial liver cells to liver fibrosis: expression of transforming growth factor-β1 receptors and modulation of plasmin-generating enzymes by transforming growth factor-1. Hepatology, 1993;18:937-938
, 百拇医药
4 Knittel T, Janneck T, Muller T, Fellmer L, Ramadori G. Transforming growth factor betal-regulated gene expression of Ito cells. Hepatology, 1996;24:352-360
5 Bachem MG, Meyer D, Melchior R, Sell KM, Gressner AM. Activation of rat liver perisinusoidal lipocytes by transforming growth factors derived from myofibroblast like cells. A potential mechanism of self perpetuation in liver fibrogenesis. J Clin Invest, 1992;89:19
6 Cheng ML, Liu SD. The base and clinic about liver fibrosis. Beijing: Renmin Wensheng Chubanshe, 1996:17-26
, 百拇医药
7 Ye HJ, Ji XS, Feng XM, Gao YS, Wang LY, Xiao H, Pan CZ. The diagnostic value of serum PCⅢ in liver fibrosis patients. Linchuang Gandanbing Zazhi, 1993;9:90-91
8 Li WD. The diagnosis of liver cirrhosis. Xin Xiaohua Bingxue Zazhi, 1997;7:466-467
9 Li BS, Wang J, Liu JX, Sui SQ, Wei MX, Liu XM, Pei X, Wang LS. The preliminary study on diagnostic value of co-detection of serum PCⅢ,HA and LN in liver fibrosis patients. Zhonghua Chuanranbing Zazhi, 1998;16:85-87
收稿日期 1998-12-21 修回日期 1999-04-12, 百拇医药
单位:河北医科大学第三医院传染科 河北省石家庄市 050051
关键词:转化生长因子-β1;肝硬化;肝/病理学;Ⅲ型前胶原蛋白/分析;层粘连蛋白/分析;透明质酸/分析
世界华人消化杂志990619 摘 要
目的 观察慢性乙肝、肝硬变患者血清转化生长因子-β1(TGF-β1)与血清肝纤维化指标和肝组织病理的关系.
方法 采用酶联免疫吸附试验(ELISA)测定76例慢性乙肝、肝硬变患者(其中慢性轻度20例、中度20例、重度18例、肝硬变18例)血清TGF-β1. 同时检测血清PCⅢ,LN,HA. 29例作肝活检,行HE染色.
, 百拇医药 结果 慢性乙肝轻、中、重度及肝硬变患者血清TGF-β1水平(mg/L,144±57,350±108,508±133,579±225)明显高于对照组(mg/L,95±34,P<0.01),按慢乙肝轻、中、重度、肝硬变依次升高(P<0.01或P<0.05);TGF-β1与血清PCⅢ,LN,HA呈正相关(P<0.01或P<0.05);血清TGF-β1,PCⅢ, LN,HA水平随着肝组织纤维化程度的加重而增长(P<0.01或P<0.05).
结论 慢性乙型病毒性肝炎、肝硬变患者血清TGF-β1与肝纤维化的血清标志以及肝组织病理改变相一致.
中国图书馆分类号 R575.2
Relationship between TGF-β1, serum indexes of liver fibrosis and hepatic tissue pathology in patients with chronic liver diseases
, 百拇医药
LIU Fang, LIU Jin-Xing, CAO Zhi-Chen, LI Bing-Shun, ZHAO Cai-Yan, KONG Li and ZHEN Zhen
Department of Infectious Diseases, Third Hospital of Hebei Medical University, Shijiazhuang 050051, Hebei Province, China
Subject headings transforming growth factor-β1; liver cirrhosis; liver/pathology; type Ⅲ procollagen/analysis, hyaluronate acid/analysis; laminin/analysis
Abstract
, 百拇医药
AIM To observe the relationship between serum transforming growth factor-β1(TGF-β1), serum indexes of liver fibrosis and hepatic tissue pathology.
METHODS Serum TGF-β1 was detected by ELISA in 58 patients with chronic hepatitis B (CHB) and 18 patients with liver cirrhosis (LC). Twenty healthy persons served as normal controls (NC). Liver puncture was performed in 29 patients with CHB. Diagnoses of pathological histology were made.
, 百拇医药
RESULTS Serum TGF-β1 levels in mild, moderate, severe CHB and LC (mg/L, 144±57, 350±108, 508±133, 579±225) were notably higher than that in NC (mg/L, 95±34,P<0.01) and increased successively (P<0.01 or 0.05). TGF-β1 was correlated positively with serum levels of PCⅢ, LN and HA (P<0.01 or 0.05). Serum TGF-β1, PCⅢ, LN and HA increased successively (P<0.01/0.05) with aggravation of liver fibrosis.
CONCLUSION Serum TGF-β1 levels of patients with CHB and LC are consistent with serum indexes of liver fibrosis and hepatic tissue pathologic changes.
, 百拇医药
0 引言
肝纤维化是慢性肝病发展成肝硬变的必经阶段,其早期诊断对肝硬变的防治或逆转起重要作用. 因此对肝纤维化发病机制、诊断方法及治疗的研究成为目前慢性肝病研究的重点之一. 转化生长因子β1(transforming growth factor-β1,TGF-β1)具有促进肝脏间质细胞分化和增殖,增加肝细胞外基质(ECM)的沉积、抑制其降解的作用. 观察血清TGF-β1水平与血清肝纤维化指标和肝组织病理的关系,以确定TGF-β1在肝纤维化形成中的作用,对肝纤维化的早期诊断和抗肝纤维化药物的研究具有非常重要的意义.
1 材料和方法
1.1 材料 慢性乙型病毒性肝炎患者76例为1997-07/1998-05我科住院患者,诊断符合1995年北京第五次全国传染病与寄生虫病学术会议修订的诊断标准[1]. 其中慢性轻度20例(男12例,女8例,年龄40岁±12岁)、中度20例(男15例,女5例,年龄40岁±12岁)、重度18例(男16例,女2例,年龄44岁±13岁)、肝硬变18例(男14例,女4例,年龄51岁±11岁). 上述病例经血清检查均排除了甲、丙、丁、戊型肝炎病毒感染. 同时以20例体检正常人员(男15例,女5例,年龄43岁±11岁)做对照. 各组间性别和年龄分布无显著性差异(P>0.05).
, 百拇医药
1.2 方法 所有病例均于入院后次日抽取空腹不抗凝静脉血3mL,待血块收缩后,以2000r/min离心10min,取血清置-20℃冰箱保存,集中专人检测. 同时分别检测PCⅢ,LN,HA及甲、乙、丙、丁、戊型肝炎病毒标志物. 在76例中29例于住院1wk内做肝组织活检,采用经皮肝穿术,选用16号国产针头快速负压抽吸. 肝组织经生理盐水冲洗,100mL/L福尔马林固定后石蜡包埋,标本经连续切片行HE染色. 血清TGF-β1检测采用ELISA法,试剂由美国Genzyme公司提供. 血清PCⅢ、LN、HA检测采用放免法,试剂分别由重庆肿瘤研究所、上海海军医学研究所提供. 抗HAV-IgM(中国人民解放军302医院提供试剂)采用ELISA法. HBsAg,抗-HBs 抗-HBc抗-HBcIgM,HBeAg,抗-HBe(中国潍坊3V公司提供试剂)采用固相放射免疫法(SPRIA法),HBV DNA(洛阳华美生物工程公司提供试剂)采用PCR法. 抗HCV,抗HCV-IgM(上海科华生物工程公司提供试剂)采用ELISA法,HCV RNA(北京人民医院肝病研究所提供试剂)采用PCR法. HDVAg,抗HDV(北京佑安医院肝炎研究所提供试剂)采用ELISA法. 抗HEV,抗HEV-IgM(北京高达生物技术研究所提供试剂)采用ELISA法.
, 百拇医药
统计学处理组间资料比较采用方差分析,q检验,各指标间相关采用直线相关分析.
2 结果
2.1 慢性肝病患者血清TGF-β1,PCⅢ,HA水平 慢性乙型病毒性肝炎轻、中、重度及LC患者血清TGF-β1,PCⅢ,HA水平均高于对照组(P<0.01,表1). 重度、LC组LN高于对照组(P<0.01). TGF-β1,PCⅢ,LN,HA水平均以LC组最高,重度次之、中度较低、轻度最低.
表1 慢性肝病患者血清TGF-β1,PCⅢ,LN,HA水平 (
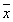 ±s) 分组
±s) 分组n
TGF-β1
, 百拇医药
(mg/L)
PCⅢ
(μg/L)
LN
(μg/L)
HA
(μg/L)
对照
20
95±34
85±17
114±16
54±25
, 百拇医药
CH轻
20
144±57b
120±39b
101±33
124±63b
CH中
20
350±108ab
180±64ab
132±21
, http://www.100md.com
304±123ab
CH重
18
508±133bd
305±193bd
165±56bd
635±252bd
LC
18
579±225bd
414±96bd
, 百拇医药
208±98bd
663±156bd
bP<0.01,vs 对照;dP<0.01,vs 轻、中度;aP<0.05,vs 轻度.
2.2 慢性乙型肝炎患者血清TGF-β1与PCⅢ,LN,HA的关系 除慢性轻度组血清LN外,血清TGF-β1与PCⅢ,LN,HA呈明显正相关(P<0.05或0.01,表2).
表2 血清TGF-β1与PCⅢ,LN,HA的相关 (r) 分组
n
PCⅢ
LN
, 百拇医药
HA
CH轻
20
0.553b
0.390
0.479a
CH中
20
0.464a
0.456a
0.504a
CH重
, 百拇医药
18
0.609b
0.719b
0.581a
LC
18
0.511a
0.545a
0.651b
aP<0.05,bP<0.01.
, http://www.100md.com
2.3 肝纤维化各期血清TGF-β1,PCⅢ,HA水平变化 血清TGF-β1,PCⅢ,HA水平在肝纤维化Ⅳ期明显高于其他各期,Ⅲ期高于0,Ⅰ,Ⅱ期(P<0.01或0.05,表3). 血清LN水平Ⅳ期高于0,Ⅰ,Ⅱ期(P<0.05). 血清TGF-β1,PCⅢ,LN,HA水平随肝纤维化程度的加重而增长.
表3 肝组织纤维化分期与血清TGF-β1. PCⅢ,LN,HA对照 (
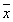 ±s) 纤维化分组
±s) 纤维化分组n
TGF-β1
(mg/L)
PCⅢ
(μg/L)
, 百拇医药
LN
(μg/L)
HA
(μg/L)
0
4
93±41
84±19
114±17
56±18
Ⅰ
8
123±38
, 百拇医药
106±39
108±23
93±19
Ⅱ
7
160±42c
122±40
115±18
140±20c
Ⅲ
5
266±39a
, http://www.100md.com
194±40a
142±19
319±99a
Ⅳ
5
332±36ab
286±55ab
190±30a
590±105ab
aP<0.01,P<0.05,vs 0,Ⅰ,Ⅱ期;bP<0.01,vs Ⅲ期;cP<0.05,vs 0期.
, 百拇医药
3 讨论
1984年Tuker et al[2]首先发现,TGF-β1是与多种上皮性肿瘤生长有关的细胞生长负调控因子. 近年来许多研究[3-5]发现,TGF-β1对肝脏ECM的合成具有调节作用. 已经明确慢性乙型肝炎肝纤维化时,乙肝病毒的直接作用和其介导的免疫病理损伤首先诱导Kupffer细胞分泌TGF-β1,然后TGF-β1进一步激活贮脂细胞和其他的间质细胞导致TGF-β1的大量分泌[6]. 本结果表明,乙型病毒性肝炎慢性轻度、中度、 重度及肝硬变患者血清TGF-β1水平均高于对照组(P<0.01或0.05),其水平按慢性轻度、中度、重度、肝硬变顺序依次递增(P<0.01或0.05). 可见慢性乙型病毒性肝炎、肝硬变患者血清TGF-β1水平升高,且其升高与乙型病毒性肝炎的严重程度相一致.
肝纤维化过程是肝细胞反复受损、ECM逐渐增加的过程. ECM主要包括胶原蛋白(Ⅰ,Ⅲ,Ⅳ,Ⅴ和Ⅵ型胶原蛋白)、非胶原糖蛋白(如纤维连接素、层粘连蛋白等)和蛋白聚糖(如透明质酸、硫酸类肝素、硫酸软骨素等). 以上成分由肝间质和实质细胞合成并释放. 体外细胞培养和慢性肝炎肝组织的免疫组化染色证明TGF-β1可激活贮脂细胞并促进该细胞的增殖和对ECM的合成,抑制间质细胞分泌蛋白酶并促进间质细胞表达TGF-β1受体[4,5]. 因此,TGF-β1是最重要的致肝纤维化的细胞因子. 血清PCⅢ,LN,HA是反映肝纤维化较可靠指标,其升降与纤维化程度相一致[7],且指标联合检测可提高肝纤维化早期诊断的阳性率[8,9]. 本结果显示,慢性乙型病毒性肝炎轻、中、重度及LC患者血清PCⅢ,LN,HA水平均高于对照组,且以LC组最高、慢性重度次之,与文献报道结果相一致[7]. 相关分析结果表明血清TGF-β1水平与PCⅢ,LN,HA呈直线正相关(P<0.01或0.05),说明TGF-β1是促进ECM的合成与沉积的关键因子.
, 百拇医药
肝组织病理可直接反应肝纤维化程度,是诊断肝纤维化最经典的方法. 我们通过对29例肝穿所得的肝组织进行HE染色,按照组织病理学诊断标准[1]将其分为纤维化0,Ⅰ,Ⅱ,Ⅲ,Ⅳ五期,同时检测相应患者的血清TGF-β1,PCⅢ,LN,HA. 结果表明,血清TGF-β1,PCⅢ,LN,HA水平随着肝组织纤维化程度的加重而增长. 表明TGF-β1与肝脏纤维组织的增长有密切关系,从病理的角度进一步证实了TGF-β1对肝纤维化的促进作用.
总之,血清TGF-β1与血清肝纤维化指标和肝组织病理改变呈一致性. 因此,寻找拮抗TGF-β1的途径不失为抗肝纤维化的有效方法,临床通过检测血清TGF-β1水平可直接了解肝纤维化程度.
作者简介:刘芳,女,1964-11-17生,河北省晋州市人,汉族. 1987年河北医科大学医学系毕业,1998年河北医科大学传染病专业硕士,传染科主治医师,主要从事病毒性肝炎的研究,发表论文5篇.
, http://www.100md.com
通讯作者 刘芳,050051,河北省石家庄市维明街110号,河北医科大学第三医院传染科.
Correspondence to:LIU Fang, Department of Infectious Diseases, Third Hospital of Hebei Medical University, 110 Weiming Street, Shijiazhuang 050051, Hebei Province, China
Tel. +86.311.7027951 Ext. 3152
4 参考文献
1 The program of prevent and treat about viral hepatitis. Zhonghua Chuanranbing Zazhi, 1995;13:241-247
, 百拇医药
2 Tuker RF, Shipley GD, Moss HL. Growth inhibitor from BSC-1 cells is closely related to the platelet type tromforing growth factor. Science, 1984;226:706-716
3 Rieder H, Armbrust T, Karl-Hermann Meyer Zum Büschenfelde, Ramadori G. Contribution of sinusoidal endothelial liver cells to liver fibrosis: expression of transforming growth factor-β1 receptors and modulation of plasmin-generating enzymes by transforming growth factor-1. Hepatology, 1993;18:937-938
, 百拇医药
4 Knittel T, Janneck T, Muller T, Fellmer L, Ramadori G. Transforming growth factor betal-regulated gene expression of Ito cells. Hepatology, 1996;24:352-360
5 Bachem MG, Meyer D, Melchior R, Sell KM, Gressner AM. Activation of rat liver perisinusoidal lipocytes by transforming growth factors derived from myofibroblast like cells. A potential mechanism of self perpetuation in liver fibrogenesis. J Clin Invest, 1992;89:19
6 Cheng ML, Liu SD. The base and clinic about liver fibrosis. Beijing: Renmin Wensheng Chubanshe, 1996:17-26
, 百拇医药
7 Ye HJ, Ji XS, Feng XM, Gao YS, Wang LY, Xiao H, Pan CZ. The diagnostic value of serum PCⅢ in liver fibrosis patients. Linchuang Gandanbing Zazhi, 1993;9:90-91
8 Li WD. The diagnosis of liver cirrhosis. Xin Xiaohua Bingxue Zazhi, 1997;7:466-467
9 Li BS, Wang J, Liu JX, Sui SQ, Wei MX, Liu XM, Pei X, Wang LS. The preliminary study on diagnostic value of co-detection of serum PCⅢ,HA and LN in liver fibrosis patients. Zhonghua Chuanranbing Zazhi, 1998;16:85-87
收稿日期 1998-12-21 修回日期 1999-04-12, 百拇医药