不同功能状态精子表面复型的透射电镜观察
作者:江一平 吴翊钦 钟秀容 林芸秀 魏玉珍
单位:江一平 吴翊钦 钟秀容 林芸秀 魏玉珍 福建医科大学组织学与胚胎学教研室;电镜室,福州 350004
关键词:表面复型;电子显微镜;获能;顶体反应;精子
解剖学报990225
【摘要】 目的 建立实用的实验程序,观察不同功能状态下的精子表面超微结构特点。 方法 用BWW上游法分离活动的人精子:BWW体外获能、诱导顶体反应和低渗膨胀试验处理后,将精子贴附于阳离子膜玻片上,叔丁醇冷却干燥后真空铂-碳喷镀复型。复型膜经3%氢氟酸剥脱,次氯酸钠腐蚀,透射电镜观察。 结果 人精子表面复型图像清晰,立体感强,细节较丰富、清晰,获能精子顶体区呈网络状,顶体反应时可见顶体区大量互相吻合的小泡,经低渗处理的精子顶体区出现类似获能和顶体反应的现象。 结论 表面复型-透射电镜技术可用于观察精子的不同生理状态引起的表面形貌变化,方法简便,可重复性好,具有良好的应用价值。
, 百拇医药
THE FUNCTIONAL ULTRASTRUCTURE OF SPERMATOZOA
VIEWING BY SURFACE-REPLICA TRANSMISSION
ELECTRON MICROSCOPY
Jiang YipingΔ, Wu Yiqin, Zhong Xiurong, Lin Yunxiu, Wei Yuzhen
(Department Histology and Embryology, Lab ratory Electron Microscopy,Fujian Medical University,Fuzhou)
【Abstract】 Objective To assess the variability of the surface-replica method for the observation of functional ultrastructure of human sperm.Methods Motile human spermatozoa,separated by swimming up in BWW,before-after capacitation,induced acrosome reaction and pretreated with hypoosmotic medium (HOS test),were fixed,layered on the poly-L-lysine coated slide-cover glass and dehydrated by tert-butanol method.The sperms on cover glass were coated by Pt/C shadowing in high vacuum to form surface-replica film.The film was stripped from glass by 3% hydrofluoric acid and digested with NaClO and then,after drying,was observed under transmission electron microscope.Results The images of surface-replica of human sperm were clear and stereo to show the surface geomorphology of spermatozoa in different physiological state.Conclusion The method of surface-replica can be used to analyze the functional altervation of sperm in ultrastructural level.
, 百拇医药
【Key words】 Surface-replica; Electron microscopy; Capacitation; Acrosome reaction; Spermatazoon
精子在成熟和受精过程中生理状态发生很大变化,许多变化往往可表现在细胞表面超微结构上,超薄切片透射电镜难于观察细胞全表面,故通常采用扫描电子显微镜技术(SEM)。由于一般SEM分辨率较低,观察精确度受到较大限制,而高分辨率的场发射SEM价格昂贵,在国内难以推广,故有必要开发既简易实用又有高分辨率的技术。本研究根据金属喷镀复型原理[1],建立了一实用的实验技术程序,报道如下。
材料和方法
1. 精子的实验处理
手淫法采集正常人精液,待其液化后以上游技术[2]分离活精子,分离用培养液采用BWW(配方见参考文献[2]);精子悬液分别进行下述处理:(1)不经任何处理直接制样(正常组);(2)用BWW调节精子密度为5~10×106/ml,37℃培养6h进行体外获能(获能组);(3)体外获能后加入Ca2+载体A 23187(Sigma,C 7522) 5μmol/L,37℃继续培养30min诱导顶体反应(AR组);(4)用含枸橼酸钠0.74%,果糖1.35%的低渗溶液于37℃水浴中培养30min,进行低渗膨胀试验(HOS组),方法见参考文献[3]。
, http://www.100md.com
2. 细胞悬液制备
各组精子悬液以500×g离心5min,弃上清,精子沉淀用PBS悬浮,离心洗涤,用适量PBS再悬浮精子,加入等体积的2.5%戊二醛/PBS混匀,室温固定30min(或4℃过夜);离心弃戊二醛,并用PBS洗涤2遍,调节精子浓度为约20×106/ml备用。
3. 阳离子膜玻片制备
取洁净的盖玻片浸入100%酒精5min以上,取出晾干,浸入0.05%~0.1%多聚-L-赖氨酸(poly-L-Lysine,PLL;Sigma)水溶液5min或将PLL滴于盖玻片上并静置于湿盒中5min;取出盖玻片并用双蒸水冲洗除去残余PLL,以便PLL在盖玻片上形成单层阳离子膜,立即用于细胞贴片或晾干贮存于-20℃中备用。
4. 单层细胞贴片制备
, http://www.100md.com
将经PBS洗涤过的精子悬液适量滴于阳离子膜玻片上,倾斜玻片使液滴扩展至所需面积,湿盒内静置10min,光镜下监控至细胞贴附于玻片上;用PBS冲洗玻片以除去残余细胞;双蒸水冲洗细胞贴片。
5. 细胞脱水与干燥
按叔丁醇冷却干燥法[4]改良:细胞贴片用系列酒精脱水:60%→70%→80%→90%→95%→100%→100%,各浸泡5min;转入100%酒精与100%叔丁醇(tert-butylalcohol,TBA,上海试剂一厂)等量混合液浸泡5min,100% TBA浸透5min,2次;取出贴片平放于玻璃平皿内置的青霉素瓶塞上,速加一大滴TBA,转入4℃冰箱放置10~15min使TBA冷却结晶;移入玻璃真空干燥器内,抽气45~60min,至玻片上结晶升华完毕,停止抽气并关闭干燥器通气口;待干燥器复温后取出玻片,干燥处保存待复型。
6. 铂碳喷镀复型制备
, http://www.100md.com
将细胞贴片置于真空喷镀仪(Hitachi, HUS-5)的旋转台上,于≤10-5mbar的真空状态下作铂-碳喷镀。喷镀参数调整为:铂珠直径D=0.5~1.0mm,铂喷射角40°、碳喷射角90°,喷射源距12cm;以投影或旋转(60r/min)方式先后喷镀铂和碳;取出玻片,用刀片在铂-碳复型膜上轻划出线距约2mm的网格,滴1滴3%氢氟酸于复型膜表面,使膜易于从玻片上剥脱;将玻片以锐角插入双蒸水中,使膜漂浮于水面,用细玻棒或白金耳环捞移复型膜,双蒸水洗2~3次;入次氯酸钠腐蚀液≥60min(必要时换1次腐蚀液),移入双蒸水漂洗3次;200~400目铜网捞膜,避尘晾干待透射电镜观察。
7. 扫描电子显微镜对照制样和观察
按常规方法操作[4]:活精子贴片经系列酒精脱水,临界点干燥,离子溅射镀金,日立扫描电子显微镜S-520观察。
以上实验共重复5次,每次每组制备2平行样(2玻片),每片观察≥50个精子。
, 百拇医药
结 果
在透射电子显微镜(TEM)下观察,可见各组精子表面超微结构各具特点。(1)正常组:精子表面复型形态完整,立体感强,呈浮雕状,精子头部分区明显,顶体后环(post-acrosomal ring,PAR)和核后环(post-nuclear ring,PNR)十分清楚,顶体前区与赤道段(equatorial segment, ES)之间的界限较明显,甚至可见质膜颗粒(图1);与放大倍数相近的SEM图像(图4)比较,可以观察到更丰富的细节、图像更加清晰。尾部各段结构特征性强,中段的螺旋状线粒体、主段的肋柱(rib column,RC)和纵行的拉链状结构(zip structure,ZS)以及末段等超微结构均清晰可辨(图2,3)。(2)获能组:精子形态分为两类,一类与正常组形态相同,另一类约半数以上精子,顶体区质膜局部呈山嵴状隆起,形成网络状形貌,顶体前区与赤道段之间界限消失(图5);(3)AR组:精子形态分为3类,其中两类与正常组和获能组所见相同,第3类精子的顶体区出现巨大变化。其中,部分精子顶体区出现大量互相吻合的膜泡(图6),另一部分精子顶体区以PAR为界形成低洼地带,其表面颗粒密集排列类似晶格状,可能是顶体破裂,膜系丢失,顶体内膜(inner acrosomal membrane,IAM)暴露所致(图7)。(4)HOS组:经低渗膨胀试验(hypo-osmotic swelling test,HOS)后,精子尾部卷曲,质膜部分膨胀但表面形态仍基本保持,如RC和ZS往往依然清晰可辨;头部结构出现与获能或AR后精子类似的形态变化(图8,9)。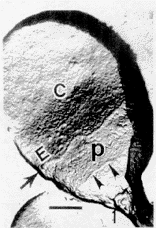


, 百拇医药
图1 活精子头部表面复型。↑.顶体后环 .核后环 E.赤道段 C.顶体区 P.顶体后区,标尺示0.5μm(下同)
.核后环 E.赤道段 C.顶体区 P.顶体后区,标尺示0.5μm(下同)
Fig.1 Surface-replica of motile sperm.↑:post-acrosomal ring; : :post-nuclear ring; C:acrosomal cap; E:equatorial segment; P:post acrosomal area.Bar=0.5μm
:post-nuclear ring; C:acrosomal cap; E:equatorial segment; P:post acrosomal area.Bar=0.5μm
图2 精子尾部中段表面复型。M.线粒体
Fig.2 Middle piece of sperm tail.M:mitochondrion.
, http://www.100md.com
图3 精子尾部主段表面复型。Z.拉链状结构 R.肋柱Fig.3 Principle piece of sperm tail.Z:zip structure; R:rib column.
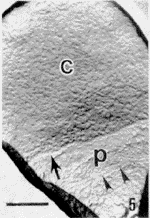

图4 人精子扫描电子显微镜图像
Fig.4 Scanning electron microscopy of human sperm.
图5 获能6h的人精子头部变化
Fig.5 Human sperm capacitated in BWW for 6h.
, 百拇医药
图6 顶体反应中的人精子表面复型图像
Fig.6 Acrosome reacting sperm.
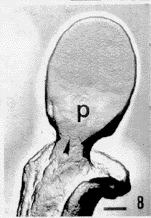
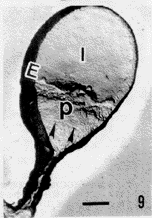
图7 顶体反应后的人精子表面复型图像 I.顶体内膜
Fig.7 Acrosome reacted sperm.I:inner acrosomal membrane.
图8 低渗膨胀试验后人精子复型图像
Fig.8 Human sperm after HOS test.
, 百拇医药
图9 低渗膨胀试验后人精子复型图像
Fig.9 Ibid
讨 论
1. 表面复型技术应用评价
从实验结果看,表面复型技术可以清晰地显示精子表面超微结构的形态特点,对精子不同生理状态的表面形态揭示清楚。体外获能组的观察表明,半数以上精子顶体区质膜局部呈山嵴状隆起,形成网络状形貌,顶体前区与赤道段之间界限消失。此现象可能具有理论价值,因为传统的观点基于超薄切片和SEM观察,认为人精子获能没有形态上的改变[5],该现象是否代表精子获能的形态特征,有待通过针对性的实验进一步加以研究。AR组和HOS组的观察表明,表面复型可清楚地显示这两种生理状态的特征性变化,这对精子生物学研究很有意义。以往在建立各种适用于临床诊断或光镜观察的AR检测技术时,都采用超薄切片技术对AR做权威判断,但超薄切片技术程序复杂,耗时而昂贵,而且无法进行全表面观察,表面复型技术则可以克服这些缺点;此外,由于超薄切片技术难于保持精子头尾连贯,所以无法观察HOS精子的头部变化,表面复型有助于填补这一空缺。综上所述,表面复型技术在细胞表面超微结构研究上具有良好而独特的应用价值。
, 百拇医药
2. 表面复型技术方法评价
本研究经过反复实验,定型程序经过5次重复实验,结果相似,表明该技术程序具有良好可重复性。该技术方法较简单、操作方便、不要求特殊仪器设备,一般电镜实验室均可开展,实用性强。与普通扫描电子显微镜(SEM)图像比较,其图像更加清晰,分辨率高于SEM,但表面复型技术比SEM技术在制样程序上多了2步——氢氟酸揭膜和次氯酸钠腐蚀液以及其后的清洗,但因其具有较高分辨率,这个缺点似不足道。此外,由于铂-碳复型膜能萃取胶体金颗粒,将胶体金免疫细胞化学技术与表面复型相结合,可对细胞表面受体或抗原分布进行研究[6],具有独特优点。
3. 表面复型技术关键
本文材料与方法中叙述的是经过多次反复试验而定型的技术程序,要获得良好的细胞表面复型样品,应重点把握好以下几个环节:
3.1 细胞在悬液中固定之后要充分洗涤,除去戊二醛,否则细胞将不能牢固吸附于阳离子膜玻片上。
, http://www.100md.com
3.2 在叔丁醇冷却干燥前的所有步骤中应避免任何可能使细胞自然干燥的误操作,以免细胞表面结构受到溶液蒸发张力的破坏。因此,要使细胞在悬液中自然沉降并牢固地贴附于玻片表面并形成互不层叠的单层,而不能采用常规血液涂片的方法制备细胞“涂片”,故本研究采用“贴片”一词以示区别。为制备理想的单层细胞贴片,关键在于正确制备阳离子膜,首先玻片要洁净,并用100%酒精浸泡作亲水处理,其次是当玻片接触多聚赖氨酸(PLL)后要立即用蒸馏水冲洗,避免PLL残留于玻片表面,否则将使细胞凝集成团。此外,细胞悬液滴于阳离子膜玻片上后要在湿盒中静置,避免悬液干涸,待细胞贴牢后要立即洗涤除去多余细胞。
3.3 冷却干燥前要事先检查叔丁醇质量,叔丁醇的冰点为23~25℃,100%叔丁醇在≤23℃时应能结晶,若不能结晶,表明其已吸收了水分,不宜使用。将浸没于叔丁醇的细胞贴片移入4℃冷却,是为了使叔丁醇结晶,以便在真空中升华而干燥,所以要注意避免其在结晶前蒸发干燥。当室温≤23℃时,涉及叔丁醇的操作宜在温箱中进行。
, 百拇医药
3.4 金属喷镀时,喷射源距(铂珠或碳棒与细胞贴片中心的直线距离)以11~12cm为宜,不得小于10cm,以免造成样品的辐射损伤。喷镀后在复型膜上划网格,是为了使氢氟酸通过网格线的缝隙渗透至铂-碳复型膜下方溶解玻片表面,使膜剥离,复型膜腐蚀时间要足够,腐蚀后洗涤要充分。
参考文献
[1]朱丽霞,程乃乾,高信曾,编著.生物学中的电子显微镜技术.北京:北京大学出版社,1983:81~91
[2]江一平,余庆亮,刘秀玲,等.异种体外受精实验模型的建立及其方法学探讨.福建医学院学报,1991,25(4):297
[3]Jeyendran RS,Van der ven HH,Perez-Pelaez M,et al.Development of an assay to assess the functional integrity of the human sperm membrane and its relationship to other semen characteristics.J Reprod Fertil, 1984,70(2):219
[4]应国华主编.医学生物学电镜技术与细胞超微结构.香港:香港现代出版社,1993:59~72
[5]Bedford JM.Sperm capacitation and fertilization in mammals.Biol Reprod Suppl,1970,2(2):125
[6]江一平,吴翊钦,钟秀容,等.精子凝集素受体金标表面复型术.电子显微学报,1994,13(5):387, http://www.100md.com
单位:江一平 吴翊钦 钟秀容 林芸秀 魏玉珍 福建医科大学组织学与胚胎学教研室;电镜室,福州 350004
关键词:表面复型;电子显微镜;获能;顶体反应;精子
解剖学报990225
【摘要】 目的 建立实用的实验程序,观察不同功能状态下的精子表面超微结构特点。 方法 用BWW上游法分离活动的人精子:BWW体外获能、诱导顶体反应和低渗膨胀试验处理后,将精子贴附于阳离子膜玻片上,叔丁醇冷却干燥后真空铂-碳喷镀复型。复型膜经3%氢氟酸剥脱,次氯酸钠腐蚀,透射电镜观察。 结果 人精子表面复型图像清晰,立体感强,细节较丰富、清晰,获能精子顶体区呈网络状,顶体反应时可见顶体区大量互相吻合的小泡,经低渗处理的精子顶体区出现类似获能和顶体反应的现象。 结论 表面复型-透射电镜技术可用于观察精子的不同生理状态引起的表面形貌变化,方法简便,可重复性好,具有良好的应用价值。
, 百拇医药
THE FUNCTIONAL ULTRASTRUCTURE OF SPERMATOZOA
VIEWING BY SURFACE-REPLICA TRANSMISSION
ELECTRON MICROSCOPY
Jiang YipingΔ, Wu Yiqin, Zhong Xiurong, Lin Yunxiu, Wei Yuzhen
(Department Histology and Embryology, Lab ratory Electron Microscopy,Fujian Medical University,Fuzhou)
【Abstract】 Objective To assess the variability of the surface-replica method for the observation of functional ultrastructure of human sperm.Methods Motile human spermatozoa,separated by swimming up in BWW,before-after capacitation,induced acrosome reaction and pretreated with hypoosmotic medium (HOS test),were fixed,layered on the poly-L-lysine coated slide-cover glass and dehydrated by tert-butanol method.The sperms on cover glass were coated by Pt/C shadowing in high vacuum to form surface-replica film.The film was stripped from glass by 3% hydrofluoric acid and digested with NaClO and then,after drying,was observed under transmission electron microscope.Results The images of surface-replica of human sperm were clear and stereo to show the surface geomorphology of spermatozoa in different physiological state.Conclusion The method of surface-replica can be used to analyze the functional altervation of sperm in ultrastructural level.
, 百拇医药
【Key words】 Surface-replica; Electron microscopy; Capacitation; Acrosome reaction; Spermatazoon
精子在成熟和受精过程中生理状态发生很大变化,许多变化往往可表现在细胞表面超微结构上,超薄切片透射电镜难于观察细胞全表面,故通常采用扫描电子显微镜技术(SEM)。由于一般SEM分辨率较低,观察精确度受到较大限制,而高分辨率的场发射SEM价格昂贵,在国内难以推广,故有必要开发既简易实用又有高分辨率的技术。本研究根据金属喷镀复型原理[1],建立了一实用的实验技术程序,报道如下。
材料和方法
1. 精子的实验处理
手淫法采集正常人精液,待其液化后以上游技术[2]分离活精子,分离用培养液采用BWW(配方见参考文献[2]);精子悬液分别进行下述处理:(1)不经任何处理直接制样(正常组);(2)用BWW调节精子密度为5~10×106/ml,37℃培养6h进行体外获能(获能组);(3)体外获能后加入Ca2+载体A 23187(Sigma,C 7522) 5μmol/L,37℃继续培养30min诱导顶体反应(AR组);(4)用含枸橼酸钠0.74%,果糖1.35%的低渗溶液于37℃水浴中培养30min,进行低渗膨胀试验(HOS组),方法见参考文献[3]。
, http://www.100md.com
2. 细胞悬液制备
各组精子悬液以500×g离心5min,弃上清,精子沉淀用PBS悬浮,离心洗涤,用适量PBS再悬浮精子,加入等体积的2.5%戊二醛/PBS混匀,室温固定30min(或4℃过夜);离心弃戊二醛,并用PBS洗涤2遍,调节精子浓度为约20×106/ml备用。
3. 阳离子膜玻片制备
取洁净的盖玻片浸入100%酒精5min以上,取出晾干,浸入0.05%~0.1%多聚-L-赖氨酸(poly-L-Lysine,PLL;Sigma)水溶液5min或将PLL滴于盖玻片上并静置于湿盒中5min;取出盖玻片并用双蒸水冲洗除去残余PLL,以便PLL在盖玻片上形成单层阳离子膜,立即用于细胞贴片或晾干贮存于-20℃中备用。
4. 单层细胞贴片制备
, http://www.100md.com
将经PBS洗涤过的精子悬液适量滴于阳离子膜玻片上,倾斜玻片使液滴扩展至所需面积,湿盒内静置10min,光镜下监控至细胞贴附于玻片上;用PBS冲洗玻片以除去残余细胞;双蒸水冲洗细胞贴片。
5. 细胞脱水与干燥
按叔丁醇冷却干燥法[4]改良:细胞贴片用系列酒精脱水:60%→70%→80%→90%→95%→100%→100%,各浸泡5min;转入100%酒精与100%叔丁醇(tert-butylalcohol,TBA,上海试剂一厂)等量混合液浸泡5min,100% TBA浸透5min,2次;取出贴片平放于玻璃平皿内置的青霉素瓶塞上,速加一大滴TBA,转入4℃冰箱放置10~15min使TBA冷却结晶;移入玻璃真空干燥器内,抽气45~60min,至玻片上结晶升华完毕,停止抽气并关闭干燥器通气口;待干燥器复温后取出玻片,干燥处保存待复型。
6. 铂碳喷镀复型制备
, http://www.100md.com
将细胞贴片置于真空喷镀仪(Hitachi, HUS-5)的旋转台上,于≤10-5mbar的真空状态下作铂-碳喷镀。喷镀参数调整为:铂珠直径D=0.5~1.0mm,铂喷射角40°、碳喷射角90°,喷射源距12cm;以投影或旋转(60r/min)方式先后喷镀铂和碳;取出玻片,用刀片在铂-碳复型膜上轻划出线距约2mm的网格,滴1滴3%氢氟酸于复型膜表面,使膜易于从玻片上剥脱;将玻片以锐角插入双蒸水中,使膜漂浮于水面,用细玻棒或白金耳环捞移复型膜,双蒸水洗2~3次;入次氯酸钠腐蚀液≥60min(必要时换1次腐蚀液),移入双蒸水漂洗3次;200~400目铜网捞膜,避尘晾干待透射电镜观察。
7. 扫描电子显微镜对照制样和观察
按常规方法操作[4]:活精子贴片经系列酒精脱水,临界点干燥,离子溅射镀金,日立扫描电子显微镜S-520观察。
以上实验共重复5次,每次每组制备2平行样(2玻片),每片观察≥50个精子。
, 百拇医药
结 果
在透射电子显微镜(TEM)下观察,可见各组精子表面超微结构各具特点。(1)正常组:精子表面复型形态完整,立体感强,呈浮雕状,精子头部分区明显,顶体后环(post-acrosomal ring,PAR)和核后环(post-nuclear ring,PNR)十分清楚,顶体前区与赤道段(equatorial segment, ES)之间的界限较明显,甚至可见质膜颗粒(图1);与放大倍数相近的SEM图像(图4)比较,可以观察到更丰富的细节、图像更加清晰。尾部各段结构特征性强,中段的螺旋状线粒体、主段的肋柱(rib column,RC)和纵行的拉链状结构(zip structure,ZS)以及末段等超微结构均清晰可辨(图2,3)。(2)获能组:精子形态分为两类,一类与正常组形态相同,另一类约半数以上精子,顶体区质膜局部呈山嵴状隆起,形成网络状形貌,顶体前区与赤道段之间界限消失(图5);(3)AR组:精子形态分为3类,其中两类与正常组和获能组所见相同,第3类精子的顶体区出现巨大变化。其中,部分精子顶体区出现大量互相吻合的膜泡(图6),另一部分精子顶体区以PAR为界形成低洼地带,其表面颗粒密集排列类似晶格状,可能是顶体破裂,膜系丢失,顶体内膜(inner acrosomal membrane,IAM)暴露所致(图7)。(4)HOS组:经低渗膨胀试验(hypo-osmotic swelling test,HOS)后,精子尾部卷曲,质膜部分膨胀但表面形态仍基本保持,如RC和ZS往往依然清晰可辨;头部结构出现与获能或AR后精子类似的形态变化(图8,9)。



, 百拇医药
图1 活精子头部表面复型。↑.顶体后环
 .核后环 E.赤道段 C.顶体区 P.顶体后区,标尺示0.5μm(下同)
.核后环 E.赤道段 C.顶体区 P.顶体后区,标尺示0.5μm(下同)Fig.1 Surface-replica of motile sperm.↑:post-acrosomal ring; :
 :post-nuclear ring; C:acrosomal cap; E:equatorial segment; P:post acrosomal area.Bar=0.5μm
:post-nuclear ring; C:acrosomal cap; E:equatorial segment; P:post acrosomal area.Bar=0.5μm图2 精子尾部中段表面复型。M.线粒体
Fig.2 Middle piece of sperm tail.M:mitochondrion.
, http://www.100md.com
图3 精子尾部主段表面复型。Z.拉链状结构 R.肋柱Fig.3 Principle piece of sperm tail.Z:zip structure; R:rib column.



图4 人精子扫描电子显微镜图像
Fig.4 Scanning electron microscopy of human sperm.
图5 获能6h的人精子头部变化
Fig.5 Human sperm capacitated in BWW for 6h.
, 百拇医药
图6 顶体反应中的人精子表面复型图像
Fig.6 Acrosome reacting sperm.



图7 顶体反应后的人精子表面复型图像 I.顶体内膜
Fig.7 Acrosome reacted sperm.I:inner acrosomal membrane.
图8 低渗膨胀试验后人精子复型图像
Fig.8 Human sperm after HOS test.
, 百拇医药
图9 低渗膨胀试验后人精子复型图像
Fig.9 Ibid
讨 论
1. 表面复型技术应用评价
从实验结果看,表面复型技术可以清晰地显示精子表面超微结构的形态特点,对精子不同生理状态的表面形态揭示清楚。体外获能组的观察表明,半数以上精子顶体区质膜局部呈山嵴状隆起,形成网络状形貌,顶体前区与赤道段之间界限消失。此现象可能具有理论价值,因为传统的观点基于超薄切片和SEM观察,认为人精子获能没有形态上的改变[5],该现象是否代表精子获能的形态特征,有待通过针对性的实验进一步加以研究。AR组和HOS组的观察表明,表面复型可清楚地显示这两种生理状态的特征性变化,这对精子生物学研究很有意义。以往在建立各种适用于临床诊断或光镜观察的AR检测技术时,都采用超薄切片技术对AR做权威判断,但超薄切片技术程序复杂,耗时而昂贵,而且无法进行全表面观察,表面复型技术则可以克服这些缺点;此外,由于超薄切片技术难于保持精子头尾连贯,所以无法观察HOS精子的头部变化,表面复型有助于填补这一空缺。综上所述,表面复型技术在细胞表面超微结构研究上具有良好而独特的应用价值。
, 百拇医药
2. 表面复型技术方法评价
本研究经过反复实验,定型程序经过5次重复实验,结果相似,表明该技术程序具有良好可重复性。该技术方法较简单、操作方便、不要求特殊仪器设备,一般电镜实验室均可开展,实用性强。与普通扫描电子显微镜(SEM)图像比较,其图像更加清晰,分辨率高于SEM,但表面复型技术比SEM技术在制样程序上多了2步——氢氟酸揭膜和次氯酸钠腐蚀液以及其后的清洗,但因其具有较高分辨率,这个缺点似不足道。此外,由于铂-碳复型膜能萃取胶体金颗粒,将胶体金免疫细胞化学技术与表面复型相结合,可对细胞表面受体或抗原分布进行研究[6],具有独特优点。
3. 表面复型技术关键
本文材料与方法中叙述的是经过多次反复试验而定型的技术程序,要获得良好的细胞表面复型样品,应重点把握好以下几个环节:
3.1 细胞在悬液中固定之后要充分洗涤,除去戊二醛,否则细胞将不能牢固吸附于阳离子膜玻片上。
, http://www.100md.com
3.2 在叔丁醇冷却干燥前的所有步骤中应避免任何可能使细胞自然干燥的误操作,以免细胞表面结构受到溶液蒸发张力的破坏。因此,要使细胞在悬液中自然沉降并牢固地贴附于玻片表面并形成互不层叠的单层,而不能采用常规血液涂片的方法制备细胞“涂片”,故本研究采用“贴片”一词以示区别。为制备理想的单层细胞贴片,关键在于正确制备阳离子膜,首先玻片要洁净,并用100%酒精浸泡作亲水处理,其次是当玻片接触多聚赖氨酸(PLL)后要立即用蒸馏水冲洗,避免PLL残留于玻片表面,否则将使细胞凝集成团。此外,细胞悬液滴于阳离子膜玻片上后要在湿盒中静置,避免悬液干涸,待细胞贴牢后要立即洗涤除去多余细胞。
3.3 冷却干燥前要事先检查叔丁醇质量,叔丁醇的冰点为23~25℃,100%叔丁醇在≤23℃时应能结晶,若不能结晶,表明其已吸收了水分,不宜使用。将浸没于叔丁醇的细胞贴片移入4℃冷却,是为了使叔丁醇结晶,以便在真空中升华而干燥,所以要注意避免其在结晶前蒸发干燥。当室温≤23℃时,涉及叔丁醇的操作宜在温箱中进行。
, 百拇医药
3.4 金属喷镀时,喷射源距(铂珠或碳棒与细胞贴片中心的直线距离)以11~12cm为宜,不得小于10cm,以免造成样品的辐射损伤。喷镀后在复型膜上划网格,是为了使氢氟酸通过网格线的缝隙渗透至铂-碳复型膜下方溶解玻片表面,使膜剥离,复型膜腐蚀时间要足够,腐蚀后洗涤要充分。
参考文献
[1]朱丽霞,程乃乾,高信曾,编著.生物学中的电子显微镜技术.北京:北京大学出版社,1983:81~91
[2]江一平,余庆亮,刘秀玲,等.异种体外受精实验模型的建立及其方法学探讨.福建医学院学报,1991,25(4):297
[3]Jeyendran RS,Van der ven HH,Perez-Pelaez M,et al.Development of an assay to assess the functional integrity of the human sperm membrane and its relationship to other semen characteristics.J Reprod Fertil, 1984,70(2):219
[4]应国华主编.医学生物学电镜技术与细胞超微结构.香港:香港现代出版社,1993:59~72
[5]Bedford JM.Sperm capacitation and fertilization in mammals.Biol Reprod Suppl,1970,2(2):125
[6]江一平,吴翊钦,钟秀容,等.精子凝集素受体金标表面复型术.电子显微学报,1994,13(5):387, http://www.100md.com