微囊化转TH基因人成纤维细胞脑内移植治疗帕金森病大鼠模型的研究
作者:戴晓玲 张进禄 徐群渊 赵春礼 赵焕英 孙晓红 郑少鹏
单位:
戴晓玲(首都医科大学北京神经科学研究所,北京 100054);张进禄(首都医科大学北京神经科学研究所,北京 100054);徐群渊(首都医科大学北京神经科学研究所,北京 100054);赵春礼(首都医科大学北京神经科学研究所,北京 100054);赵焕英(首都医科大学北京神经科学研究所,北京 100054);孙晓红(首都医科大学北京神经科学研究所,北京 100054)
关键词:帕金森病;基因治疗;酪氨酸羟化酶;人成纤维细胞;微囊;大鼠
解剖学报000407 【摘要】 目的 探讨微囊化转酪氨酸羟化酶(TH)基因的细胞在帕金森病(PD)大鼠模型脑内存活、组织反应及对异常行为的治疗效果。 方法 以人TH基因作为目的基因,重组到逆转录病毒载体感染人成纤维细胞,将细胞包裹在APA半透膜中进行微囊化后,植入6-羟多巴胺单侧损毁的PD大鼠模型纹状体内,观察移植物的存活状况和功能作用16周。 结果 体外和植入体内的微囊化转基因细胞具有良好的存活能力。移植微囊化细胞可以使大鼠异常运动明显改善,移植位点周围的免疫反应较小。 结论 微囊化对转基因细胞异种移植以进行基因治疗具有显著意义。
, 百拇医药
【中图分类号】 R74.25 【文献标识码】 A 【文章编号】 0529-1356(2000)04-317
AN EXPERIMENTAL STUDY ON GENE THERAPY WITH
INTRACEREBRAL TRANSPLANTATION OF MICROCAPSULATED
HUMAN FIBROBLASTS EXPRESSING TH GENE
IN RAT MODEL OF PARKINSON DISEASE
DAI Xiao-ling ZHANG Jin-lu XU Qun-yuan ZHAO Chun-li ZHAO Huan-ying SUN Xiao-hong ZHENG Shao-peng
, 百拇医药
(Beijing Institute for Neuroscience, Capital University of Medical Sciences, Beijing 100054, China)
【Abstract】 Objectives The aim of this study was to evaluate the survival of the grafts, their immune response from hostissue and improvement of the locomotion after the intracerebral transplantation of microcapsulated genetically modified cells in the rat model of Parkinson Disease(PD). Methods The human tyrosine hydroxylase(TH) gene was recombined into a retrovirus vector and the newly constructed vector was then transfected into primary cultured human fibroblasts in vitro.These human fibroblasts were microcapsulated by the alginate-polylysine-alginate(APA)semipermeable membrane. The rat model of PD was made by unilateral 6-OHDA injection in the midbrain. These microcapulated genetically modified human fibroblasts were transplanted into the brain of the rat models. Results The microcapsulated cells could survive well in vivo at least 16 weeks. The grafting of these cells could induce a marked decrease in abnormal locomotion for the animal models and make a less immunorejection from host tissue. Conclusion The APA-microcapsulation may help gene therapy by use of xenograft with genetically modified cells.
, http://www.100md.com
【Key words】 Parkinson disease; Gene therapy; Tyrosine hydroxylase; Human fibroblast; Microcapsule; Rat
帕金森病(Parkinson Disease, PD)的主要病理特征为中脑黑质多巴胺(dopamine, DA)能神经元变性,使纹状体内的DA显著减少而出现一系列临床症状。将分泌多巴胺的胚胎中脑细胞或肾上腺髓质细胞进行纹状体内移植,能一定程度地逆转或改善患者的症状。此外,新近发展起来的基因治疗方法,即利用各种转基因技术,将外源性基因如DA合成限速酶-酪氨酸羟化酶(tyrosine hydroxylase,TH)基因转入某种体外培养的细胞内,再将此基因工程细胞植入模型动物脑内,使之在纹状体表达TH[1,2],而达到提高DA水平的目的。但是,大量研究证明,无论用哪种细胞植入脑内都存在宿主免疫排斥的问题,在进行同种异体基因和异种基因细胞移植中尤为显著[3]。现有报道,将丙烯共聚物微囊植入大鼠脑内诱导的宿主组织反应较小。这种通过分子量界值为50 000道尔顿的微囊半透膜容许营养物质、生长因子和神经递质等小分子自由扩散,但能阻止大分子的免疫球蛋白和宿主细胞跨过微囊膜攻击移植细胞,从而对移植物提供免疫隔离[4],故用微囊包裹的细胞移植势必大大减少宿主的免疫排斥并提高移植物的存活率。据此,本研究拟对转TH基因的人成纤维细胞进行藻酸盐-多聚赖氨酸-藻酸盐(alginate-poly-lysine-alginate,APA)半透膜聚合物微囊包裹后植入大鼠纹状体内,以探求用成纤维细胞进行脑内异种移植治疗帕金森病实际应用的可能性。
, http://www.100md.com
材料和方法
1.大鼠PD模型的建立
将体重190~200g的雌性SD大鼠(首都医科大学实验动物部提供)用6%水和氯醛(0.05ml/kg腹腔注射)麻醉,置于脑立体定位仪行开颅手术;在脑内两点定位注射1%6-OHDA(6-hydroxydopamine, Sigma)各4μl[5],以损毁脑一侧黑质神经元。术后1周,大鼠颈部皮下注射Apomorphine(0.05mg/kg),然后置于PD大鼠模型旋转记录仪[6]上进行行为学检测。每周1次,每次40min,连续测量4周;出现向损毁对侧旋转次数大于7圈/min的大鼠可视为PD动物模型,共38只,供脑移植用。
2.运载细胞人成纤维细胞的培养
取临床消毒后流产胎儿(胎龄4个月)皮肤,剪碎后用0.1%胰蛋白酶消化30min,血清中和后离心去上清;Hank液洗1~2遍,用含10%胎牛血清的DEME培养基(DEME/FCS,Gibco/BL)反复吹打,制成细胞悬液;将其按5×105的细胞密度接种于50ml培养瓶中进行培养。
, 百拇医药
3.带有TH基因的pLhTHSN质粒的重组
用两种DNA,即质粒pLXSN(逆转录病毒载体,海军总医院黄晋生博士惠赠)和质料pRcTH(含人TH基因,由美国Somatix Therapy Corporation提供)构建新的质粒pLhTHSN。用限制性内切酶EcoRI酶切pRcTH,回收并纯化1.8 kb片段作为人TH(hTH)基因的插入片段。用限制性内切酶EcoRI酶切pLXSN,用适量的CIAP进行脱磷酸反应作为逆转录病毒载体。将5.8kb的载体DNA片段和1.8 kb的目的基因片段纯化后,两者按照1∶3~5的比例加入连接反应体系中,在T4 DNA连接酶作用(12℃,过夜)下进行连接反应,两者连接后可使hTH基因插入载体中。然后转化到XL1-Blue大肠杆菌感受态细胞。挑选转化后过夜生长的12个连接转化菌落,用煮沸法从中小量提取质粒DNA,并用限制性内切酶EcoRI、XhoI和BamHI进行酶切和电泳分析,以验证质粒是否携带hTH基因和其插入方向是否正确。经确认后,用碱裂解法大量提取质粒pLhTHSN以用于基因转移。
, http://www.100md.com
4.pLhTHSN质粒转染培养的人成纤维细胞
用含hTH基因的逆转录病毒载体pLhTHSN用磷酸钙沉淀法转染单向包装细胞系ψ-2,48h后收集含ψ-2细胞出芽的病毒颗粒的上清,感染双相包装细胞系PA317;用G418对PA317进行筛选,对形成的抗G418细胞克隆分别进行扩增培养,并用抗人TH的单克隆抗体进行细胞免疫组织化学染色;当抗性细胞表现为TH免疫组织化学染色阳性而表明有TH基因表达后,大量扩增培养,收集病毒上清;用整合有pLhTHSN的PA317细胞克隆产生的病毒上清感染人成纤维细胞,用抗人TH抗体进行免疫组织化学染色;经证实能表达TH后,将细胞大量扩增,制成细胞悬液用于微囊化处理和大鼠纹状体内移植。
5.微囊化转人TH基因的成纤维细胞
将转染的人成纤维细胞送301医院临床基础研究所,用微囊静电发生器进行微囊化处理,微囊为APA微囊[7]。
, http://www.100md.com
6.转入TH基因的成纤维细胞大鼠纹状体内移植
将PD大鼠模型作为宿主动物分为3组,微囊化人成纤维细胞移植组(Ⅰ组)和未微囊化人成纤维细胞移植组(Ⅱ组)各15只,空囊移植组(C组)8只作为对照组。3组动物均经腹腔注射6%水和氯醛(0.05ml/kg)麻醉,置于脑立体定位仪上,进行开颅手术。将上述转入TH基因的微囊化和未微囊化的人成纤维细胞,按照每只1×106的细胞数,分别为15μl和20μl细胞悬液,分两点立体定位注射到大鼠PD模型一侧脑内纹状体(尾壳核)内。在对照组的大鼠脑内移植空囊悬液。
7.行为学及形态学检测
在经相同方法进行移植后,术后动物分别存活2~16周。对上述3组植入不同移植物的动物按照不同的存活时间分成小组,所有动物都在术后按前述制作模型的方法进行旋转实验。根据不同的存活期灌杀动物,即经升主动脉先注入温生理盐水200ml,然后注入4℃含4%多聚甲醛的0.1mol/L磷酸缓冲液(pH7.4)250 ml;灌杀后立即取脑,置于含30%蔗糖的4%多聚甲醛中后固定24h后,进行冰冻连续切片(50μm),将切片分组后分别行TH,胶质细胞酸性蛋白(glial-fibrillary-acidic-protein,GFAP)和CD8免疫组织化学染色,即顺序将切片入分别用小鼠抗TH抗体(1∶1 000,Sigma公司)、GFAP抗体和单克隆小鼠抗T细胞CD8抗体(1∶100,DAKO公司)作为一抗、用生物素标记的羊抗鼠IgG抗体(1∶300,Vector公司)作为二抗和HRP标记的抗生物素复合物作为三抗的0.1mol/L磷酸缓冲液中,然后用含0.5%DAB的0.1mol/L磷酸缓冲液进行染色,以显示其免疫活性。染色后取部分切片进行焦油固紫复染。
, http://www.100md.com
结 果
1.逆转录病毒载体pLhTHSN的构建
用质粒pRcTH和pLXSN新构建出来的质粒pLhTHSN经酶切分析,显示其均带有TH基因(1.8kb);这些质粒用XhoI/BamHI双酶切分析,产生两个片段,即1.4kb和6.2kb,证明重组质粒中TH基因的插入方向是正确的。新构建的质粒图解见图1。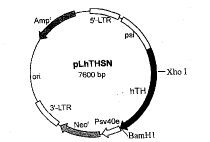
图1 新构建的质粒pLhTHSN基因图,其中TH基因插入方向正确
Fig.1 The gene map of the reconstructed plasmid pLhTHSN.
2.转基因成纤维细胞的基因表达
, 百拇医药
将新构建的逆转录病毒载体pLhTHSN导入培养的人成纤维细胞,2~3d后,TH免疫组织化学方法染色可见50%细胞被染成棕色(图2),显示有TH表达。
3.微囊化细胞的体外培养
经微囊包裹后,光镜下体外观察可见细胞存活(图3),细胞密度随培养时间增长;存活细胞中也可见细胞的重影和碎片,这主要发生在囊的中央。对微囊化细胞的TH染色在任何时间均呈阳性。
图2 pLhTHSN转染人成纤维细胞后的TH免疫细胞化学染色。↑示TH反应阴性细胞,其他均为TH反应阳性细胞 ×200
Fig.2 The immunocytochemical staining of TH in pLhTHSN transfected human fibroblasts. Arrows indicate TH-negative fibroblasts, the other fibroblasts are TH-positive. ×200
, http://www.100md.com
图3 微囊化转TH基因的人成纤维细胞 ×40
Fig.3 Microcapsulated TH-expressed human fibroblast.×40
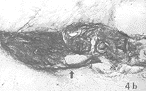
图4 移植后PD大鼠模型脑切片。TH免疫细胞化学染色。
a. 微囊化转TH基因细胞移植组(Ⅰ组)的TH免疫细胞化学染色,术后存活2周。↑示微囊化的细胞。▲示微囊 ×200
b. 未微囊化转TH基因细胞移植组(Ⅱ组)的TH免疫细胞化学染色,术后存活16周。↑示移植物 ×100
Fig.4 Photomicrograph of the immunocytochemical staining of TH in the brain section of the PD rat model after transplantation.
, http://www.100md.com
a, The immunocytochemical staining of TH in microcapsulated TH-expressed human fibroblasts transplantation group(Ⅰ Group).The arrow indicates the microcapsulated fibroblasts. The triangle indicates the microcapsule. The post-transplantation time is 2 weeks.×200
b, The immunocytochemical staining of TH in non-microcapsulated TH-expressed human fibroblasts transplantation group(Ⅱ Group). The arrow indicates the graft. The post-transplantation time is 16 weeks.×100

, http://www.100md.com
图5 移植后PD大鼠模型脑切片CD8免疫细胞化学染色。
a.微囊化转基因细胞移植组(Ⅰ组)的CD8免疫细胞化学染色,术后存活2周。 ▲示微囊 ×100
b.未微囊化转基因细胞移植组(Ⅱ组)的CD8免疫细胞化学染色,术后存活2周。 ↑示移植物 ×100
Fig.5 Photomicrograph of the immunocytochemical staining of CD8 in the brain section of the PD rat model after transplantation.
a, The immunocytochemical staining of CD8 in microcapsulated TH-expressed human fibroblasts transplantation group(Ⅰ Group). The triangle indicates the microcapsule. The post-transplantation time is 2 weeks. ×100
, 百拇医药
b, The immunocytochemical staining of CD8 in non-microcapsulated TH-expressed human fibroblast transplantation group(Ⅱ Group). The arrow indicates the graft. The post-transplantation time is 2 weeks. ×100

图6 移植后PD大鼠模型脑切片GFAP免疫细胞化学染色。
a.微囊化转基因细胞移植组(Ⅰ组)的GFAP免疫细胞化学染色,术后存活4周。 ▲示微囊 ×100
b.未微囊化转基因细胞移植组(Ⅱ组)的GFAP免疫细胞化学染色,术后存活4周。↑示星型胶质细胞 ▲示移植物 ×100
, http://www.100md.com
Fig.6 Photomicrograph of the immunocytochemical staining of GFAP in the brain section of the PD rat model after transplantation.
a, The immunocytochemical staining of GFAP in microcapsulated TH-expressed human fibroblasts transplantation group(Ⅰ Group). The triangle indicates the microcapsule. The post-transplantation time is 4 weeks.×100
b,The immunocytochemical staining of GFAP in non-microcapsulated TH-expressed human fibroblasts transplantation group(Ⅱ Group). The arrows indicate the astrocytes. The triangle indicates the graft. The post-transplantation time is 4 weeks. ×100
, http://www.100md.com
4.动物行为的检测
实验动物Ⅰ组和Ⅱ组在移植手术后1周行为即有改变:Ⅰ组动物的旋转圈数由术前12.1圈/min(n=15)减少至3.7圈/min(n=15),持续到16周;Ⅱ组动物的旋转圈数由术前11.9圈/min(n=15)减少至5.6圈/min(n=13);C组动物的旋转圈数术前术后均为13.7圈/min(n=8)(图7)。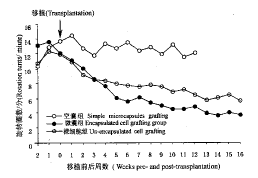
图7 PD动物模型脑内移植转基因成纤维
细胞前后单侧旋转测试
Fib.7 The rotation test of PD rat model
pre-and post-transplantation.
, 百拇医药
5.脑内移植物形态学检测
在动物不同存活期脑切片上可见:Ⅰ组动物脑内可见呈球形微囊轮廓的移植物,囊中有深棕色TH免疫反应的成纤维细胞(图4a),移植物周围(囊外)有TH免疫反应物质浸润;移植物细胞和浸润区的大体数量和范围在16周内无明显变化。Ⅱ组动物脑内移植物也呈深棕色TH免疫反应,周围也有TH免疫反应物质浸润,但随时间延长其表达下降,从第8周起范围明显减少,第16周时仅见少量(图4b),有时还出现坏死。C组动物脑内未出现TH阳性反应。Ⅱ组动物移植位点周围GFAP和CD8免疫反应相对较强烈,出现深棕色CD8阳性颗粒(图5b),GFAP阳性的星形胶质细胞多且明显(图6b);Ⅰ组动物和C组动物移植位点周围GFAP和CD8免疫反应相似,CD8阳性颗粒(图5a)和GFAP阳性细胞(图6a)数量和范围少于Ⅱ组动物。
讨 论
本研究是将能表达TH基因的pLhTHSN质粒转入人成纤维细胞,再经APA人工半透膜包囊后植入PD大鼠模型纹状体内。实验证明,它与未微囊化的转基因细胞一样能有效改善PD大鼠模型的不正常运动行为。不仅如此,微囊化的异种转TH基因细胞在脑内引起的免疫排斥反应比未微囊化的细胞小,预示其能存活和表达更长时间。因此可以认为,APA半透膜微囊包裹既对转基因细胞的营养无明显不利影响,又能在异体移植中对宿主的免疫排斥反应起隔离作用。
, http://www.100md.com
从以往研究[8,9]看,植入的微囊化细胞在体内的存活状况可能与某些因素有一些关系。其中靶细胞选择有一定的作用。有报道指出,成纤维细胞是一种广泛使用、适合于基因工程改造的供移植的细胞,即它易于获取、能够在体外培养、植入脑内不易形成肿瘤。本研究证明,在体内和体外不同的环境中,转入TH基因的成纤维细胞在微囊内皆存活良好,能较好表达TH活性。由此可知,成纤维细胞是一种可供临床基因治疗选择的运载细胞。
其次,移植位点选择也有一定影响。有报道说,当移植微囊化PC12细胞治疗PD时,移入侧脑室并无效果,而移入纹状体内则有明显效果[10],这说明囊内细胞分泌的物质必须扩散到靶组织中才有作用。本研究实验结果证实了微囊化转基因细胞可在纹状体内长期存活,可以明显改善动物模型的单侧旋转运动。但从切片看,其TH扩散程度有限。因此,多点、多量定位移植是使用微囊化细胞移植必需考虑的因素。
移植细胞的数量和体积直接影响到移植手术的复杂程度和移植物的存活度。大鼠中枢神经系统中神经活性物质的需求量相对较少,一般移植的细胞数目约为106~107个,因此从理论上讲,微囊技术更适用于中枢神经系统内的移植。本研究各组所移植的细胞数目基本相同(1×106),但由于微囊化后所占体积增大,因此移植物的体积比以往实验有所加大[11](20μl)。体积加大对脑组织的影响尚需进一步观察,但从本研究看,尚未见到其有显著影响。
, 百拇医药
尽管脑是免疫“豁免”部位,但这种“豁免”并不是绝对的[3]。本实验中未微囊化细胞组移植部位TH免疫反应细胞在第8周后显著减少,呈现一定的免疫排斥现象;而微囊化细胞组则未见明显排斥,这说明人工微囊确实起到了免疫隔离的作用。本研究显示微囊化组尽管比未微囊化组的免疫反应较弱,但仍然存有免疫反应。这表示微囊并不能做到绝对的免疫隔离。微囊对巨嗜细胞和其他免疫细胞所分泌的一些低分子量的物质,如对细胞具有非特异性毒性的细胞因子(10~30kD)、自由基、H2O2和NO等并不能起到隔离作用[12];微囊壁上的孔径并不均一,呈正态分布,部分小孔面积足以允许抗体和补体通过[13]。这些都会影响移植物在体内的长期存活,但微囊化后的异种细胞在植入脑内后遭受宿主的免疫排斥毕竟较小。
另外,还需进一步研究营养支持对微囊化转基因细胞的影响。Tomac等[14]曾报告,在脑内用胶质细胞源性神经营养因子(GDNF)对黑质纹状体多巴胺系统具有保护和恢复双重功能。已证实将牛嗜铬细胞与一种分泌NGF的细胞系一同微囊化后移植,可显著增加DA的释放,改善异常的旋转行为[15]。因此将来应考虑用转基因细胞和分泌生长因子的细胞一同微囊化后移植以实施基因治疗的战略。
, http://www.100md.com
无论如何,微囊化转基因细胞异体移植对PD动物模型的基因治疗显示了有价值的应用前景,这对基因治疗的临床应用具有重要意义。
本实验中微囊化处理得到了301医院临床基础研究所薛毅珑教授的大力帮助,谨致谢意。
本文图2~6见插图第8页
【基金项目】 国家自然科学基金国际合作项目
【作者简介】 戴晓玲(1972—),女(汉族),吉林市人,硕士,讲师
作者单位:郑少鹏(首都医科大学北京神经科学研究所,北京 100054)
参考文献
[1] During MJ, Naegele JK, O'Malley KL, et al. Long-term correction of rat model of Parkinsoniam rats by a HSV vector expressing tyrosine hydroxylase[J]. Science, 1994,226(5189):1399-1403.
, 百拇医药
[2] Jiao SS, Gurevich V, Wolff JA. Long-term correction of rat model of Parkinson's disease by gene therapy[J]. Nature, 1993,362(6419):450-453.
[3] Duan WM. Immunological and inflammatory responses against intrastriatal neural grafts in the rat[J]. Lund:Lund University,1997:20\|25.
[4] Winn SR, Aebischer P, Galletti PM. Brain tissue reaction to permselective polymer capsules[J]. J Biochmed Mater Res, 1989,3(1):31-44.
, 百拇医药
[5] Cenci MA, Kaien P, Mandel RJ, et al. Dopaminergic transplantation normalize amphetecmine and apomorphine-induced for expression in the 6-hydroxydopamine-lesioned striatum[J]. Neuroscience,1992,46(4):943-957.
[6] 王克权,张进禄,徐群渊,等.BIN-1型大鼠帕金森病旋转记录仪的研制[J].医疗设备信息,1995,10(4):1~3.
[7] Sagen J. Chromaffin cell transplantation. In:Lanza RP, Chick WL(eds). Yearbook of Cell and Tissue Transplantation[M]. Dordrecht:Kluwer Academic Press,1996:71-89.
, http://www.100md.com
[8] Aebischer P, Tresco PA, Winn SR, et al. Long-term cross-species brain transplantation of a polymer-encapsulated dopamine secreting cell line[J]. Experimental Neurology,1991,111(3):269-275.
[9] Hughes M, Vassilakos A, Andrews DW, et al. delivery of a secretable adenosine deaminase though microcapules-a novel approach to somatic gene therapy[J]. Human Gene Therapy,1994,5(12):1445-1455.
[10] Date I, Ohmoto T. Neural transplantation and trophic factors in Parkinson's Disease:special reference to chromaffin cell grafting NGF support from pretransected peripheral nerve and encapsulated dopamine-secreting cell grafting[J]. Experimental Neurology, 1996,137(2):333-344.
, 百拇医药
[11] 张进禄,徐群渊,刘玉军,等.转入LacZ基因的骨骼肌细胞大鼠脑内移植存活及基因表达的研究[J].解剖学报,1996,27:140~143.
[12] Wiegand F, Kroncke KD, Kolb-Bachofen V. Macrophage-generated nitric oxide as cytotoxic factor in destruction of alginate encapsulated islets[J]. Transplantation, 1993,56(5):1206-1212.
[13] Colton CK, Avgoustiniatos ES. Bioengineering in development of the hydrid artificial pancreas[J]. J Biomech Eng, 1991,113(2):152-170.
, 百拇医药
[14] Tomac A, Lindqvist E, Lin LF, et al. Protection and repair of the nigrostriatal dopaminergic system by GDNF in vivo [J]. Nature, 1995,373(6512):335-339.
[15] Winn SR, Tresco PA, Sagen J. Microencapsulated bovine chromaffin cells in vitro:effect of density and coseeding with a NGF releasing cell[J]. J Neur Trans Plastic, 1992,3(2-3):115-124.
【收稿日期】 1999-07-30
【修回日期】 2000-03-03, 百拇医药
单位:
戴晓玲(首都医科大学北京神经科学研究所,北京 100054);张进禄(首都医科大学北京神经科学研究所,北京 100054);徐群渊(首都医科大学北京神经科学研究所,北京 100054);赵春礼(首都医科大学北京神经科学研究所,北京 100054);赵焕英(首都医科大学北京神经科学研究所,北京 100054);孙晓红(首都医科大学北京神经科学研究所,北京 100054)
关键词:帕金森病;基因治疗;酪氨酸羟化酶;人成纤维细胞;微囊;大鼠
解剖学报000407 【摘要】 目的 探讨微囊化转酪氨酸羟化酶(TH)基因的细胞在帕金森病(PD)大鼠模型脑内存活、组织反应及对异常行为的治疗效果。 方法 以人TH基因作为目的基因,重组到逆转录病毒载体感染人成纤维细胞,将细胞包裹在APA半透膜中进行微囊化后,植入6-羟多巴胺单侧损毁的PD大鼠模型纹状体内,观察移植物的存活状况和功能作用16周。 结果 体外和植入体内的微囊化转基因细胞具有良好的存活能力。移植微囊化细胞可以使大鼠异常运动明显改善,移植位点周围的免疫反应较小。 结论 微囊化对转基因细胞异种移植以进行基因治疗具有显著意义。
, 百拇医药
【中图分类号】 R74.25 【文献标识码】 A 【文章编号】 0529-1356(2000)04-317
AN EXPERIMENTAL STUDY ON GENE THERAPY WITH
INTRACEREBRAL TRANSPLANTATION OF MICROCAPSULATED
HUMAN FIBROBLASTS EXPRESSING TH GENE
IN RAT MODEL OF PARKINSON DISEASE
DAI Xiao-ling ZHANG Jin-lu XU Qun-yuan ZHAO Chun-li ZHAO Huan-ying SUN Xiao-hong ZHENG Shao-peng
, 百拇医药
(Beijing Institute for Neuroscience, Capital University of Medical Sciences, Beijing 100054, China)
【Abstract】 Objectives The aim of this study was to evaluate the survival of the grafts, their immune response from hostissue and improvement of the locomotion after the intracerebral transplantation of microcapsulated genetically modified cells in the rat model of Parkinson Disease(PD). Methods The human tyrosine hydroxylase(TH) gene was recombined into a retrovirus vector and the newly constructed vector was then transfected into primary cultured human fibroblasts in vitro.These human fibroblasts were microcapsulated by the alginate-polylysine-alginate(APA)semipermeable membrane. The rat model of PD was made by unilateral 6-OHDA injection in the midbrain. These microcapulated genetically modified human fibroblasts were transplanted into the brain of the rat models. Results The microcapsulated cells could survive well in vivo at least 16 weeks. The grafting of these cells could induce a marked decrease in abnormal locomotion for the animal models and make a less immunorejection from host tissue. Conclusion The APA-microcapsulation may help gene therapy by use of xenograft with genetically modified cells.
, http://www.100md.com
【Key words】 Parkinson disease; Gene therapy; Tyrosine hydroxylase; Human fibroblast; Microcapsule; Rat
帕金森病(Parkinson Disease, PD)的主要病理特征为中脑黑质多巴胺(dopamine, DA)能神经元变性,使纹状体内的DA显著减少而出现一系列临床症状。将分泌多巴胺的胚胎中脑细胞或肾上腺髓质细胞进行纹状体内移植,能一定程度地逆转或改善患者的症状。此外,新近发展起来的基因治疗方法,即利用各种转基因技术,将外源性基因如DA合成限速酶-酪氨酸羟化酶(tyrosine hydroxylase,TH)基因转入某种体外培养的细胞内,再将此基因工程细胞植入模型动物脑内,使之在纹状体表达TH[1,2],而达到提高DA水平的目的。但是,大量研究证明,无论用哪种细胞植入脑内都存在宿主免疫排斥的问题,在进行同种异体基因和异种基因细胞移植中尤为显著[3]。现有报道,将丙烯共聚物微囊植入大鼠脑内诱导的宿主组织反应较小。这种通过分子量界值为50 000道尔顿的微囊半透膜容许营养物质、生长因子和神经递质等小分子自由扩散,但能阻止大分子的免疫球蛋白和宿主细胞跨过微囊膜攻击移植细胞,从而对移植物提供免疫隔离[4],故用微囊包裹的细胞移植势必大大减少宿主的免疫排斥并提高移植物的存活率。据此,本研究拟对转TH基因的人成纤维细胞进行藻酸盐-多聚赖氨酸-藻酸盐(alginate-poly-lysine-alginate,APA)半透膜聚合物微囊包裹后植入大鼠纹状体内,以探求用成纤维细胞进行脑内异种移植治疗帕金森病实际应用的可能性。
, http://www.100md.com
材料和方法
1.大鼠PD模型的建立
将体重190~200g的雌性SD大鼠(首都医科大学实验动物部提供)用6%水和氯醛(0.05ml/kg腹腔注射)麻醉,置于脑立体定位仪行开颅手术;在脑内两点定位注射1%6-OHDA(6-hydroxydopamine, Sigma)各4μl[5],以损毁脑一侧黑质神经元。术后1周,大鼠颈部皮下注射Apomorphine(0.05mg/kg),然后置于PD大鼠模型旋转记录仪[6]上进行行为学检测。每周1次,每次40min,连续测量4周;出现向损毁对侧旋转次数大于7圈/min的大鼠可视为PD动物模型,共38只,供脑移植用。
2.运载细胞人成纤维细胞的培养
取临床消毒后流产胎儿(胎龄4个月)皮肤,剪碎后用0.1%胰蛋白酶消化30min,血清中和后离心去上清;Hank液洗1~2遍,用含10%胎牛血清的DEME培养基(DEME/FCS,Gibco/BL)反复吹打,制成细胞悬液;将其按5×105的细胞密度接种于50ml培养瓶中进行培养。
, 百拇医药
3.带有TH基因的pLhTHSN质粒的重组
用两种DNA,即质粒pLXSN(逆转录病毒载体,海军总医院黄晋生博士惠赠)和质料pRcTH(含人TH基因,由美国Somatix Therapy Corporation提供)构建新的质粒pLhTHSN。用限制性内切酶EcoRI酶切pRcTH,回收并纯化1.8 kb片段作为人TH(hTH)基因的插入片段。用限制性内切酶EcoRI酶切pLXSN,用适量的CIAP进行脱磷酸反应作为逆转录病毒载体。将5.8kb的载体DNA片段和1.8 kb的目的基因片段纯化后,两者按照1∶3~5的比例加入连接反应体系中,在T4 DNA连接酶作用(12℃,过夜)下进行连接反应,两者连接后可使hTH基因插入载体中。然后转化到XL1-Blue大肠杆菌感受态细胞。挑选转化后过夜生长的12个连接转化菌落,用煮沸法从中小量提取质粒DNA,并用限制性内切酶EcoRI、XhoI和BamHI进行酶切和电泳分析,以验证质粒是否携带hTH基因和其插入方向是否正确。经确认后,用碱裂解法大量提取质粒pLhTHSN以用于基因转移。
, http://www.100md.com
4.pLhTHSN质粒转染培养的人成纤维细胞
用含hTH基因的逆转录病毒载体pLhTHSN用磷酸钙沉淀法转染单向包装细胞系ψ-2,48h后收集含ψ-2细胞出芽的病毒颗粒的上清,感染双相包装细胞系PA317;用G418对PA317进行筛选,对形成的抗G418细胞克隆分别进行扩增培养,并用抗人TH的单克隆抗体进行细胞免疫组织化学染色;当抗性细胞表现为TH免疫组织化学染色阳性而表明有TH基因表达后,大量扩增培养,收集病毒上清;用整合有pLhTHSN的PA317细胞克隆产生的病毒上清感染人成纤维细胞,用抗人TH抗体进行免疫组织化学染色;经证实能表达TH后,将细胞大量扩增,制成细胞悬液用于微囊化处理和大鼠纹状体内移植。
5.微囊化转人TH基因的成纤维细胞
将转染的人成纤维细胞送301医院临床基础研究所,用微囊静电发生器进行微囊化处理,微囊为APA微囊[7]。
, http://www.100md.com
6.转入TH基因的成纤维细胞大鼠纹状体内移植
将PD大鼠模型作为宿主动物分为3组,微囊化人成纤维细胞移植组(Ⅰ组)和未微囊化人成纤维细胞移植组(Ⅱ组)各15只,空囊移植组(C组)8只作为对照组。3组动物均经腹腔注射6%水和氯醛(0.05ml/kg)麻醉,置于脑立体定位仪上,进行开颅手术。将上述转入TH基因的微囊化和未微囊化的人成纤维细胞,按照每只1×106的细胞数,分别为15μl和20μl细胞悬液,分两点立体定位注射到大鼠PD模型一侧脑内纹状体(尾壳核)内。在对照组的大鼠脑内移植空囊悬液。
7.行为学及形态学检测
在经相同方法进行移植后,术后动物分别存活2~16周。对上述3组植入不同移植物的动物按照不同的存活时间分成小组,所有动物都在术后按前述制作模型的方法进行旋转实验。根据不同的存活期灌杀动物,即经升主动脉先注入温生理盐水200ml,然后注入4℃含4%多聚甲醛的0.1mol/L磷酸缓冲液(pH7.4)250 ml;灌杀后立即取脑,置于含30%蔗糖的4%多聚甲醛中后固定24h后,进行冰冻连续切片(50μm),将切片分组后分别行TH,胶质细胞酸性蛋白(glial-fibrillary-acidic-protein,GFAP)和CD8免疫组织化学染色,即顺序将切片入分别用小鼠抗TH抗体(1∶1 000,Sigma公司)、GFAP抗体和单克隆小鼠抗T细胞CD8抗体(1∶100,DAKO公司)作为一抗、用生物素标记的羊抗鼠IgG抗体(1∶300,Vector公司)作为二抗和HRP标记的抗生物素复合物作为三抗的0.1mol/L磷酸缓冲液中,然后用含0.5%DAB的0.1mol/L磷酸缓冲液进行染色,以显示其免疫活性。染色后取部分切片进行焦油固紫复染。
, http://www.100md.com
结 果
1.逆转录病毒载体pLhTHSN的构建
用质粒pRcTH和pLXSN新构建出来的质粒pLhTHSN经酶切分析,显示其均带有TH基因(1.8kb);这些质粒用XhoI/BamHI双酶切分析,产生两个片段,即1.4kb和6.2kb,证明重组质粒中TH基因的插入方向是正确的。新构建的质粒图解见图1。

图1 新构建的质粒pLhTHSN基因图,其中TH基因插入方向正确
Fig.1 The gene map of the reconstructed plasmid pLhTHSN.
2.转基因成纤维细胞的基因表达
, 百拇医药
将新构建的逆转录病毒载体pLhTHSN导入培养的人成纤维细胞,2~3d后,TH免疫组织化学方法染色可见50%细胞被染成棕色(图2),显示有TH表达。
3.微囊化细胞的体外培养
经微囊包裹后,光镜下体外观察可见细胞存活(图3),细胞密度随培养时间增长;存活细胞中也可见细胞的重影和碎片,这主要发生在囊的中央。对微囊化细胞的TH染色在任何时间均呈阳性。

图2 pLhTHSN转染人成纤维细胞后的TH免疫细胞化学染色。↑示TH反应阴性细胞,其他均为TH反应阳性细胞 ×200
Fig.2 The immunocytochemical staining of TH in pLhTHSN transfected human fibroblasts. Arrows indicate TH-negative fibroblasts, the other fibroblasts are TH-positive. ×200

, http://www.100md.com
图3 微囊化转TH基因的人成纤维细胞 ×40
Fig.3 Microcapsulated TH-expressed human fibroblast.×40


图4 移植后PD大鼠模型脑切片。TH免疫细胞化学染色。
a. 微囊化转TH基因细胞移植组(Ⅰ组)的TH免疫细胞化学染色,术后存活2周。↑示微囊化的细胞。▲示微囊 ×200
b. 未微囊化转TH基因细胞移植组(Ⅱ组)的TH免疫细胞化学染色,术后存活16周。↑示移植物 ×100
Fig.4 Photomicrograph of the immunocytochemical staining of TH in the brain section of the PD rat model after transplantation.
, http://www.100md.com
a, The immunocytochemical staining of TH in microcapsulated TH-expressed human fibroblasts transplantation group(Ⅰ Group).The arrow indicates the microcapsulated fibroblasts. The triangle indicates the microcapsule. The post-transplantation time is 2 weeks.×200
b, The immunocytochemical staining of TH in non-microcapsulated TH-expressed human fibroblasts transplantation group(Ⅱ Group). The arrow indicates the graft. The post-transplantation time is 16 weeks.×100


, http://www.100md.com
图5 移植后PD大鼠模型脑切片CD8免疫细胞化学染色。
a.微囊化转基因细胞移植组(Ⅰ组)的CD8免疫细胞化学染色,术后存活2周。 ▲示微囊 ×100
b.未微囊化转基因细胞移植组(Ⅱ组)的CD8免疫细胞化学染色,术后存活2周。 ↑示移植物 ×100
Fig.5 Photomicrograph of the immunocytochemical staining of CD8 in the brain section of the PD rat model after transplantation.
a, The immunocytochemical staining of CD8 in microcapsulated TH-expressed human fibroblasts transplantation group(Ⅰ Group). The triangle indicates the microcapsule. The post-transplantation time is 2 weeks. ×100
, 百拇医药
b, The immunocytochemical staining of CD8 in non-microcapsulated TH-expressed human fibroblast transplantation group(Ⅱ Group). The arrow indicates the graft. The post-transplantation time is 2 weeks. ×100


图6 移植后PD大鼠模型脑切片GFAP免疫细胞化学染色。
a.微囊化转基因细胞移植组(Ⅰ组)的GFAP免疫细胞化学染色,术后存活4周。 ▲示微囊 ×100
b.未微囊化转基因细胞移植组(Ⅱ组)的GFAP免疫细胞化学染色,术后存活4周。↑示星型胶质细胞 ▲示移植物 ×100
, http://www.100md.com
Fig.6 Photomicrograph of the immunocytochemical staining of GFAP in the brain section of the PD rat model after transplantation.
a, The immunocytochemical staining of GFAP in microcapsulated TH-expressed human fibroblasts transplantation group(Ⅰ Group). The triangle indicates the microcapsule. The post-transplantation time is 4 weeks.×100
b,The immunocytochemical staining of GFAP in non-microcapsulated TH-expressed human fibroblasts transplantation group(Ⅱ Group). The arrows indicate the astrocytes. The triangle indicates the graft. The post-transplantation time is 4 weeks. ×100
, http://www.100md.com
4.动物行为的检测
实验动物Ⅰ组和Ⅱ组在移植手术后1周行为即有改变:Ⅰ组动物的旋转圈数由术前12.1圈/min(n=15)减少至3.7圈/min(n=15),持续到16周;Ⅱ组动物的旋转圈数由术前11.9圈/min(n=15)减少至5.6圈/min(n=13);C组动物的旋转圈数术前术后均为13.7圈/min(n=8)(图7)。

图7 PD动物模型脑内移植转基因成纤维
细胞前后单侧旋转测试
Fib.7 The rotation test of PD rat model
pre-and post-transplantation.
, 百拇医药
5.脑内移植物形态学检测
在动物不同存活期脑切片上可见:Ⅰ组动物脑内可见呈球形微囊轮廓的移植物,囊中有深棕色TH免疫反应的成纤维细胞(图4a),移植物周围(囊外)有TH免疫反应物质浸润;移植物细胞和浸润区的大体数量和范围在16周内无明显变化。Ⅱ组动物脑内移植物也呈深棕色TH免疫反应,周围也有TH免疫反应物质浸润,但随时间延长其表达下降,从第8周起范围明显减少,第16周时仅见少量(图4b),有时还出现坏死。C组动物脑内未出现TH阳性反应。Ⅱ组动物移植位点周围GFAP和CD8免疫反应相对较强烈,出现深棕色CD8阳性颗粒(图5b),GFAP阳性的星形胶质细胞多且明显(图6b);Ⅰ组动物和C组动物移植位点周围GFAP和CD8免疫反应相似,CD8阳性颗粒(图5a)和GFAP阳性细胞(图6a)数量和范围少于Ⅱ组动物。
讨 论
本研究是将能表达TH基因的pLhTHSN质粒转入人成纤维细胞,再经APA人工半透膜包囊后植入PD大鼠模型纹状体内。实验证明,它与未微囊化的转基因细胞一样能有效改善PD大鼠模型的不正常运动行为。不仅如此,微囊化的异种转TH基因细胞在脑内引起的免疫排斥反应比未微囊化的细胞小,预示其能存活和表达更长时间。因此可以认为,APA半透膜微囊包裹既对转基因细胞的营养无明显不利影响,又能在异体移植中对宿主的免疫排斥反应起隔离作用。
, http://www.100md.com
从以往研究[8,9]看,植入的微囊化细胞在体内的存活状况可能与某些因素有一些关系。其中靶细胞选择有一定的作用。有报道指出,成纤维细胞是一种广泛使用、适合于基因工程改造的供移植的细胞,即它易于获取、能够在体外培养、植入脑内不易形成肿瘤。本研究证明,在体内和体外不同的环境中,转入TH基因的成纤维细胞在微囊内皆存活良好,能较好表达TH活性。由此可知,成纤维细胞是一种可供临床基因治疗选择的运载细胞。
其次,移植位点选择也有一定影响。有报道说,当移植微囊化PC12细胞治疗PD时,移入侧脑室并无效果,而移入纹状体内则有明显效果[10],这说明囊内细胞分泌的物质必须扩散到靶组织中才有作用。本研究实验结果证实了微囊化转基因细胞可在纹状体内长期存活,可以明显改善动物模型的单侧旋转运动。但从切片看,其TH扩散程度有限。因此,多点、多量定位移植是使用微囊化细胞移植必需考虑的因素。
移植细胞的数量和体积直接影响到移植手术的复杂程度和移植物的存活度。大鼠中枢神经系统中神经活性物质的需求量相对较少,一般移植的细胞数目约为106~107个,因此从理论上讲,微囊技术更适用于中枢神经系统内的移植。本研究各组所移植的细胞数目基本相同(1×106),但由于微囊化后所占体积增大,因此移植物的体积比以往实验有所加大[11](20μl)。体积加大对脑组织的影响尚需进一步观察,但从本研究看,尚未见到其有显著影响。
, 百拇医药
尽管脑是免疫“豁免”部位,但这种“豁免”并不是绝对的[3]。本实验中未微囊化细胞组移植部位TH免疫反应细胞在第8周后显著减少,呈现一定的免疫排斥现象;而微囊化细胞组则未见明显排斥,这说明人工微囊确实起到了免疫隔离的作用。本研究显示微囊化组尽管比未微囊化组的免疫反应较弱,但仍然存有免疫反应。这表示微囊并不能做到绝对的免疫隔离。微囊对巨嗜细胞和其他免疫细胞所分泌的一些低分子量的物质,如对细胞具有非特异性毒性的细胞因子(10~30kD)、自由基、H2O2和NO等并不能起到隔离作用[12];微囊壁上的孔径并不均一,呈正态分布,部分小孔面积足以允许抗体和补体通过[13]。这些都会影响移植物在体内的长期存活,但微囊化后的异种细胞在植入脑内后遭受宿主的免疫排斥毕竟较小。
另外,还需进一步研究营养支持对微囊化转基因细胞的影响。Tomac等[14]曾报告,在脑内用胶质细胞源性神经营养因子(GDNF)对黑质纹状体多巴胺系统具有保护和恢复双重功能。已证实将牛嗜铬细胞与一种分泌NGF的细胞系一同微囊化后移植,可显著增加DA的释放,改善异常的旋转行为[15]。因此将来应考虑用转基因细胞和分泌生长因子的细胞一同微囊化后移植以实施基因治疗的战略。
, http://www.100md.com
无论如何,微囊化转基因细胞异体移植对PD动物模型的基因治疗显示了有价值的应用前景,这对基因治疗的临床应用具有重要意义。
本实验中微囊化处理得到了301医院临床基础研究所薛毅珑教授的大力帮助,谨致谢意。
本文图2~6见插图第8页
【基金项目】 国家自然科学基金国际合作项目
【作者简介】 戴晓玲(1972—),女(汉族),吉林市人,硕士,讲师
作者单位:郑少鹏(首都医科大学北京神经科学研究所,北京 100054)
参考文献
[1] During MJ, Naegele JK, O'Malley KL, et al. Long-term correction of rat model of Parkinsoniam rats by a HSV vector expressing tyrosine hydroxylase[J]. Science, 1994,226(5189):1399-1403.
, 百拇医药
[2] Jiao SS, Gurevich V, Wolff JA. Long-term correction of rat model of Parkinson's disease by gene therapy[J]. Nature, 1993,362(6419):450-453.
[3] Duan WM. Immunological and inflammatory responses against intrastriatal neural grafts in the rat[J]. Lund:Lund University,1997:20\|25.
[4] Winn SR, Aebischer P, Galletti PM. Brain tissue reaction to permselective polymer capsules[J]. J Biochmed Mater Res, 1989,3(1):31-44.
, 百拇医药
[5] Cenci MA, Kaien P, Mandel RJ, et al. Dopaminergic transplantation normalize amphetecmine and apomorphine-induced for expression in the 6-hydroxydopamine-lesioned striatum[J]. Neuroscience,1992,46(4):943-957.
[6] 王克权,张进禄,徐群渊,等.BIN-1型大鼠帕金森病旋转记录仪的研制[J].医疗设备信息,1995,10(4):1~3.
[7] Sagen J. Chromaffin cell transplantation. In:Lanza RP, Chick WL(eds). Yearbook of Cell and Tissue Transplantation[M]. Dordrecht:Kluwer Academic Press,1996:71-89.
, http://www.100md.com
[8] Aebischer P, Tresco PA, Winn SR, et al. Long-term cross-species brain transplantation of a polymer-encapsulated dopamine secreting cell line[J]. Experimental Neurology,1991,111(3):269-275.
[9] Hughes M, Vassilakos A, Andrews DW, et al. delivery of a secretable adenosine deaminase though microcapules-a novel approach to somatic gene therapy[J]. Human Gene Therapy,1994,5(12):1445-1455.
[10] Date I, Ohmoto T. Neural transplantation and trophic factors in Parkinson's Disease:special reference to chromaffin cell grafting NGF support from pretransected peripheral nerve and encapsulated dopamine-secreting cell grafting[J]. Experimental Neurology, 1996,137(2):333-344.
, 百拇医药
[11] 张进禄,徐群渊,刘玉军,等.转入LacZ基因的骨骼肌细胞大鼠脑内移植存活及基因表达的研究[J].解剖学报,1996,27:140~143.
[12] Wiegand F, Kroncke KD, Kolb-Bachofen V. Macrophage-generated nitric oxide as cytotoxic factor in destruction of alginate encapsulated islets[J]. Transplantation, 1993,56(5):1206-1212.
[13] Colton CK, Avgoustiniatos ES. Bioengineering in development of the hydrid artificial pancreas[J]. J Biomech Eng, 1991,113(2):152-170.
, 百拇医药
[14] Tomac A, Lindqvist E, Lin LF, et al. Protection and repair of the nigrostriatal dopaminergic system by GDNF in vivo [J]. Nature, 1995,373(6512):335-339.
[15] Winn SR, Tresco PA, Sagen J. Microencapsulated bovine chromaffin cells in vitro:effect of density and coseeding with a NGF releasing cell[J]. J Neur Trans Plastic, 1992,3(2-3):115-124.
【收稿日期】 1999-07-30
【修回日期】 2000-03-03, 百拇医药