rhIL-3影响K562细胞对阿糖胞苷敏感性的研究
http://www.100md.com
37c医学网
作者:王景昌 王庆余 周大柱 孙胜德 罗莉 张侃如 谢家印
单位:王景昌 周大柱 孙胜德 罗莉 张侃如(733000 甘肃省武威市,解放军第十医院内科);王庆余 谢家印(第三军医大学新桥医院血液科)
关键词:
中华血液学杂志000610 我们以前的研究表明,在体外重组人白细胞介素3(rhIL-3)能增强急性髓系白血病(AML)细胞对柔红霉素(DNR)的敏感性[1]。阿糖胞苷(Ara-C)是国际AML化疗的标准方案(DA方案)中的主要药物,且DNR和Ara-C对白血病细胞的作用机制不同。我们以AML细胞株K562细胞为模型,观察rhIL-3联合Ara-C对K562细胞集落(CFU-L)生长的影响,并通过3H-Ara-C掺入和测定白细胞分化抗原CD14、CD15表达,探讨其影响的机制和意义。
, 百拇医药
材料和方法
1 K562细胞株 引自重庆医科大学组织胚胎教研室。
2 试剂 rhIL-3,日本Kirin公司产品,活性1×108U/mg。盐酸阿糖胞苷,Upjoh公司产品。3H-Ara-C,Amersham公司产品,放射性活度925GBq/mmol。小鼠抗人单克隆抗体(单抗)CD14、CD15和异硫氰酸酯荧光素(FITC)标记的兔抗鼠抗体(二抗)均购自军事医学科学院。
3 K562细胞培养 K562细胞培养液为含体积分数为10%的小牛血清的RPMI 1640液。置细胞于37℃,体积分数为5%的CO2,饱和湿度条件下培养,每3~4d换液传代。换液时1500r/min离心5min,弃上清液,细胞数调至1×105/ml,10ml/瓶。细胞经多次传代后至指数生长且死细胞数<5%时进行实验。
, 百拇医药
4 液体悬浮培养 将指数生长期K562细胞调成5×105/ml细胞浓度悬液,以10ml/瓶为一体系,实验组加入rhIL-3,浓度分别调至10U/ml,100U/ml,1000U/ml;对照组不加rhIL-3,每组2瓶,置37℃,体积分数为5%的CO2及饱和湿度条件下培养2~3d。
5 3H-Ara-C掺入试验 将悬浮培养的K562细胞移入96孔培养板中,每孔0.2ml,加3H-Ara-C(100ng/ml)继续培养24h,收获在醋酸纤维膜上,用液闪仪测定各孔放射性核素每分钟闪烁计数(CPM)值,以3孔平均值作为3H-Ara-C掺入量。
6 细胞集落半固体培养及药敏试验 取液体悬浮培养的细胞,加入Ara-C(100ng/ml)后作用24h,按文献[2]方法进行CFU-L半固体培养,观察细胞集落产率情况,按液体悬浮培养时的分组分别计算集落产率。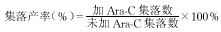
, 百拇医药
7 白血病细胞分化抗原表达测定 液体悬浮培养3d的K562细胞悬液离心弃上清,用PBA(PBS+体积分数为20%的小牛血清)洗2次,分别加入CD14、CD15单抗(一抗),4℃ 30min。用PBA洗2次,加入二抗,4℃ 30min。PBS洗2次后,用流式细胞仪检测1×104个细胞,设立阴性对照去除非特异性荧光,仪器用鸡红细胞作标准,激发波长488nm,发射波长525nm,数据经计算机处理,计算阳性细胞百分率。
结果
1 rhIL-3对3H-Ara-C掺入K562细胞的影响 经不同浓度rhIL-3作用后K562细胞内3H-Ara-C掺入值均明显高于未经rhIL-3处理的K562细胞内3H-Ara-C掺入值(P<0.05或P<0.01),并且CPM值的增高与rhIL-3的浓度呈剂量依赖关系(见图1)。
, 百拇医药
图1 rhIL-3对3H-Ara-C掺入K562细胞的影响
2 rhIL-3联合Ara-C对CFU-L生长的影响 rhIL-3+Ara-C组CFU-L产率为(18.33±4.21)%,单纯Ara-C组为(38.68±7.20)%,两组比较,差异有显著性意义(P<0.01)。
3 rhIL-3对K562细胞分化抗原表达的影响 K562细胞经rhIL-3作用3d,与对照组比较,细胞分化抗原CD14、CD15表达阳性率差异无显著性意义(P>0.05),见表1。
表1 rhIL-3对K562细胞分化的影响( ±s) 组别
±s) 组别
CD14阳性率(%)
, http://www.100md.com
CD15阳性率(%)
对照组
19.54±4.80
31.83±5.40
rhIL-3组
20.68±5.60*
34.96±8.70*
注:与对照组比较,*P>0.05讨论
白血病细胞存在较多非增殖期(G0)或慢增殖细胞,这些细胞的存在是白血病化疗失败和复发的重要原因之一[3]。我们曾以原代AML细胞体外培养为模型,证实rhIL-3具有刺激增加S期白血病细胞比例的作用[1]。Ara-C是已知作用于细胞S期的特异性药物。我们观察不同浓度rhIL-3作用后K562细胞3H-Ara-C掺入情况,结果显示,经不同浓度rhIL-3刺激后,K562细胞内3H-Ara-C掺入率较对照组增加近0.5~1.5倍。进一步半固体CFU-L培养的结果表明,rhIL-3联合Ara-C作用后,CFU-L产率比对照组显著减低。CD14、CD15为表达于较成熟的粒-单核细胞表面的抗原,观察K562细胞CD14、CD15的表达可从一个方面了解细胞的分化情况,我们的测定结果显示,rhIL-3(100U/ml)对K562细胞CD14、CD15表达阳性率无明显影响,提示在本实验条件下,rhIL-3对K562细胞无诱导分化作用,因此认为rhIL-3(100U/ml)与Ara-C联合可增强K562细胞对Ara-C的敏感性。其机制可能是rhIL-3刺激后使G0期或慢增殖的白血病细胞进入S期,从而有利于Ara-C掺入细胞DNA,加速白血病细胞死亡。
, http://www.100md.com
参考文献
1,王景昌,王庆余. rhIL-3增强急性髓系白血病细胞对柔红霉素敏感性的研究. 中华血液学杂志,1999,20:30-32.
2,Boekhorst PA,Lowerberg B, Sonneveld P. Enhanced chemosensitivity in acute myeloid leukemia by the haematopoietic growth factor:a comparison of MTT assay with a clonogenic assay. Leukemia, 1993,7:1637-1644.
3,Greenberg ML, Chanana AD, Cronkite EP. The generation time of human leukemic myeloblasts. Lab Invest,1972,26:245-252.
(收稿日期:1999-05-17), 百拇医药
单位:王景昌 周大柱 孙胜德 罗莉 张侃如(733000 甘肃省武威市,解放军第十医院内科);王庆余 谢家印(第三军医大学新桥医院血液科)
关键词:
中华血液学杂志000610 我们以前的研究表明,在体外重组人白细胞介素3(rhIL-3)能增强急性髓系白血病(AML)细胞对柔红霉素(DNR)的敏感性[1]。阿糖胞苷(Ara-C)是国际AML化疗的标准方案(DA方案)中的主要药物,且DNR和Ara-C对白血病细胞的作用机制不同。我们以AML细胞株K562细胞为模型,观察rhIL-3联合Ara-C对K562细胞集落(CFU-L)生长的影响,并通过3H-Ara-C掺入和测定白细胞分化抗原CD14、CD15表达,探讨其影响的机制和意义。
, 百拇医药
材料和方法
1 K562细胞株 引自重庆医科大学组织胚胎教研室。
2 试剂 rhIL-3,日本Kirin公司产品,活性1×108U/mg。盐酸阿糖胞苷,Upjoh公司产品。3H-Ara-C,Amersham公司产品,放射性活度925GBq/mmol。小鼠抗人单克隆抗体(单抗)CD14、CD15和异硫氰酸酯荧光素(FITC)标记的兔抗鼠抗体(二抗)均购自军事医学科学院。
3 K562细胞培养 K562细胞培养液为含体积分数为10%的小牛血清的RPMI 1640液。置细胞于37℃,体积分数为5%的CO2,饱和湿度条件下培养,每3~4d换液传代。换液时1500r/min离心5min,弃上清液,细胞数调至1×105/ml,10ml/瓶。细胞经多次传代后至指数生长且死细胞数<5%时进行实验。
, 百拇医药
4 液体悬浮培养 将指数生长期K562细胞调成5×105/ml细胞浓度悬液,以10ml/瓶为一体系,实验组加入rhIL-3,浓度分别调至10U/ml,100U/ml,1000U/ml;对照组不加rhIL-3,每组2瓶,置37℃,体积分数为5%的CO2及饱和湿度条件下培养2~3d。
5 3H-Ara-C掺入试验 将悬浮培养的K562细胞移入96孔培养板中,每孔0.2ml,加3H-Ara-C(100ng/ml)继续培养24h,收获在醋酸纤维膜上,用液闪仪测定各孔放射性核素每分钟闪烁计数(CPM)值,以3孔平均值作为3H-Ara-C掺入量。
6 细胞集落半固体培养及药敏试验 取液体悬浮培养的细胞,加入Ara-C(100ng/ml)后作用24h,按文献[2]方法进行CFU-L半固体培养,观察细胞集落产率情况,按液体悬浮培养时的分组分别计算集落产率。
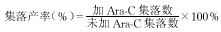
, 百拇医药
7 白血病细胞分化抗原表达测定 液体悬浮培养3d的K562细胞悬液离心弃上清,用PBA(PBS+体积分数为20%的小牛血清)洗2次,分别加入CD14、CD15单抗(一抗),4℃ 30min。用PBA洗2次,加入二抗,4℃ 30min。PBS洗2次后,用流式细胞仪检测1×104个细胞,设立阴性对照去除非特异性荧光,仪器用鸡红细胞作标准,激发波长488nm,发射波长525nm,数据经计算机处理,计算阳性细胞百分率。
结果
1 rhIL-3对3H-Ara-C掺入K562细胞的影响 经不同浓度rhIL-3作用后K562细胞内3H-Ara-C掺入值均明显高于未经rhIL-3处理的K562细胞内3H-Ara-C掺入值(P<0.05或P<0.01),并且CPM值的增高与rhIL-3的浓度呈剂量依赖关系(见图1)。

, 百拇医药
图1 rhIL-3对3H-Ara-C掺入K562细胞的影响
2 rhIL-3联合Ara-C对CFU-L生长的影响 rhIL-3+Ara-C组CFU-L产率为(18.33±4.21)%,单纯Ara-C组为(38.68±7.20)%,两组比较,差异有显著性意义(P<0.01)。
3 rhIL-3对K562细胞分化抗原表达的影响 K562细胞经rhIL-3作用3d,与对照组比较,细胞分化抗原CD14、CD15表达阳性率差异无显著性意义(P>0.05),见表1。
表1 rhIL-3对K562细胞分化的影响(
 ±s) 组别
±s) 组别CD14阳性率(%)
, http://www.100md.com
CD15阳性率(%)
对照组
19.54±4.80
31.83±5.40
rhIL-3组
20.68±5.60*
34.96±8.70*
注:与对照组比较,*P>0.05讨论
白血病细胞存在较多非增殖期(G0)或慢增殖细胞,这些细胞的存在是白血病化疗失败和复发的重要原因之一[3]。我们曾以原代AML细胞体外培养为模型,证实rhIL-3具有刺激增加S期白血病细胞比例的作用[1]。Ara-C是已知作用于细胞S期的特异性药物。我们观察不同浓度rhIL-3作用后K562细胞3H-Ara-C掺入情况,结果显示,经不同浓度rhIL-3刺激后,K562细胞内3H-Ara-C掺入率较对照组增加近0.5~1.5倍。进一步半固体CFU-L培养的结果表明,rhIL-3联合Ara-C作用后,CFU-L产率比对照组显著减低。CD14、CD15为表达于较成熟的粒-单核细胞表面的抗原,观察K562细胞CD14、CD15的表达可从一个方面了解细胞的分化情况,我们的测定结果显示,rhIL-3(100U/ml)对K562细胞CD14、CD15表达阳性率无明显影响,提示在本实验条件下,rhIL-3对K562细胞无诱导分化作用,因此认为rhIL-3(100U/ml)与Ara-C联合可增强K562细胞对Ara-C的敏感性。其机制可能是rhIL-3刺激后使G0期或慢增殖的白血病细胞进入S期,从而有利于Ara-C掺入细胞DNA,加速白血病细胞死亡。
, http://www.100md.com
参考文献
1,王景昌,王庆余. rhIL-3增强急性髓系白血病细胞对柔红霉素敏感性的研究. 中华血液学杂志,1999,20:30-32.
2,Boekhorst PA,Lowerberg B, Sonneveld P. Enhanced chemosensitivity in acute myeloid leukemia by the haematopoietic growth factor:a comparison of MTT assay with a clonogenic assay. Leukemia, 1993,7:1637-1644.
3,Greenberg ML, Chanana AD, Cronkite EP. The generation time of human leukemic myeloblasts. Lab Invest,1972,26:245-252.
(收稿日期:1999-05-17), 百拇医药