青少年肥胖和糖代谢异常与PPARγ2基因多态性的相关性研究
 |
【摘要】 目的 探讨青少年肥胖和糖代谢异常与过氧化物酶增殖物活化受体γ(PPARγ)基因Pro12Ala多态性的相关性,为探讨肥胖病因和预防控制肥胖提供理论依据。方法 选择北京市东城区14~17岁初中生955名,进行身体测量、血糖测定和Pro12Ala多态性检测。结果 Pro12Ala等位基因突变率(P>A)为6.7%;Pro12Ala基因型及等位基因频率在体重正常、超重和肥胖3组间差异无统计学意义(P>0.05);重度肥胖(BMI≥30 kg/m2)青少年与体重正常者比较,基因型构成和等位基因频率差异有统计学意义(P<0.05);肥胖组中不同基因型的BMI、腰臀比、腰围和腰围身高比水平差异存在统计学意义(P<0.05),分性别比较,仅发现肥胖组男生Ala等位基因携带者这些指标水平较高(P<0.05);肥胖组空腹血糖异常组Ala频率要高于空腹血糖正常组(P<0.05)。结论 Pro12Ala等位基因突变率与已有汉族人群研究结果相近,其多态性与肥胖有关,与肥胖的协同作用可能导致糖代谢异常。男生Ala等位基因携带者更易发生中心型肥胖,提示性别可能有一定的效应修正作用。
【关键词】 多态性,单核苷酸;基因;肥胖症;葡萄糖代谢障碍;青少年
【中图分类号】 R 151.1 R 589.1 Q 987 【文献标识码】 A 【文章编号】
肥胖是一种营养代谢性疾病,是由能量的摄入和消耗不平衡造成的,已经成为影响我国儿童青少年健康的重要公共卫生问题。肥胖者常伴有脂代谢、糖代谢紊乱和高血压等,这种聚集现象被称为代谢综合征(MS),是成年期心血管疾病发生的重要危险因素,二者可能存在共同的多基因遗传基础。过氧化物酶增殖物活化受体γ(peroxisome proliferator activated receptorγ, PPARγ)是肥胖导致胰岛素抵抗的重要转录因子之一,在脂肪细胞分化过程中起着关键作用,并参与脂代谢相关基因的表达调控。自从1997年Yen等[1]在PPARγ2 基因中发现了Pro12Ala多态性以来,国内外有很多研究针对不同人群探讨PPARγ2基因Pro12Ala多态性与肥胖和代谢综合征的关联,结论尚不确定[2-4]。为了解我国青少年肥胖、糖代谢与该基因位点的相关性,笔者对北京地区955名青少年进行了研究,为探讨肥胖和糖代谢异常的遗传机制以及预防控制肥胖提供依据。
1 对象与方法
1.1 对象 采用整群抽样法,从北京市东城区9所中学选择955名14~17岁初中生为研究对象[5],其中体重正常170名,超重400名,肥胖385名;男生612名,女生343名。根据既往检查资料和询问病史,剔除患心血管及内分泌疾病的青少年。
1.2 方法
1.2.1 身体测量及超重、肥胖的判定 对所有研究对象进行身高、体重、腰围、臀围的测量,测量方法参照《2000年中国学生健康与体质调研检测细则》进行。根据测量结果,计算身体质量指数(BMI)、腰臀比(WHR)、腰围身高比(WHtR)。超重、肥胖的判定采用中国肥胖问题工作组制定的“中国学龄儿童青少年超重、肥胖BMI筛查分类标准”。参考孟玲慧等[6]提出的北京市3~18岁人群的腰围(WC)适宜界值为性别年龄组的第80百分位值,腰围身高比(WHtR)的适宜界值为0.46,以此作为中心型肥胖的界值点。
1.2.2 血糖测定 由专职人员采清晨空腹(禁食12 h)静脉血3 mL,于室温下凝固离心后,用HITACHI 7060型自动生化分析仪测定空腹血糖(FPG),采用氧化酶-过氧化物酶法。应用国际糖尿病协会2005年指定的代谢综合征标准,判定儿童青少年血糖水平是否异常[7]。
1.2.3 PPARγ2基因Pro12Ala多态性检测 采用常规酚/氯仿法从血凝块中提取DNA。参考文献[8],用聚合酶链反应限制性片段长度多态性(PCR-RFLP)分析方法,对PPARγ2基因Pro12Ala多态性进行检测。PCR引物由北京奥科生物技术公司合成。正向引物序列为5’-CAAGCCCAGTCCTTTCTGTG-3’,反向引物序列为5’-AGTGAAGGAATCGCTTTCAG-3’PCR反应体系为25 μL,Taq聚合酶1U。PCR扩增条件为: 94 ℃预变性5 min,接着进行94 ℃变性30 s,62 ℃退火30 s,72 ℃延伸30 s共30个循环,最后72 ℃延伸5 min。PCR产物用5U限制性内切酶MspⅠ于37 ℃过夜酶切。酶切产物用EB染色的2.5%琼脂糖凝胶电泳进行基因型鉴定,3种基因型酶切产物分别为野生纯合型(CC)(224bp,43bp)、突变杂合型(CG)(267bp,224bp,43bp) 及突变纯合型(GG)(267bp)。
1.2.4 统计学分析 用EpiData软件建立数据库,采用双录入方法进行数据输入和检错。用SPSS 13.0软件进行Hardy-Weinberg平衡检验、χ2检验、t检验等。
2 结果
2.1 PPARγ2基因Pro12Ala多态性发生情况
2.1.1 PPARγ2基因Pro12Ala多态性发生情况 955名初中生中,832名(87.1%)为野生纯合型(PP),118名(12.4%)为突变杂合型(PA),5名(0.5%)为突变纯合型(AA)。PPARγ2基因Pro12Ala等位基因突变率(P>A)为6.7%。因AA纯合基因型发生较少,故在下面的分析中将PA和AA基因型数据合并。
2.1.2 Hardy-Weinberg平衡检验 Hardy-Weinberg平衡是指在一个大的相对稳定的群体中,变异率保持不变,各种基因型频率也将代代保持不变,成为遗传平衡的群体。本研究对不同营养状况组PPARγ2基因Pro12Ala多态性进行Hardy-Weinberg平衡检验, P值分别为:体重正常组0.35,超重组0.84,肥胖组0.89(均大于0.30,符合Hardy-Weinberg平衡定律)。
2.2 肥胖与PPARγ2基因Pro12Ala多态性的相关性
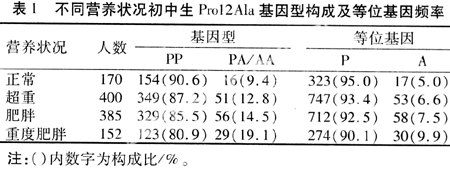
2.2.1 比较各组Pro12Ala基因型和等位基因频率 根据BMI将学生分为不同营养状况组,结果发现体重正常、超重和肥胖组青少年Pro12Ala基因型及等位基因频率差异无统计学意义(P>0.05),但是PA/AA基因型频率以及A等位基因频率存在一定的趋势:肥胖组>超重组>体重正常组。进一步对体重正常与重度肥胖(BMI≥30 kg/m2)青少年进行比较,基因型构成和等位基因频率差异具有统计学意义(P<0.05),重度肥胖者中A等位基因携带者较多,见表1。
分别以孟玲慧等[6]研究提出的腰围(WC)分性别和年龄的P80以及腰围身高比(WHtR)的界值0.46分组,比较WC较高和较低组以及WHtR较高和较低组的基因型构成和等位基因频率,差异无统计学意义(P>0.05)。
2.2.2 比较Pro12Ala不同基因型之间肥胖指标水平 分别在体重正常、超重和肥胖组比较不同基因型的肥胖指标BMI,WHR,WC和WHtR水平,发现肥胖组中不同基因型的BMI,WHR,WC和WHtR水平差异均存在统计学意义(P值均<0.05),Ala等位基因携带者各肥胖指标水平较高,而体重正常组和超重组中不同基因型的各肥胖指标水平差异无统计学意义(P>0.05)。分性别比较后发现,肥胖组男生Ala等位基因携带者的BMI,WHR,WC和WHtR水平高于非携带者(P值均<0.05),女生不同基因型各指标水平差异则无统计学意义(P值均>0.05),见表2。, 百拇医药(郭旭君 王海俊 马 军 尹遵栋 潘勇平)