辽宁省原料药生产企业新版GMP认证检查缺陷分析与对策
药品,培训,1辽宁省原料药生产企业实施新版GMP认证情况概述,2缺陷项目描述与分析,1质量控制与质量保证方面,2文件管理方面,3物料与产品方面存在的缺陷项目及分析,4确认与验证方面,5厂房与设施设备方面,6
张春蕾,刘智勇,田丽娟(.沈阳药科大学工商管理学院,沈阳 006;.辽宁省药品认证中心,沈阳 0003)原料药的质量会直接影响到制剂的质量,确保原料药的安全是保证药品安全的基础。按照《药品生产质量管理规范(2010年修订版)》(简称“新版GMP”)的要求组织生产,有利于提高原料药的质量,保障药品安全。新版GMP于2011年3月1 日起正式施行,其对原料药生产企业的软、硬件系统提出了更高的要求,同时也规定了明确的期限,即到2015 年12 月31日前所有原料药生产企业必须通过新版GMP 认证[1],逾期未达到要求的企业(车间)将不得继续从事药品生产。
截至2013 年10 月,我国共有原料药生产企业1 761 家[2],其中通过新版GMP认证的仅有333家(共核发420张证书)[3],占企业总数的18.91%。大部分企业因经营状况问题、重视程度不够或处于改造中尚未申请认证。对于有能力实施改造的企业来说,尽快通过新版GMP认证是关系到企业生存发展的头等大事。本文回顾性分析了辽宁省原料药生产企业在新版GMP 认证检查中发现的缺陷项目,并对所存在的缺陷项目进行了归纳、概括与分析,以为企业尽快通过新版GMP认证提供参考。
1 辽宁省原料药生产企业实施新版GMP 认证情况概述
根据辽宁省药品认证中心提供的新版GMP认证进程、企业认证现场检查不合格项目情况等资料表明,2011 年3 月至2013年12月辽宁省共有12家非无菌原料药生产企业(16个品种)申请新版GMP认证,经过技术审查和行政审批,12家企业均通过了认证(核发16张证书)。但在对这些企业进行认证检查的过程中发现,共存在161个缺陷项目,其中严重缺陷0个、主要缺陷3个、一般缺陷158个。缺陷项目的具体分布情况见表1。
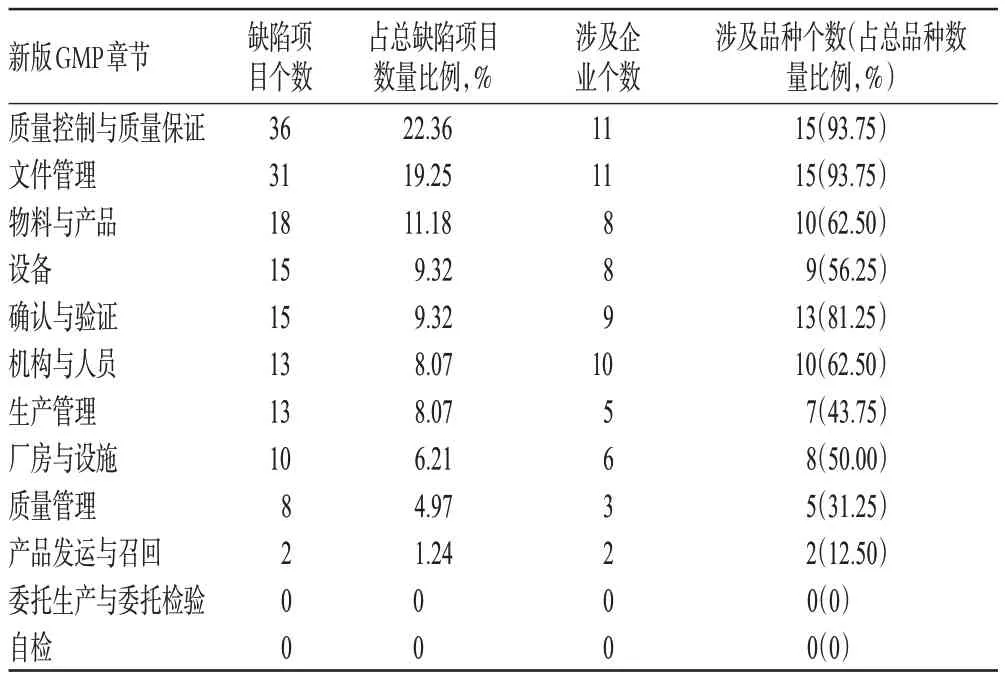
表1 辽宁省原料药生产企业新版GMP认证检查中的缺陷项目分布Tab 1 The distribution of defects items about the inspection of new GMP in API manufacturers in Liaoning province
由表1 可见,缺陷主要集中在质量控制与质量保证、文件管理、物料与产品等项目;其次为设备、确认与验证、机构与人员等项目;产品发运与召回的缺陷项目较少;委托生产与委托检验、自检等项目无缺陷项 ......
您现在查看是摘要页,全文长 9630 字符。