美国和欧盟的罕用药研发激励政策对比研究与启示Δ
资格,资助,上市,1美国和欧盟罕用药研发激励的立法沿革,2美国和欧盟罕用药研发激励的具体措施比较,3美国和欧盟的罕用药研发激励效果比较,4美国和欧盟罕用药研发激励政策对我国的启示
杨 莉,田丽娟,林 琳(沈阳药科大学工商管理学院,沈阳 110016)·药事管理·
美国和欧盟的罕用药研发激励政策对比研究与启示Δ
杨 莉*,田丽娟,林 琳(沈阳药科大学工商管理学院,沈阳 110016)
目的:为构建和完善我国的罕用药研发激励政策提供参考和建议。方法:从罕用药的立法沿革、研发罕用药的激励措施与效果方面对美国和欧盟的罕用药研发激励政策进行对比,并为我国完善相关政策提供建议。结果与结论:美国与欧盟的罕用药激励政策分别始于1983年美国《罕用药法案》与1999年欧盟《罕用药管理规范》,之后通过不断完善,形成了较为完备的体系。美国与欧盟在罕用药的认定标准、认定程序、具体激励措施(研发资助、税收减免、费用减免、微型与中小企业额外激励、市场独占、特殊审批程序)等方面有所差异,如在费用减免方面,美国对处方申请费用、生产费用和药物确认费用进行减免,而欧盟对协议帮助费用、初始和后续要求费用,审批前的检查费用和首次上市申请费用依类型按一定比例进行减免。罕用药激励政策推行后,其资格认定数量及上市数量大幅增加、微型与中小型企业成为罕用药研发的生力军、研发投资涵盖各类疾病治疗领域、罕用药研发成为药物创新和生物技术发展的主要方向。我国应该尽快确定罕用药研发激励的相关立法、设立罕用药的资格认定、从多方面入手完善罕用药研发激励具体措施,同时加强与其他国家在罕用药资格认定和研发激励方面的合作。
罕用药;研发激励;美国;欧盟;对比;研究
罕用药由于临床研究开展困难、研发成本难以收回等因素成为许多医药企业不愿意涉足的领域。目前,世界上超过35个国家都推行并实施了不同程度的罕用药研发激励政策[1]。美国和欧盟作为世界上对罕用药研发激励最为倾斜的两个国家(地区),是许多学者研究的对象,但是针对这两个国家(地区)的罕用药研发激励政策的对比研究较少。因此,在本研究中,笔者从罕用药的认定、立法、具体措施以及实施效果等多方面对美国和欧盟的罕用药研发激励政策进行对比研究,以期为我国罕用药研发激励政策的构建和完善提供建议。
1 美国和欧盟罕用药研发激励的立法沿革
1983年1月4日,美国颁布并实施了《罕用药法案》,开启了通过立法对罕用药进行研发激励之门。1999年,欧盟委员会颁布了《罕用药管理法规》,鼓励欧盟的医药企业进行罕用药的研发,该法于2000年4月28日正式实施。美国和欧盟罕用药研发激励立法比较见图1。
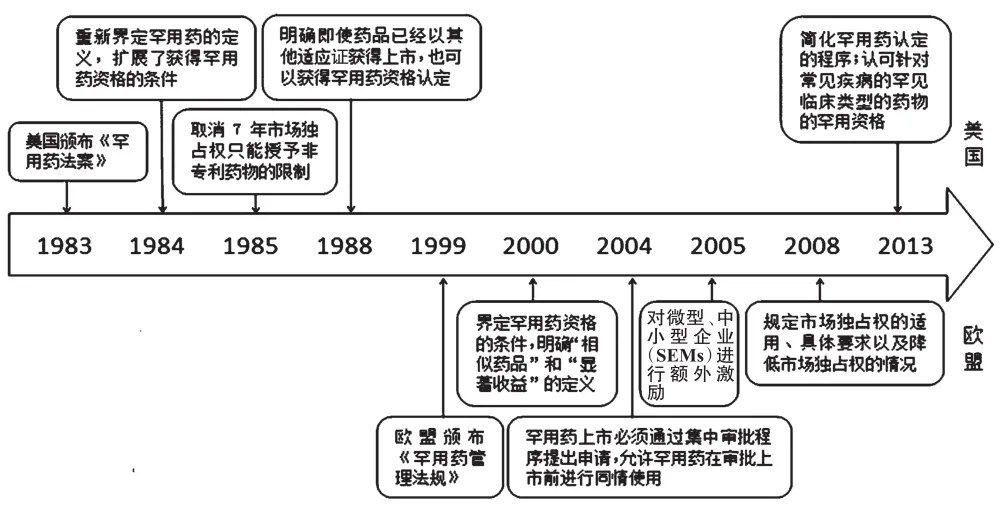 ......
......
您现在查看是摘要页,全文长 22181 字符。