我院2009年药品不良反应报告分析
 |
| 第1页 |
参见附件(846KB,2页)。
药品不良反应(adverse drug reactions,ADR)是指合格药品在正常用法用量下出现的与用药目的无关的或意外的有害反应。世界卫生组织(WHO)的统计资料表明,ADR发生率为5%~20%,住院患者又有10%~15%发生ADR。2009年我院药品不良反应监测站共收到有效报表83例,现对83例ADR报表进行汇总分析。
1资料与来源
对我院2009年收集的83例药品ADR报告表进行详细登记,内容包括:报告日期、报告科室、患者姓名、性别、出生日期、可疑药物、ADR症状、报告人、ADR级别等。
2结果
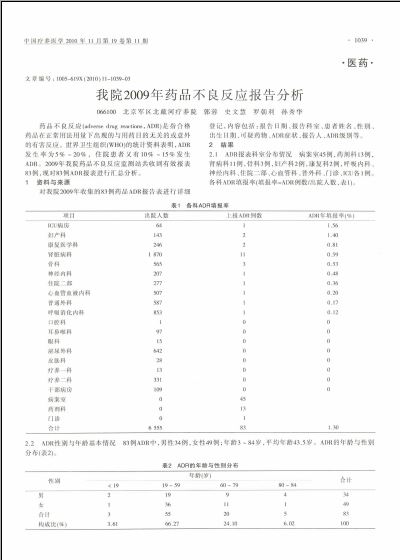
2.1ADR报表科室分布情况病案室45例,药剂科13例,肾病科11例,骨科3例,妇产科2例,康复科2例,呼吸内科、神经内科、住院二部、心血管科、普外科、门诊、ICU各1例。各科ADR填报率(填报率=ADR例数/出院人数,表1)。
2.2ADR性别与年龄基本情况83例ADR中,男性34例,女性49例;年龄3~84岁,平均年龄43.5岁。ADR的年龄与性别分布(表2)。
2.3给药途径静脉滴注48例,占57.83%;口服32例,占38.55%;其他3例(硬膜外给药1例、肌内注射2例),占3.62%。
2.4过敏史及合并用药既往用药过敏史7例(占8.43%),合并用药8例(9.64%)。
2.5程度分级及预后一般48例,严重32例,新的3例。对原患疾病的影响:不明显的64例,病程延长8例,病情加重10例,导致后遗症1例。需要对症治疗的60例,仅停药无特殊处理的23例。不良反应的预后:治愈57例,好转9例,有后遗症17例。
2.6因果关系评价采用WHO的不良反应因果关系评定标准,分肯定、很可能、可能、可疑4个等级进行评价。可能81例、肯定2例,均是再次用药后再次出现。由于ADR可能危及患者生命安全,不能重复给药进行验证,故多数上报者对ADR评定为可能。
2.7致ADR药物分布情况中药制剂31例,占37.35%;抗感染药物30例,占36.14%;心血管系统用药6例,占7.23%;解热镇痛药3例,占3.61%;其他13例,占15.66%(表3)。
3讨论
3.1科室上报情况为了加大药品不良反应监测力度,我院今年重新制订了《药品不良反应监测工作制度》,各科室设立了药品不良反应监察员,从上报的情况看,ADR上报仍有漏报、瞒报情况,其中病案室上报的45例均为科室漏报后,病案室查阅病历后发现补报。《药品不良反应监测工作制度》第5章第16条规定:各临床科室药品不良反应的年度报告数量不少于本单位收容患者总数的1%。从表1可看出,我院大部分临床科室没有达标,只有ICU病房和妇产科超过1%,个别科室填报率为0。各临床科室应重视和加强ADR监测工作的重要性,积极认真填报ADR,ADR监督员要履行职责,对工作中发现的ADR应协助填写并及时上报。
3.2发生ADR分布情况由表2可以看出,不同年龄、性别的个体对药物的吸收、分布、代谢、排泄是不同的。83例ADR中,女性比男性更易发生ADR,各年龄均有分布,主要以中青年患者为多,可能与该年龄段人群压力较大且持续亚健康状态而导致患病几率增加、用药机会较大有关。3.3发生ADR的给药途径83例ADR中静脉滴注引发的ADR占总数的57.83%,其由于药物直接进入血液循环,故静脉注射液的pH值、渗透压、不溶性微粒、内毒素等都可能成为引发ADR的因素。口服药物的ADR发生率仅次于静脉给药,为32例,占38.55%。临床在设计给药方案时应充分考虑患者情况,针对其病症选择适当的给药途径,能够口服或肌肉注射者尽量不采用静脉滴注,以避免严重ADR的发生。
3.4发生ADR的药品83例ADR中,涉及43种药品,引起ADR的药品以中药制剂为多,有31例,占ADR总数的37.35%。近两年来,随着中药制剂在临床的广泛应用,我院中药制剂的ADR出现较大幅度的增加。中药治病注重辨证及用法用量,剂量的大小应根据阴阳偏盛偏衰的程度,因证而定,因方而别,因人而异,因地因时制宜;并根据病情的变化而调整剂量,若用量过大或用药时间过长,就会出现不良反应。临床药学室通过对我院中药注射剂在临床使用过程中的调查发现,有过度用药和剂量偏大现象,这也是造成中药制剂不良反应发生的重要原因之一。抗感染药物引起的ADR有30例,占ADR总数的36.14%,从一个侧面说明我院抗菌药物应用较为普遍,同时不排除滥用抗菌药物情况。使用抗感染药物应按照《抗菌药物临床应用指导原则》,严格掌握用药指征,切实做到合理使用。
3.5ADR引起的不良反应类型从表4可以看出,以泌尿系统引起的ADR比例最高,其次为皮肤系统反应。泌尿系统中多数为院外发生的严重ADR,原因为我院作为全军肾病中西医结合治疗单位,在当地以致全国均有一定知名度,来我院就医后发现药物性肾损害的患者较多有关 ......
您现在查看是摘要介绍页,详见PDF附件(846KB,2页)。