不同浓度人参皂苷RG3对高转移卵巢癌细胞集落形成及细胞形态的影响(2)
 |
 |
 |
 |
 |
 |
Key words: human high-metastasis; ovarian neoplasms; H0-8910PM cell line; ginsenoside Rg3; cell colony-forming efficiency; morphocytology
卵巢癌是常见的妇科肿瘤之一,目前发病率居第5位但致死率高居首位,且发病率仍有逐年上升的趋势[1]。70%的患者在确诊时已为病情晚期,虽大部分患者在正规治疗后疾病暂时缓解,但仅不足40%患者能够被治愈[1]。近年来,中医中药及中西医结合的综合治疗日益受到人们的重视。实验已证实人参皂苷可调节乳腺癌、白血病和肝癌等细胞株的增殖与凋亡[2-4]。本研究通过细胞集落形成率和细胞形态这两个观察指标,来分组观察不同浓度的人参皂苷Rg3(Ginsenoside Rg3)对高转移人卵巢癌细胞系H0-8910PM的体外增殖抑制和损伤作用,以期为Rg3进一步应用于卵巢癌的辅助治疗提供实验依据。
1材料和方法
, http://www.100md.com
1.1材料
1.1.1细胞系采用浙江省肿瘤医院建立的高转移人卵巢癌细胞系H0-8910PM[5],细胞系按常规体外传代,每周传代或换液2次。
1.1.2药物参一胶囊(Rg3):由吉林亚泰制药有限公司提供纯度为99.9%的Rg3制剂, 批准文号:国药准字Z20030044。
1.1.3仪器设备CO2培养箱 HERAEUS B5060EU(德国);万能倒置显微镜JMT-2(日本Olympus);H-600型电子显微镜(日本日立公司);
1.2 方法
1.2.1 细胞培养H0-8910PM细胞用含超级新生牛血清的完全培养液培养于37℃、5%的CO2培养箱中,细胞呈悬浮生长,在倒置显微镜下观察细胞达到一定数量时于超净台内进行传代,具体步骤参见文献[6]。
, 百拇医药
1.2.2 实验分组将细胞用随机数字表法随机分成6组: ①空白对照组:只加新鲜的全培养液;②低浓度Rg3组:含10μg/mL Rg3培养液;③中浓度Rg3组:含20μg/mL Rg3培养液;④中高浓度Rg3组:含30μg/mL Rg3培养液;⑤高浓度Rg3组:含40μg/mL的培养液。每次实验均在相同条件下重复4次。
1.2.3 检测细胞集落形成率 取对数生长期的细胞,将细胞制成1000个/mL的细胞悬液,按组别不同取0.4~0.7mL(400~700个细胞/孔)不等,置6孔培养板中,再加5mL培养液。37℃、CO2培养箱中培养48h后弃去原培养液。按组别加入不同浓度Rg3的药液,再培养24h,弃去药液用HK液洗2次后换入常规培养液,继续培养7~10天。取出后用HK液洗、甲醇固定液固定10 min后瑞氏染色。经重复实验后,在显微镜下观察其集落形成率。由50个以上细胞组成的细胞团,计为1个集落。
细胞集落形成率按以下公式计算:细胞集落形成率(CFE) =(每孔形成的集落数/ 每孔接种的细胞数)×100%
, 百拇医药
1.2.4Rg3对细胞形态的影响 分别用倒置显微镜和透射电镜观察不同浓度Rg3的药液作用48h后的5组细胞的形态。光镜标本用95%酒精固定盖片,H.E染色后在Olympus显微镜下观察。电镜标本经消化打落贴壁细胞,用PBS液洗、2.5%戊二醛固定、1%锇酸固定、丙酮梯度脱水、环氧树脂浸透、包埋、超薄切片、以铀、铅双重染色法染色,在日立H-600型电子显微镜下观察形态改变并拍照。
1.3 统计学处理
各组之间的比较采用随机区组设计资料的方差分析,数据由SPSS 15.0统计学软件包进行分析。如P<0.05被认为差异有统计学差异。
2结 果
2.1Rg3对H0-8910PM细胞集落形成率的影响
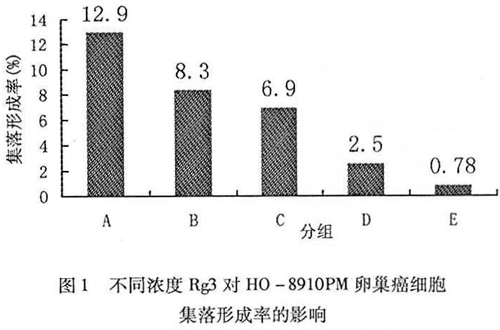
不同浓度的5组细胞经单因素分析发现随着Rg3浓度的升高,细胞集落形成率逐渐而下降, 5组之间比较差异有统计学意义(F=176.362,P=0.000),见图1。
, 百拇医药
经Tukey HSD多组变量随机区组分析显示:空白对照组与任何浓度Rg3组比较差异均有统计学意义(P=0.000,0.000,0.000,0.000)。低浓度组与中高浓度Rg3两组细胞集落形成率结果相近(8.3% Vs 6.9%),差异无统计学意义(P=0.133)。中高浓度组与高浓度Rg3两组细胞集落形成率均很低(2.5% Vs 0.78%),差异无统计学意义(P=0.057)。低浓度组、中高浓度组分别与中高浓度组、高浓度组比较,差异均有统计学意义(P=0.000,0.000,0.000,0.000)。
2.2Rg3对H0-8910PM细胞生长影响
2.2.1光镜观察 空白对照组细胞排列紧密,边界清楚,核分裂多见,部分细胞重叠生长。低浓度组细胞细胞排列较紧密,边界较清楚,核分裂多见,与A组相比差别不明显。中浓度组细胞排列开始稀疏,边界尚清楚,核分裂相减少,核固缩渐增多,胞浆内出现有空泡变性。中高浓度组细胞排列更加逐渐稀疏、边界较模糊,核分裂相更加减少,核固缩明显增多,胞浆内多见空泡变性。高浓度组细胞生长十分稀疏,细胞不完整,核固缩现象多见,胞浆内多量空泡变性,出现部分细胞胞膜破损现象。
, 百拇医药
2.2.2电镜观察 空白对照组细胞完整,细胞表面有丰富微绒毛,细胞内各细胞器清楚,有较多的粗面内质网、线粒体、分泌颗粒,可见凝集的异染色质,核膜凹陷呈不规则状,核大、多个核仁清楚可见,部分靠近核膜;核分裂较多见,充分显示卵巢癌细胞恶性特征,见图2。
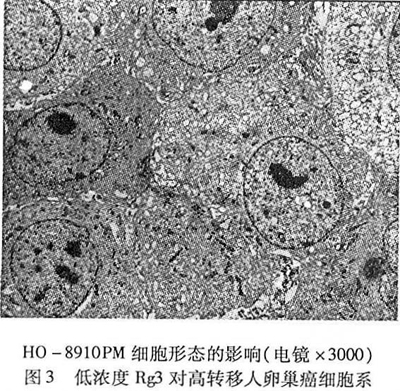
低浓度组细胞形态和结构与空白对照组细胞比较改变不明显,细胞完整,细胞表面有丰富微绒毛,细胞内各细胞器清楚,基质清晰,核仁清楚,核分裂较多见,见图3。
中浓度组细胞边界尚清楚,细胞表面微绒毛逐渐减少,细胞器开始模糊,胞浆内出现空泡,出现泡状内质网,线粒体间隙开始增大,核分裂相减少,核固缩渐增多,见图4。
中高浓度组细胞表面微绒毛继续减少,细胞器模糊不清,胞浆内有较多空泡形成,泡状内质网增多,线粒体间隙继续增大,部分胞浆区域变空,核染色质稀疏,核结构部分破坏,见图5。
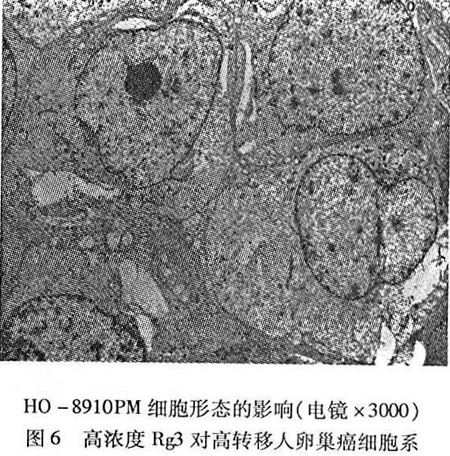
, 百拇医药 高浓度组细胞细胞形态改变明显,细胞表面微绒毛基本消失,细胞器模糊不清且明显减少,胞浆内多个较大的空泡形成,有较多的泡状内质网,线粒体间隙增大明显,胞浆中部分区域变空甚至胞质溶解,核染色质稀疏,核结构破坏或核裂解,核变空,见图6。
3讨 论
卵巢癌发病率高,难以早期诊断,导致中晚期患者比例升高;且手术化疗后容易产生耐药、复发和转移,病死率极高。因此选择一种或几种有效的辅助治疗药物以提高疗效显得尤为必要。近年已利用肺癌、肝癌、前列腺癌、头颈部等肿瘤模型发现人参皂苷Rg3可能抑制肿瘤细胞的增殖,抑制肿瘤细胞Ca2+内流,抑制肿瘤细胞粘附、浸润和转移,抑制肿瘤血管生成等[7-12],但其机制尚未完全明确。
本实验发现,空白对照组与其余任何浓度Rg3组比较细胞集落形成率均有差异,表明无论浓度高低Rg3对高转移人卵巢癌细胞系H0-8910PM均有体外抑制作用,Rg3的单独用药是有效的。浓度不同的5组细胞随着Rg3浓度的升高,细胞集落形成率逐渐而下降。药物浓度和细胞集落形成率成反比也显示了一定的药物剂量依赖性。但低浓度与中高浓度Rg3两组细胞集落形成率结果相近,中高浓度与高浓度Rg3两组细胞集落形成率结果也相近,差异均无统计学意义;表明10~20μg/mL Rg3,30~40μg/mL Rg3两个分段各自浓度对细胞抑制作用的影响不大。但10~20μg/mL Rg3,30~40μg/mL Rg3两个分段进行比较发现差异均有统计学意义,表明Rg3浓度30μg/mL以上会比20μg/mL以下发挥更强的细胞抑制作用,Rg3的抑制作用与剂量浓度有关。细胞集落形成率是体外抗癌药物敏感性测定主要方法之一,是反映癌细胞中具有增殖活性的干细胞的增殖能力的指标。而干细胞是肿瘤治疗中的主要靶细胞,对于干细胞的抑制作用比单纯抑制其他非干细胞更有意义。细胞集落形成率的下降表明细胞群体中干细胞比例减少,产生了对肿瘤细胞的抑制增殖作用。, 百拇医药(陈 鲁 钱丽娟 顾琳慧 马胜林 朱笕青)