细胞活性检测方法优化(2)
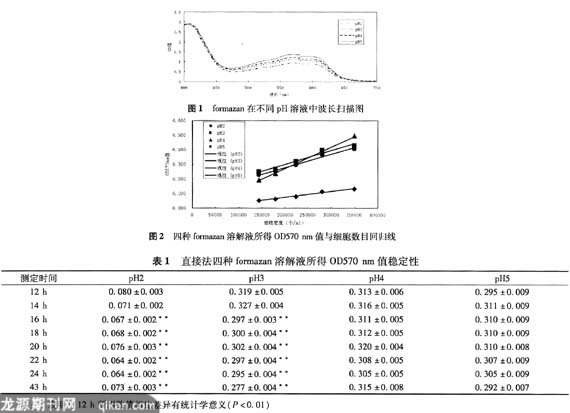 |
利用SPSS统计软件对四种formazan溶解液所得溶液的稳定性进行了分析(表1),从表中可以看出,当溶解液的pH值为2、3时,溶液16 h后测定与12 h测定所得数值有显著性差异,而当溶解液的pH值为4、5时,溶液43 h测定与12 h后测定所得数值无显著性差异。
3 讨论
现行的MTT法其关键的问题是MTT的代谢产物formazan为不溶于水的结晶物,通常在加入有机溶剂前需吸净全部的培养基,这不仅操作较为繁琐,而且也容易产生一定的实验误差,同时对悬浮生长细胞的应用也起到一定的限制。本文在前人工作的基础上,对MTT法做了进一步的探索,使其更适于在不吸出培养基的情况下溶解formazan。首先,通过对不同pH值下RPMI-1640培养基(含10%胎牛血清,0.5 mg/ml MTT)进行波长扫描,发现要消除培养基对吸收值的影响,要使溶解液的pH值小于等于5。这是因为酚红在pH大于5时在560 nm左右有吸收峰。因此我们确定formazan溶解液的pH值必须小于等于5,才能消除培养基带来的干扰。
其次,对不同formazan溶解液下所得溶液进行全波长扫描,得出以下结论:formazan溶解液没有改变formazan的吸收特性,所得溶液在570 nm左右都有一个比较宽的吸收峰,因此决定在570 nm进行检测。
最后,通过对不同formazan溶解液所得溶液与相应数目细胞的相关性分析,和所得溶液的稳定性分析。发现当formazan溶解液的pH值在4~5时,灵敏度最高、相关性最好、溶液最稳定。
MTT法作如上改进有如下优点:可使用普通培养基,无需特别选购无酚红无血清培养基;formazan溶解完全,溶解液稳定;细胞数量与光吸收值线性关系良好;本底低,灵敏度高,稳定性好。
参考文献
[1] 张平,章崇杰,刘杰,等.改良MTT法检测自然杀伤细胞的活性.华西医科大学学报,1996,27(2):213-215.
[2] Kawada K,Yonei T,Ueoka H,et al.Comparison of chemosensitivity tests:clonogenic assay versus MTT assay.Acta Med Okayama,2002,56(3):129-134.
[3] 唐亚辉.人类肿瘤化疗药敏检测方法的研究现状.江西中医学院学报,2000,12(3):142.
[4] Abe S,Kubota T,Matsuzaki SW,et al.Chemosensitivity test is useful in evaluating the appropriate adjuvant cancer chemotherapy for stang Ⅲ non-scirrhous and scirrhous gastric cancers.Anticancer Res,1999,19(5C):4581-4586.
[5] Bhuvanesh Singh,Rongou Li,Li Xu,et al.Prediction of survival in patients with head and neck cancer using the histoculture drug response assay.Head Neck,2002,24(5):437-422.
[6] 刘民,马华,李柏青.MTT法检测小鼠淋巴细胞增殖性反应探讨.中国实验动物学杂志,1999,9(3):146-149.
[7] 边兴艳,杨明燕,张英.改良MTT比色法测定淋巴细胞增殖反应.吉林医学院学报,1997,17(2):28-29.
[8] 安飞云,廖春华,边寰峰.改良MTT法检测G2细胞增殖的研究.毒理学杂志,2006,20(3):186-188., 百拇医药(薄华本 邵红伟 胡凌波 黄树林)