核糖体S6K蛋白激酶(2)
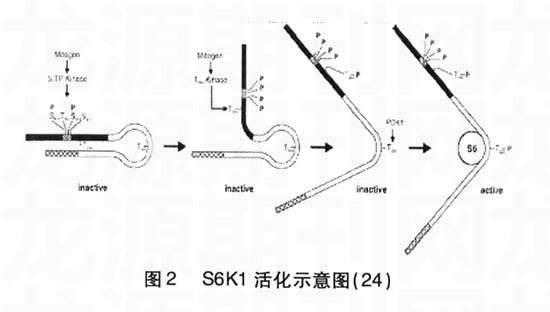 |
2.3其他调节位点尽管上述结论使我们建立了一个p70S6K蛋白活化基本模型,但针对细胞内具体活化步骤仍存在有许多疑点。由于缺失掉羧基末端的p70S6KΔC104突变体仍对激酶活化和Thr389磷酸化具有严格的调控作用,这说明还存在有其他调节位点在S/T-P缺失的情况下控制Thr389磷酸化。因为AGC家族成员中多数含有与Thr389同源的位点,且在此位点周围有一些保守结构域(2),为此人们确定出一个新位点,即Ser371(4).Ser371位点的+1位和-2位上也分别有一脯氨酸和疏水性氨基酸残基,尽管其不能自身磷酸化,但他却可潜在性的调节激酶氨基末端,催化区域和自主抑制区间的相互作用(4)。实际研究中发现,将Ser371突变为谷氨酸或者天冬氨酸可封闭掉Thr389磷酸化和激酶活性,却并不影响Thr229的磷酸化(4),这可能是因为Ser371的突变打破了铰链区对Thr389和Thr229磷酸化水平的正常调节功能。要想使有关p70S6K蛋白激酶活化机制的描述更加精确,Ser371和Ser404位点在级联模型中的作用更加具体,更多的实验需要我们作进一步研究。
2.4S6K2磷酸化因为S6K2蛋白在调控区域和磷酸化位点上与S6K1高度同源,有研究估计S6K1的活化机制可能也适用于S6K2 ......
您现在查看是摘要页,全文长 4472 字符。